多釩硼氧簇化合物水熱合成實驗
孫瑞卿, 黃夢夢, 陳義平
(福州大學 化學學院, 福州 350116)
0 引 言
無機-有機雜化材料由于其獨特的分子結構和多樣性的電子結構,在催化、生物化學、藥物及新材料領域具有廣泛的應用前景,受到科研工作者的關注[1-5]。多釩硼氧簇化合物是雜化材料中金屬氧簇化合物的一個重要分支。利用水熱法[6-10]合成的多釩硼氧簇化合物,釩氧間的配位方式有VO4四面體、VO5四角方錐和VO6八面體等,硼氧間的配位方式有BO4四面體、BO3平面三角形等, 釩氧多面體(VOn)和硼氧多面體(BOn)間通過共頂點、共棱或共面的方式形成了結構豐富的多釩硼氧簇化合物。
相比于其他合成晶體的方法,水熱法具有操作簡單、反應時間自由、能夠一步合成目標產物的優點,并且目標產物缺陷較少、形狀規則。當然,水熱法也存在一定的局限性,還沒有形成穩定、通用的規律,可分析和利用的熱力學數據不足;水熱法有時無法按照設計方案獲得預期的理想產物,還存在轉化率低且雜質含量高的問題。
本文設計多種實驗方案,探索不同條件下水熱合成多釩硼氧簇化合物的特點,并利用X-射線單晶衍射法確定化合物的結構,利用紅外光譜對化合物進行表征,探討結構與性能的關系,從而總結出適合實驗教學的多釩硼氧簇化合物水熱合成實驗過程。
1 實 驗
1.1 化合物的合成
1.1.1[enH2]2[Mn(H2O)2]2[V12B16O50(OH)8(H2O)0.5]·4(H2O)化合物1的合成
稱取原釩酸鈉(Na3VO4·12H2O) 0.217 6 g,硼酸(H3BO3)0.500 0 g,醋酸錳(Mn(CH3COO)2·4H2O)0.200 0 g,乙二胺(en)0.2 mL,放入25 mL內襯聚四氟乙烯的不銹鋼水熱反應釜中,再加入4.0 mL蒸餾水攪拌30 min使其完全溶解,滴加氨水調節pH 8.58左右,置于160 ℃的恒溫箱中反應96 h,取出后自然冷卻至室溫,經過抽濾、洗滌得到棕黃色類似正方形狀的化合物1(按釩計算產率約56%)。
1.1.2[Zn(en)0.5(H2O)]6[V12B18O54(OH)6(OH)]·3(OH)化合物2的合成
稱取偏釩酸銨(NH4VO3)0.175 5 g,硼酸(H3BO3)0.25 g,醋酸鋅(Zn(CH3COO)2·2H2O)0.329 3 g,2,2聯吡啶0.156 2 g,放入25 mL內襯聚四氟乙烯的不銹鋼水熱反應釜中,再加入4.0 mL蒸餾水攪拌30 min使其完全溶解,滴加乙二胺調節pH 8.68左右,置于140 ℃的恒溫箱中反應120 h,取出后自然冷卻至室溫,經過抽濾、洗滌得到棕黃色化合物2(按釩計算產率約為70%)。
1.2 結構的確定
X-射線單晶衍射法是目前測定單晶結構最常用且有效的方法。利用Rigaku R-Axis-Parid Weissenberge IP衍射儀,在293 K溫度下,采用石墨單色化的Mo靶Kα射線(λ=0.710 73×10-10)以ω-2θ掃描方式對本文所合成的化合物進行晶體晶胞參數和衍射強度的測定。選擇I>2σ(I)的獨立衍射點,用 SHELXL-97程序[11]對單晶數據進行解析,確定化合物的結構。
1.3 紅外光譜表征
紅外光譜是一種基于分子振動的光譜,不同的化學鍵或官能團具有特定的振動吸收峰,因此,紅外光譜是分析化合物結構的有效輔助方法,也是研究金屬氧簇化合物的性質與結構關系的常用方法之一[12]。利用 Thermo Scientific Nicolet iS50 FT-IR儀器,以KBr為背景,在400~4 000 cm-1范圍內,對化合物掃描32次,得到化合物的紅外光譜圖。
2 結果與討論
2.1 化合物的結構特征
化合物1屬于單斜晶系,C2/C空間群,不對稱單元如圖1所示。

對稱操作符: a. (1-x,y,0.5-z); b. (0.5+x,-0.5+y,z);c. (-0.5+x, 0.5+y,z)
化合物以[V12B16O58]16-簇單元為主體,[V12B16O58]16-簇單元由一個V12籠和兩條B8O20鏈組成,其中V12籠由12個VO5四方錐以共棱的形式連接形成扭曲開放的籠狀,B8O20鏈由2個B4O11基礎單元構成,B4O11由3個BO4四面體和1個BO3三角形橋連而成。兩條B8O20鏈通過V-O-B鍵橋連嵌入V12籠的空隙中,形成一個閉合的籠。化合物中V存在兩種價態,4價和5價,通過BVS價鍵[13]計算可得V原子的平均價態為4.333 (V(IV)∶V(V)=2∶1)。
化合物1是有機-無機雜化形成的多酸化合物,它是由[Mn(H2O)2]2+與[V12B16O58]16-簇陰離子間通過金屬-氧(Mn-O)鍵作用構成,兩個Mn2+分別與每個簇單元中B8O20鏈上的兩個氧原子配位,同時還與兩個水分子配位,呈現出八面體的六配位方式,經platon計算其孔隙率為20.0%。[V12B16O58]16-簇單元通過Mn-O鍵及乙二胺與B8鏈上的氫鍵作用形成了二維層狀結構(見圖 2)。層間通過氫鍵作用形成三維結構,氫鍵如表1所示。O30為與硼原子相連的端氧,O2,O9,O4,O8是與釩原子相連的端氧。
化合物2屬于三方晶系,R-3空間群,不對稱單元如圖3所示。
化合物2是以V12B18為構筑主體的零維結構的化合物,且具有較大的孔洞結構,經platon計算,得出其孔隙率為22.1%。V12B18由兩個V6環和一個B18環組合而成,兩個V6環通過V-O-B鍵分別連接在B18環的上、下方,從而形成V6-B18-V6夾心結構。V6環由6個四方錐形的VO5共邊相連構成,B18環由6個B3O7共頂點連接而成,一個平面三角形的BO3和2個四面體形的BO4組成一個B3O7單元。每個[V12B18O60]14-簇單元中的B18鏈通過Zn-O鍵與6個Zn配位,同時Zn原子還通過Zn-N鍵或Zn-O鍵與en或H2O分子相連接,但en和H2O占有率各為0.5,6個[Zn(en)0.5(H2O)]2+在V12B18簇單元外,圍成一個圓圈,V12B18簇單元位于其圓圈的中心。化合物2中的V仍是混合價態,通過BVS價鍵[13]計算可得V原子的平均價態為4.333 (V(IV)∶V(V)=2∶1)。從圖4可以看出,化合物2通過[Zn(en)0.5(H2O)]2+與[V12B18O60]14-簇陰離子橋連作用及乙二胺或水與簇陰離子間的氫鍵作用構成,氫鍵如表2所示,O1與O4均為與釩原子相連的端O,相對于化合物1,化合物2的氫鍵較少。

圖2 化合物1二維層狀結構
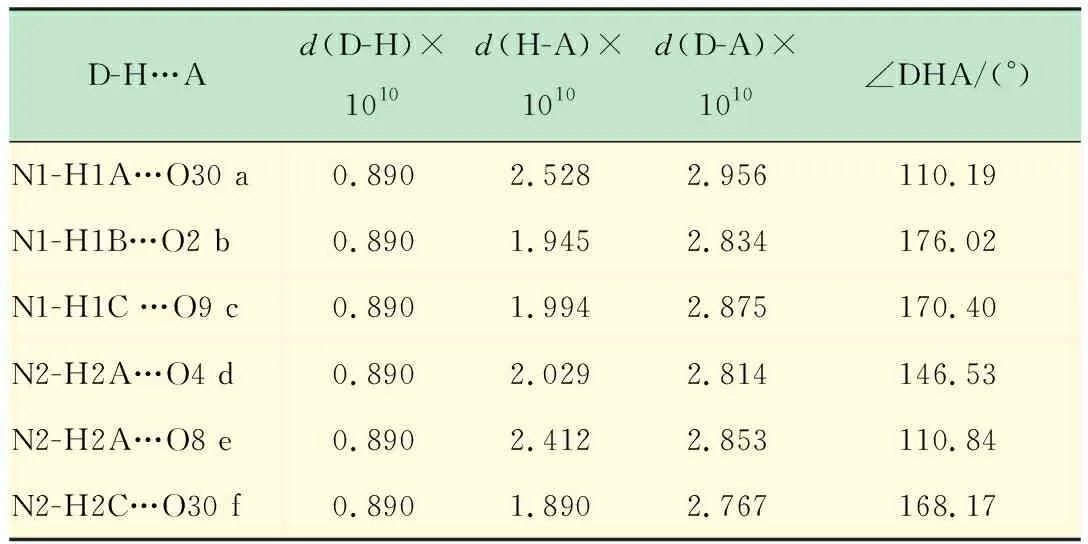
表1 化合物1部分氫鍵列表
對稱操作符: a. (-x+2, -y+1, -z+1); b. (x, -y+1,z+1/2);c. (-x+3/2, -y+3/2, -z+1);d. (-x+1,-y+1, -z+1);e. (-x+3/2, -y+3/2, -z+1);f. (x, -y+1,z+1/)

圖3 化合物2的不對稱單元圖(省略氫原子和孤立的水分子)
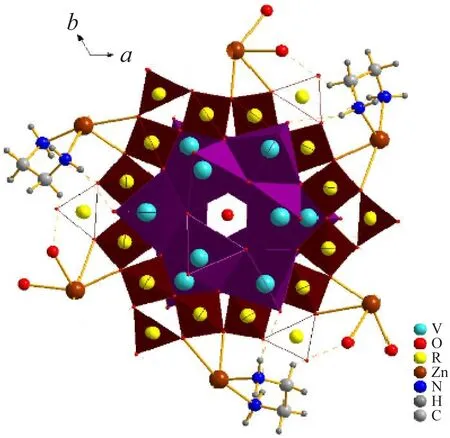
圖4 化合物 2堆積圖

表2 化合物2部分氫鍵列表
對稱操作符: a. (-x+1, -y+1, -z+1); b. (x-y+1,x, -z+1,1/3-z); c. (-x+y, -x+1,z)
2.2 化合物的紅外光譜
如圖5所示,由于化合物1和2均含有乙二胺配體和水,因此分別在3 403 cm-1和3 428 cm-1左右出現νas(O—H)吸收峰,又因氫鍵的影響,峰出現了寬化;乙二胺中νas(N—H) 尖吸收峰分別出現在3 162、3 339 cm-1附近,化合物1中,乙二胺與水分子及V12B16簇間形成強烈的氫鍵導致vas(N—H)向低波數偏移。1 623和1 632 cm-1處出現的峰分別歸屬于兩個化合物的δ(O—H)振動吸收峰。B原子在兩個化合物中均存在兩種不同的配位方式,但因所形成的籠不同,故峰位略有移動,平面三角形的BO3中的νas(B—O)吸收峰在化合物1中出現在1 344 cm-1處附近,化合物2中則在1 355 cm-1,而BO4中的νas(B—O)吸收峰在兩化合物中分別出現在1 038和1 065 cm-1,同樣ν(V=Ot)吸收峰分別在930和951 cm-1,化合物1中 乙二胺與V12B16簇釩端氧間形成強烈的氫鍵,導致ν(V=Ot)向低波數偏移,且峰形寬;化合物1中795 cm-1和化合物2中796 cm-1處的吸收峰歸屬于νas(V—Oμ)反對稱伸縮振動吸收峰。而化合物1中711 cm-1附近νs(V—Oμ)被簇單元的骨架振動吸收峰所掩蓋,化合物2中νs(V—Oμ)位于718 cm-1處,表3對兩化合物主要化學鍵的紅外振動吸收峰進行了歸納。
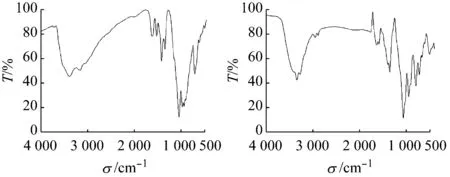
(a) 化合物1(b) 化合物2

表3 化合物1,2部分紅外振動吸收峰
注:a. 四配位的B; b. 三配位的B
3 實驗條件
3.1 釩源和硼源
實驗中,嘗試的釩源樣品有:Na3VO4、NaVO3、NH4VO3以及VOSO4和V2O5。采用氧化物V2O5為釩源,通常不能與其他原料完全反應,即便完全反應,最終得到的產物也都是粉末,無法得到理想的晶體,這與V2O5水溶性差、化學性質穩定有關。同樣采用硫酸氧釩(VOSO4)作釩源,與其他原料通過水熱反應最后得到的大部分也是粉末。文獻報道的釩氧簇合物大多采用偏釩酸銨作為釩源[14],可能是因為銨根離子本身顯酸性,對溶液體系的pH產生一定的影響,本實驗合成得到的化合物2的釩源也采用偏釩酸銨,化合物1采用Na3VO4作釩源。
實驗中嘗試用到的硼源有:H3BO3、Na2B4O7·10H2O、BLiO2和B2O3。采用B2O3作為硼源,與其他原料水熱反應后,最終得到的產物是黑色的粉狀固體,同樣與B2O3的水溶性差以及化學性質穩定有關。
通過篩選不同類型的釩源、硼源,多次調整實驗方案,發現采用硼酸作為硼源、釩酸鹽作為釩源較易合成得到形狀規則、尺寸適中的多釩硼氧簇化合物單晶,與有關文獻報道相吻合[14]。本實驗獲得的兩個化合物均采用硼酸作為硼源、釩酸鹽作為釩源。
3.2 反應體系pH
反應體系的pH對多酸化合物的合成具有較大影響,在不同的pH范圍內,釩酸鹽存在形式不同[15],如圖6所示。
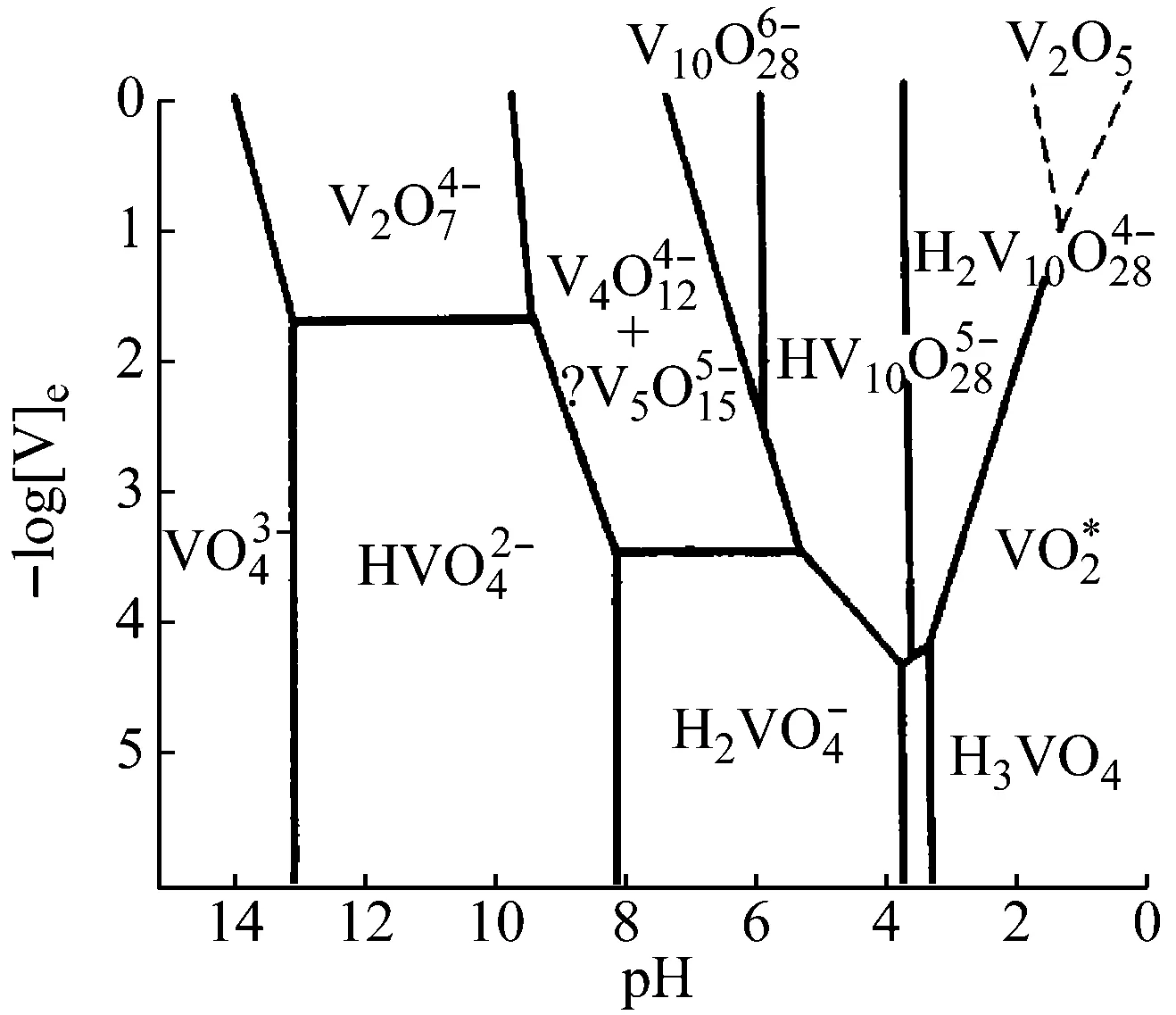
圖6 釩氧陰離子與pH的關系
pH值不僅影響金屬離子的沉淀情況,也對有機物的水解有一定的影響。本文經過實驗探索,采用NaOH、NH3·H2O、1,2-dap(1,2-丙二胺)、en(乙二胺)、dien(二亞乙基三胺)、HAc來調控反應溶液的pH值,表明在pH 8.00~9.10左右,較易合成得到多釩硼氧簇化合物單晶,且獲得的晶體形狀規則、尺寸適中。本文兩個化合物的反應溶液pH分別為8.58和8.68。
3.3 模板劑
模板劑會影響水熱合成化合物的結構。實驗過程分別引入多種有機胺作為模板劑,如1,2-dap、en、dien、DMF(二甲基甲酰胺)、2,2-dpy(2,2-聯吡碇),也嘗試同時引入兩種不同類型的有機胺作為模板劑,以期合成得到新型多釩硼氧簇化合物,但實驗結果并不理想,只有乙二胺較易參與多酸化合物的配位,這與相關文獻報道相符。化合物1中的乙二胺處在簇單元外,化合物2中的乙二胺與金屬離子鋅配位。實驗結果顯示,有機模板劑不僅可以調節溶液體系的pH值,而且還可以修飾多釩硼氧簇單元的結構。
3.4 溫度和時間
反應溫度與水熱體系的反應程度和反應平衡的移動有關,合適的反應溫度不僅可以提高目標產物的轉化率,同時合成得到的化合物晶形也較好。不同的反應時間影響晶核的成長速度以及它們的成型。
在探索溫度對化合物合成的影響時,實驗從120~190 ℃設置溫度梯度,每間隔10 ℃為一個梯段,研究不同溫度梯度下化合物的形成情況。結果表明,在不同的溫度下,合成得到的化合物的晶形和數量有明顯的差別,最適合化合物合成的溫度是120~180 ℃(化合物1合成溫度160 ℃,化合物2為140 ℃),如果溫度超過180 ℃,得到的產物多是黑色粉末或者無法合成出目標化合物。
不同的反應時間直接影響晶體的成型速度。經過實驗嘗試,合成的反應時間在3~6 d內,化合物成形較好,形狀規則,且尺寸適中。反應時間少于3 d,成核晶體數少且多數形狀不規則;超過7 d,晶體之間容易發生晶形的轉變。
4 結 語
水熱合成是一個能較快得到目標產物的方法,同時又是一個非常復雜的過程,它受到很多因素的影響:例如原料、反應物濃度、pH值、模板劑、反應時間、反應溫度以及加入的金屬陽離子等[16]。到目前為止,多釩硼氧簇化合物都是采取水熱合成法獲得,但由于影響水熱合成的因素復雜,缺乏可靠的實驗設計方案指導,所以仍需進行文獻調研,不斷總結實驗經驗,探索新穎化合物的合成條件和合成方案。本文綜合研究實驗原料、有機模板劑、pH值和反應溫度等控制因素,經過多種實驗方案設計,篩選出適合本科生綜合實驗教學和研究生實驗教學的多釩硼氧簇化合物的合成過程、結構表征、譜學研究等。
本文實驗可以進一步拓展,利用X-射線粉末衍射(XRD)、元素分析(EA)、紫外光譜、熱重分析等對化合物進行更多譜學性質的研究,探討化合物結構與性能的關系,在培養學生查閱文獻、設計實驗方案、合成目標化合物的創新能力和實驗操作技能基礎上,指導學生確定化合物的結構并進行性能測試,進一步拓展學生操作使用大型儀器設備的能力和綜合分析問題、解決問題的能力,為本科生準備畢業論文或研究生進行科研實驗提供良好的綜合訓練。

