KIBRA基因多態性對健康年輕志愿者海馬亞區體積影響的研究
梁雪,王芳芳,王坤,張慶雷,吳思楚,青釗,張鑫,李茗,張冰
作者單位:
南京大學醫學院附屬鼓樓醫院,醫學影像科,南京 210008
基因學研究表明腎腦表達蛋白(kidney and brain expressed protein,KIBRA) rs17070145位點基因與人類記憶功能密切相關[1]。雖然先前研究認為KIBRA作為一種突觸后支架蛋白,涉及囊泡運輸、轉錄的調節和突觸發生等過程[2],但其確切潛在神經機制還并不清楚。研究表明KIBRA的多態性對記憶功能影響與海馬的結構和功能變化有密切的聯系[1,3-4]。功能磁共振研究顯示CC純合子攜帶者與T基因攜帶者間海馬功能激活程度存在差異[1,3],結構磁共振研究結果顯示T基因攜帶者較非T基因攜帶者海馬體積增大[5-6],并且在健康老年人中的研究顯示CA2和CA4/齒狀回海馬亞區的體積也有差異[6]。這些研究中,大部分研究對象都是西方人群,對中國漢族人群的研究還較少。目前發現一篇功能磁共振關于KIBRA基因多態性和腦默認網絡及執行網絡影響的研究[7],還有一篇磁共振擴散峰度成像的研究[8]。但還未見關于磁共振海馬亞區研究的報道。因此,本研究采用磁共振海馬亞區體積自動分割方法,研究KIBRA基因多態性對健康年輕人海馬亞區體積的關系。
1 材料與方法
1.1 研究對象
本研究志愿者入組標準:(1) 20~30歲;(2)中國國籍;(3)漢族;(4)右利手;(5)無神經及精神系統疾病;(6)無腦創傷、藥物及酒精依賴史或其他可能影響腦結構與功能的疾病;(7)無MR檢查禁忌證。本研究經過南京鼓樓醫院倫理委員會批準,所有志愿者均自愿參加實驗,在實驗前簽署知情同意書。
根據上述入組標準,共招募志愿者63名,其中由于3名缺少血液樣本及基因型數據被排除;最終60名志愿者納入本研究。
1.2 基因分型
所有被試均留取外周靜脈血約2 ml,ED-TA抗凝,-80℃冰箱存儲。利用EZgeneTM血液gDNA小量提取試劑盒,從1 ml全血中提取受試者的基因組DNA,應用聚合酶鏈反應(polymerase chain reaction,PCR)-連接酶檢測反應(ligation detection reaction,LDR)的方法[9-10],檢測受試者KIBRA基因rs17070145位點C/T等位基因多態性;一共分為3種基因型:C/C、C/T和T/T。根據不同基因型將受試者分成兩組,一組為C等位基因攜帶者(包括C/C和C/T),另一組為TT純合子攜帶者。
本研究中60名志愿者中,有2名C/C純合子,21名C/T雜合子和37名T/T純合子,其中CC純合子分布頻率為3.3%,TT純合子分布頻率為61%,與先前研究相似[7-8],并且基因分布頻率也符合Hardy-Weinberg分布(χ2=0.22,P=0.64)。KIBRA基因多態性由于rs17070145位點由T突變為C所致,基因型分組實際情況是按照KIBRA等位基因在人群中的比例來劃分的。由于國內CC純合子攜帶者在人群中的比例較小,TT純合子攜帶者比例較大,而西方人群CC純合子攜帶者在人群中的比例約為50%,TT純合子攜帶者比例較小。因此,為避免一組樣本過少導致統計模型失效,通常西方人研究中按CC純合子和T攜帶者分組進行對比,而在中國人群中則相反將C等位基因攜帶者和TT純合子進行對比。以往研究結果顯示無論是按照“CC純合子攜帶者和T等位基因攜帶者”還是按照“C等位基因攜帶者(包括C/C和C/T)和TT純合子攜帶者”來分組,含CC純合子攜帶者組記憶力表現更差,并且相應的腦結構和功能區表現相類似[3-7,11-12]。因此,考慮樣本數限制,本研究延續以往中國人群研究中的方法,對KIBRA基因按C等位基因攜帶者(包括C/C和C/T)和TT純合子攜帶者來分組的方案。
1.3 神經心理學相關測試
本研究采用了記憶功能評估相關的神經心理學量表。包括簡易精神狀態量表(mini-mental state examination,MMSE)、蒙特利爾認知評估量表(Montreal cognitive assessment,MoCA)、數字連線試驗-A (number connection test type A,NCT-A)和數字連線測驗-B (number connection test type B,NCT-B)、以及韋氏記憶量表中的邏輯記憶測驗和數字廣度(順背和倒背)。隨機抽取23名被試,在磁共振檢查前3 d內進行了所有的神經心理學測試。
1.4 磁共振數據采集
使用荷蘭Philips公司生產的Achieva 3.0 T TX雙梯度雙射頻源磁共振成像系統,SENSE-8-HEAD線圈(Achieva 3.0 T TX dual-source parallel RF excitation and transmission technology,Philips Medical Systems,The Netherlands)。所有受試者均先行常規MRI檢查以除外其他引起腦結構改變的疾病。采用三維超快速場回波(3D-TFE) T1WI序列矢狀位掃描,掃描參數:重復時間(repetition time,TR) 7.7 ms,回波時間(echo time,TE)3.4 ms,視野(field of view,FOV) 256 mm×256 mm×178 mm,voxle size 1×1×1,層間距為0,反轉角90°。海綿固定受試者頭部,用橡膠耳塞塞耳,盡可能保持頭部不動。
1.5 數據處理
海馬體積分析采用美國哈佛大學FreeSurfer v5.3.0 (http://surfer.nmr.mgh.harvard/ freesurfer/)軟件完成。Freesurfer將原始的dicom圖像數據轉換成.mgz格式后,通過計算每個體素與神經解剖結構特點相匹配的概率,按概率配準到已經集成的人工模板,對皮質和皮層下結果進行全自動分割。主要步驟包括運動矯正,混合區域變形或表面變形去除非腦組織,Talairach變換,分割皮層下白質和深部灰質結構,最后獲得海馬亞區的腦結構體積[13]。
FreeSurfer5.3.0軟件將海馬分為CA1、CA2_3、CA4_DG、下托(subiculum)、前下托(presubiculum)、海馬裂(fissure)、海馬傘(fimbria)以及無法分割的尾區(標記為 hippocampus) 8個亞區(圖1)。在其完成之后,人工檢查FreeSurfer對海馬體積的分割結果,筆者將分割嚴重超出海馬區域的腦區進行手動分割,然后再次計算海馬體積。同時,利用FreeSurfer估算的顱內容積(estimated total intracranial volume,eTIV)作為協變量來校正海馬體積,以去除每個人頭部大小不一所導致的海馬體積差異。
由于海馬傘和海馬裂為腦白質部分,海馬尾部為不能再分割為任何亞區的結構,因此,本研究只關注CA1、CA2_3、CA4_DG亞區、下托、以及前下托的體積。

圖1 海馬亞區示意圖,不同顏色代表不同海馬亞區Fig. 1 Schematic hippocampal subfields, different colors represent different hippocampal subfields.

表1 所有受試者一般特征資料Tab. 1 Demographic data of subjects

表2 23名受試者神經心理學量表測試結果及一般資料Tab. 2 Demographic data and neuropsychological tests of 23 subjects
表3 C等位基因攜帶者組與TT純合子攜帶者組海馬亞區體積統計結果Tab. 3 Volumes of the hippocampal subfields in different groups (mm3,
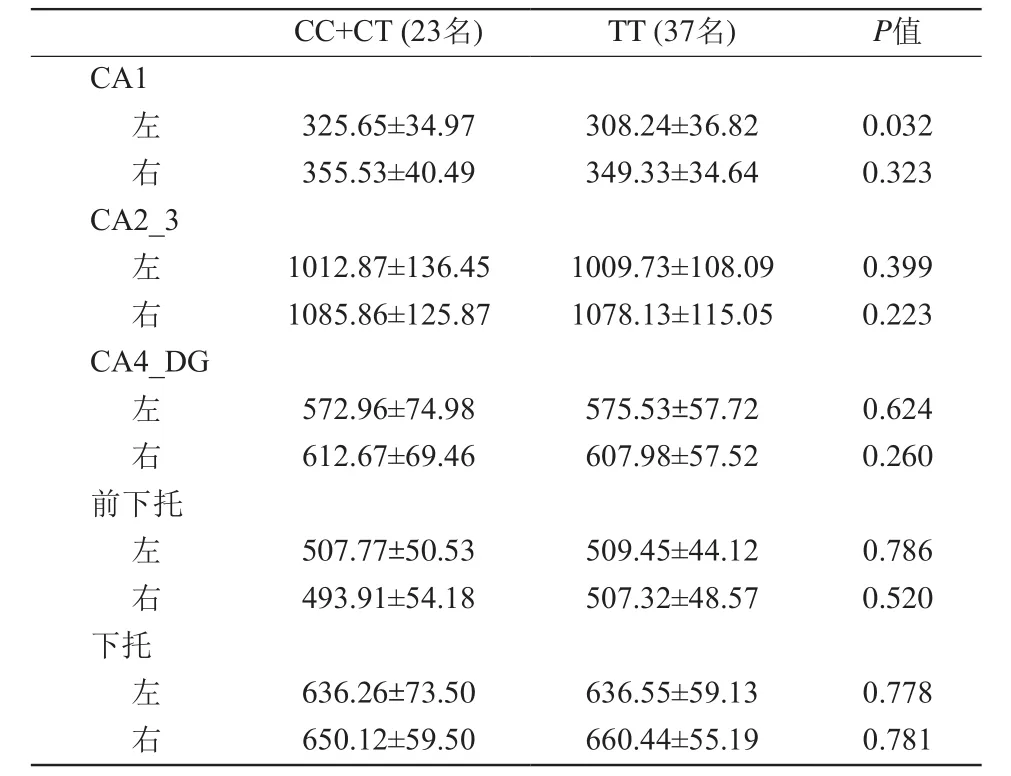
表3 C等位基因攜帶者組與TT純合子攜帶者組海馬亞區體積統計結果Tab. 3 Volumes of the hippocampal subfields in different groups (mm3,
注:以eTIV為協變量的一般線性模型試驗
CC+CT (23名) TT (37名) P值CA1左325.65±34.97 308.24±36.82 0.032右355.53±40.49 349.33±34.64 0.323 CA2_3左 1012.87±136.45 1009.73±108.09 0.399右 1085.86±125.87 1078.13±115.05 0.223 CA4_DG左572.96±74.98 575.53±57.72 0.624右612.67±69.46 607.98±57.52 0.260前下托左507.77±50.53 509.45±44.12 0.786右493.91±54.18 507.32±48.57 0.520下托左636.26±73.50 636.55±59.13 0.778右650.12±59.50 660.44±55.19 0.781
1.6 統計學分析
數據采用SPSS 19.0統計軟件進行統計學分析與處理。定量資料用均數±標準差表示,定性資料采用相對比或百分比表示;其中性別屬于定性資料,采用χ2檢驗。將eTIV作為協變量,去除每個被試頭部大小不一所導致的海馬體積差異,采用線性回歸檢驗對兩組受試者進行組間比較。然后,再將有統計學差異的海馬亞區體積與神經心理學量表進行Pearson相關性檢驗。

表4 Pearson相關檢驗結果Tab. 4 Relationship between neuropsychological tests and left CA1 hippocampal subfields volume

圖2 在23名受試者中,左側海馬CA1區體積與NCT-B完成時間呈正相關Fig. 2 Of the 23 subjects, volume of the left hippocampal CA1 region was positively correlated with NCT-B completion time.
2 結果
2.1 受試者一般特征資料
C等位基因攜帶者組與TT純合子攜帶者組年齡、性別及受教育程度差異均無統計學意義(P>0.05,表1)。并且兩組間顱內總體積eTIV也無統計學差異(P=0.192)。另外,其中23名志愿者行神經心理學量表測試,結果見表2。結果顯示NCT-A和NCT-B時間兩組被試間均存在統計學差異(P<0.001、P=0.006)。
2.2 關于C等位基因攜帶者組與TT純合子攜帶者組海馬亞區體積統計結果
由于顱內總體積有個體差異,并且顱內總體積與海馬體積有一定相關性,盡管C等位基因攜帶者組與TT純合子攜帶者組顱內總體積無統計學差異,為了減小每個被試頭部大小不一所導致的海馬體積差異,本研究采用線性回歸檢驗,將eTIV做為協變量,來探討兩組間海馬亞區體積的差異。
研究結果顯示與TT純合子攜帶者組相比,TT純合子攜帶者組左側海馬CA1區體積增大(P=0.032),而其他各亞區體積組間差異均無統計學意義(表3)。
2.3 有統計學差異的海馬亞區體積與神經心理學量表Pearson相關性檢驗結果
Pearson相關結果顯示,在23名受試者中,左側海馬CA1區體積與NCT-B完成時間呈顯著正相關(r=0.459,P=0.028),結果表4和圖2。而左側海馬CA1區體積與其他神經心理學量表無顯著相關性(P>0.05)。
3 討論
本研究結果顯示,在健康年輕受試者中,C等位基因攜帶者組與TT純合子攜帶者組相比左側CA1區海馬亞區體積增大,并且C等位基因攜帶者組神經心理學量表NCT-A和NCT-B完成時間明顯大于TT純合子攜帶者組。另外左側CA1區海馬亞區體積與神經心理學量表NCT-B完成時間呈正相關。
海馬位于大腦半球的內側面,是組成大腦邊緣系統的一部分,與記憶以及空間定位相關,并且參與注意的調節[14]。組織病理學研究和動物模型表明,海馬不是一個整體的結構,而是由幾個具有不同組織學特征的亞區組成,如下托,cornu ammonis (CA1-3)和齒狀回(dentate gyrus,DG)[15]。本研究結果顯示,與TT純合子攜帶者組相比,C等位基因攜帶者組只有左側海馬CA1區體積明顯增大,而右側海馬及左側海馬其他亞區間均無統計學差異,表明在健康年輕受試者中,左側CA1區海馬亞區體積受到KIBRA基因多態性的影響,而其他海馬亞區并未受到影響。本研究結果與先前磁共振研究結果[5-6]并不吻合,主要原因可能有以下幾個方面:第一,研究對象種族差異,本研究對象是中國人,而先前研究為西方人群。第二,研究對象年齡差異,本研究對象是年輕人,而先前研究為老年人[6]。先前研究表明T等位基因攜帶者較C/C純合子攜帶者海馬亞區體積增大,而本研究結果是C等位基因攜帶者組較TT純合子攜帶者組海馬亞區體積增大,有研究表明漢族人群中KIBRA等位基因頻率在不同年齡段有差異[16],筆者猜測KIBRA等位基因不同年齡段對海馬的影響機制不同,然而這一結果需要不同年齡段的人群研究來驗證。第三,由于本研究樣本量的限制,可能抽樣誤差增大所導致,今后還需要大樣本量及多個年齡段人群的研究來完善。
大量研究表明KIBRA基因與情景記憶之間存在相關性[1,3,5-6,11]。一項基于8000人的Meta分析表明KIBRA T等位基因對情景記憶具有保護性作用[12],TT純合子攜帶者組情景記憶得分高于C等位基因攜帶者組。本研究結果顯示,NCT-A和NCT-B完成時間明顯大于TT純合子攜帶者組,而完成時間越長,表明認知功能越差,這與先前研究結果相吻合[7]。并且,左側海馬CA1區體積與NCT-B完成時間呈正相關。連線測試主要檢測空間知覺、注意廣度和視覺運動協調功能。海馬CA1區的功能主要與空間記憶和中間記憶過程相關。海馬CA1區體積與NCT-B完成時間呈正相關,即C等位基因攜帶者組海馬CA1區體積越大,NCT-B完成時間越長,說明空間記憶和執行功能越差,表明KIBRA C等位基因攜帶者左側CA1區海馬亞區體積的增加可能是對空間記憶和執行功能減低的一種代償作用。
本研究條件下,在健康年輕受試者中,左側CA1區海馬亞區體積受到KIBRA基因多態性的影響,KIBRAC等位基因攜帶者左側CA1區海馬亞區體積的增加可能是對空間記憶和執行功能減低的一種代償作用,該研究結果有助于KIBRA基因多態性與健康年輕人空間記憶和執行功能關系神經機制的研究。

