黑暗脅迫下擬南芥葉片衰老突變體的篩選及鑒定
祁 蒙,賈 敏,劉夏燕
(西北農(nóng)林科技大學(xué)生命科學(xué)學(xué)院,陜西楊凌712100)
植物衰老是一個(gè)年齡依賴的在細(xì)胞、組織、器官和生物體水平上的程序性死亡過(guò)程,是生長(zhǎng)發(fā)育的最后一個(gè)階段[1-2]。葉片衰老作為植物衰老的主要形式,是葉片細(xì)胞對(duì)年齡信息及一系列內(nèi)外環(huán)境的總體響應(yīng)。影響葉片衰老的環(huán)境因子包括生物因素及非生物因素,生物因素包括病菌入侵或鄰近植物遮蔽等,非生物因素包括干旱、營(yíng)養(yǎng)限制、黑暗處理、極端溫度及氧化脅迫等[3-4]。而外界因素的影響,會(huì)導(dǎo)致衰老的提前發(fā)生[5-6],例如,黑暗是最有效也是最簡(jiǎn)便的誘發(fā)衰老的信號(hào),使植物產(chǎn)生快速、一致的衰老表型[7]。在衰老過(guò)程中,伴隨著葉片形態(tài)上的顯著變化如葉色逐漸黃化,細(xì)胞內(nèi)也發(fā)生一系列的生理生化反應(yīng)[8-9]。首先,生長(zhǎng)及環(huán)境因素等信號(hào)分子激活調(diào)控衰老相關(guān)基因表達(dá)的轉(zhuǎn)錄因子[10-11],從而啟動(dòng)相關(guān)基因的表達(dá)。隨后,細(xì)胞內(nèi)的各組分開(kāi)始進(jìn)入有序的降解過(guò)程,其中葉綠體的降解最早發(fā)生;伴隨著葉綠體的降解就是葉綠素和蛋白質(zhì)的降解,典型的葉綠體蛋白如核酮糖二磷酸羧化酶及葉綠素結(jié)合蛋白(CAB)等都有很大程度的減少;其他組分如膜脂、核酸等也被一定程度的降解,降解后的小分子營(yíng)養(yǎng)物質(zhì)被轉(zhuǎn)移到新生器官或種子中循環(huán)利用[12-13]。葉片衰老是植物進(jìn)化選擇的產(chǎn)物,能夠幫助植物更好地適應(yīng)環(huán)境并保證后代的繁衍[14],但另一方面,葉片衰老降低了作物產(chǎn)量和生物量的積累,限制了水果、蔬菜以及觀賞植物的壽命,使植物更容易受到病原體侵害[15-16]。因而,對(duì)葉片衰老的研究一方面可以更深入地闡明衰老過(guò)程的分子機(jī)理;另一方面,對(duì)提高作物產(chǎn)量及果蔬儲(chǔ)藏具有重要經(jīng)濟(jì)意義。
目前研究衰老機(jī)制主要從遺傳篩選和分子手段兩方面入手。遺傳手段包括篩選和鑒定衰老異常突變體。擬南芥作為模式植物,具有全基因組已經(jīng)測(cè)序、生長(zhǎng)周期短、葉片生長(zhǎng)發(fā)育階段易于區(qū)分等特點(diǎn),成為研究葉片衰老的最適材料[1,4]。擬南芥突變體的獲得主要有物理誘變、化學(xué)誘變、T-DNA插入誘變等[17]。化學(xué)誘變法作為經(jīng)典的誘變方法,其產(chǎn)生的突變體為基因功能研究提供了豐富資源。甲基磺酸乙酯(EMS)是一種較為常用的化學(xué)誘變劑,能誘發(fā)植物產(chǎn)生高密度的系列等位基因點(diǎn)突變,并且誘變頻率高、副作用(致死或不育等)較小、操作簡(jiǎn)單[18],因而被廣泛用于擬南芥的誘變處理。對(duì)經(jīng)過(guò)誘變處理后的植物,通常多利用植物表型鑒定、生理生化、遺傳學(xué)等方法進(jìn)行篩選。
本研究先對(duì)野生型擬南芥進(jìn)行時(shí)間梯度的黑暗脅迫誘導(dǎo),獲得一個(gè)合理的誘導(dǎo)衰老體系:將擬南芥種子在添加1%蔗糖的MS培養(yǎng)基上持續(xù)光照生長(zhǎng)7 d,之后移栽至不添加外源糖的MS培養(yǎng)基上,并進(jìn)行梯度黑暗脅迫處理,植物葉片隨處理時(shí)間延長(zhǎng)呈現(xiàn)出明顯的衰老表型;接著,將自噬基因突變體在碳素缺乏條件下,經(jīng)過(guò)黑暗誘導(dǎo)后呈現(xiàn)的早衰表型來(lái)確定試驗(yàn)體系的可行性和有效性;最后,以EMS誘變獲得的M2代分離群體為研究對(duì)象,進(jìn)行上述黑暗脅迫體系的誘導(dǎo),從而篩選出可能的葉片衰老提前或者衰老延緩的突變體,成功獲得了1個(gè)衰老提前的突變體asd1-1,進(jìn)一步對(duì)該衰老異常突變體進(jìn)行了鑒定和研究。
1 材料與方法
1.1 材料
1.1.1 植物材料 擬南芥(Arabidopsis thaliana)野生型為Columbia(Col-0)生態(tài)型。植物經(jīng)典自噬基因突變體atg5-1、atg7-3由筆者所在實(shí)驗(yàn)室購(gòu)于擬南芥資源中心(Arabidopsis biological resource center,ABRC)。 突 變 體asd1-1為野生型擬南芥通過(guò)EMS誘變篩選得到。
1.1.2 主要試劑 擬南芥培養(yǎng)基質(zhì)購(gòu)自Pindstrup Substrate Peat Moss;蔗糖和 EMS購(gòu)自美國(guó) Amresco公司,瓊脂(BACTO)購(gòu)自美國(guó)BD公司。
1.1.3 溶液 種子漂洗液(50%市售 84消毒液,0.1%Triton X-100);MS全素固體培養(yǎng)基[5 mmol/L硝酸鉀,2 mmol/L硫酸鎂,2.5 mmol/L磷酸二氫鉀,2 mmol/L硝酸鈣,0.05 mmol/L Fe - EDTA,0.1% 微量元素混合液(V/V),0.02%EMS,1%蔗糖,1%瓊脂;KOH 調(diào) pH 值為 5.8,121 ℃高壓滅菌20 min]。
1.2 方法
1.2.1 EMS誘變 以擬南芥野生型(Col)為材料,利用甲基磺酸乙酯(EMS)化學(xué)誘變技術(shù),構(gòu)建誘變?nèi)后w,參照Wilson等的方法[19]略作改動(dòng)。稱取0.4 g(約2萬(wàn)粒)的野生型種子,于50 mL離心管中用雙蒸水浸泡6~8 h使種子預(yù)吸脹。之后吸出水,加入用磷酸緩沖液配制的0.4%的EMS(V/V),浸泡14 h過(guò)夜。處理后的種子,吸出EMS,用蒸餾水反復(fù)沖洗數(shù)次,每次5 min,即為M1種子。將M1種子種植于培養(yǎng)基質(zhì)上,混合收獲種子并分組,共得到30個(gè)M2誘變?nèi)后w。將獲得的M2代群體作為篩選對(duì)象,通過(guò)缺失碳源及黑暗脅迫體系處理,觀察植物表型,篩選可能的葉片衰老相關(guān)突變體。
1.2.2 種子表面消毒 每次用千分之一天平稱取0.05 g(約3 000粒)種子,分裝于1.5 mL的離心管中,加入1 mL新配置的種子漂洗液,顛倒數(shù)次后,于超凈臺(tái)中將漂洗液吸去,用已滅菌的雙蒸水反復(fù)洗數(shù)遍至不再有漂洗液殘留,最后將種子重新懸浮于無(wú)菌水中,置于4℃低溫黑暗處理2~3 d。
1.2.3 MS固體培養(yǎng)基培養(yǎng) 配制含有1%蔗糖的MS培養(yǎng)基并于121℃高壓滅菌。將滅菌后的培養(yǎng)基以每個(gè)培養(yǎng)板約40 mL的量均勻平鋪于12 cm×12 cm的方形培養(yǎng)板上,待培養(yǎng)基凝結(jié)以備用。用巴氏滴管吸取種子,單粒均勻點(diǎn)播在含有1%蔗糖的MS固體培養(yǎng)基表面。待培養(yǎng)基表面無(wú)多余水分后,用封口膜密封培養(yǎng)板。將培養(yǎng)板放入培養(yǎng)間,放置在溫度22℃和光強(qiáng)約100μmol/(m2·s)的持續(xù)光照下豎直培養(yǎng)。
1.2.4 黑暗脅迫體系誘導(dǎo)葉片衰老及衰老異常突變體的篩選 將在含有1%蔗糖的MS培養(yǎng)基上光下生長(zhǎng)的擬南芥植株,移到不添加外源糖的MS培養(yǎng)基上并完全黑暗處理的體系稱為黑暗脅迫。在含1%蔗糖的MS培養(yǎng)基上生長(zhǎng)7 d的M2代植物,于超凈臺(tái)中用鑷子小心挑起并移到不添加蔗糖的MS培養(yǎng)基上,封口膜密封后,用錫紙包裹培養(yǎng)板使植物完全黑暗并豎直放入培養(yǎng)箱中培養(yǎng)。在黑暗脅迫處理7 d后,取出黑暗處理過(guò)的M2代植株觀察拍照。葉片衰老相關(guān)突變體的篩選模式如圖1所示,此時(shí)的M2群體中葉片衰老程度不一。將黑暗脅迫7 d的野生型(WT)植株(圖1-A)中子葉明顯黃化、衰老加劇或子葉較綠、衰老延緩的植物挑出(圖1-B),移栽到植物基質(zhì)泥炭土中,放入光照培養(yǎng)間正常培養(yǎng),單株編號(hào)并記錄植株表型后收種子。以野生型擬南芥作對(duì)照,將第1輪篩選得到的葉片衰老表型異常植株經(jīng)過(guò)黑暗脅迫處理再次驗(yàn)證葉片衰老表型,能夠維持第1輪得到的葉片衰老加劇或延緩的植物即為可能的衰老異常突變體。具體篩選過(guò)程如圖1-C所示。
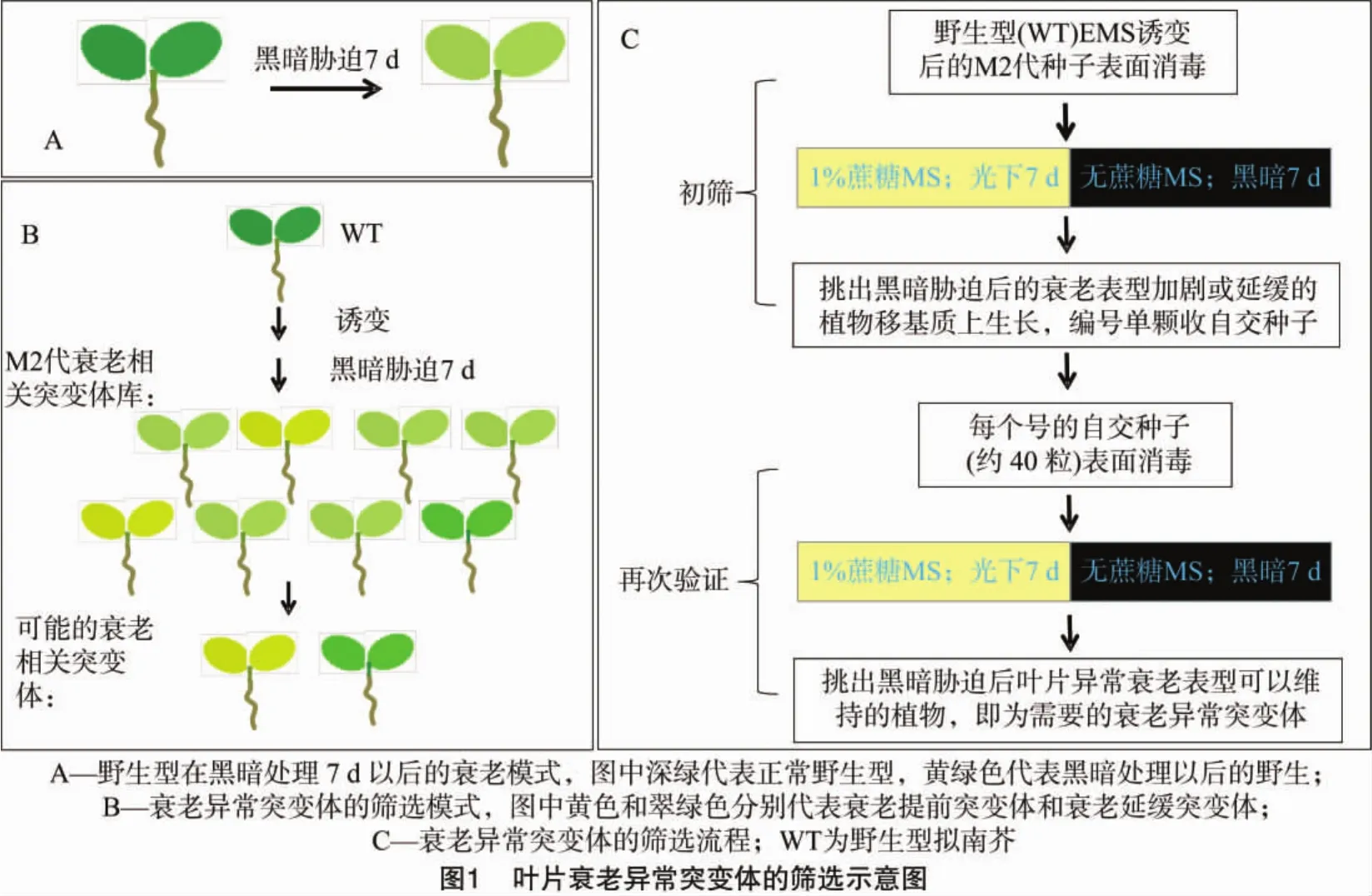
1.2.5 突變體的衰老表型分析 觀察突變體幼苗的發(fā)育狀況、葉色的差異、植株整體表型及在黑暗脅迫處理中植物的衰老情況并拍照。
1.2.6 T-DNA插入突變體的鑒定 進(jìn)行突變體T-DNA插入鑒定的引物如表1所示。T-DNA插入的純合體植株基因組DNA用自身基因R引物或F引物與T-DNA序列上的LB引物可以擴(kuò)增出特異條帶,而自身F+R不能擴(kuò)增出目的條帶。野生型或無(wú)插入的植株只有F+R可以擴(kuò)增出目的條帶。進(jìn)一步對(duì)突變體的T-DNA插入位置進(jìn)行確定,以純合突變體植株的基因組DNA為模板,用T-DNA序列的左端引物L(fēng)B與基因組F或R引物擴(kuò)增,將所得的擴(kuò)增產(chǎn)物回收后測(cè)序并比對(duì)分析T-DNA插入位置。
1.2.7 葉綠素的提取及含量測(cè)定 取新鮮植物葉片(約20 mg)置于標(biāo)記好的1.5 mL離心管中,精確稱質(zhì)量并記錄組織鮮質(zhì)量后迅速投入液氮中凍存。將植物組織充分研磨至粉末狀,加入1 mL的95%乙醇;避光放入4℃環(huán)境中顛倒混勻孵育,孵育時(shí)間為5~24 h;孵育完成后,使用高速低溫離心機(jī)以14 000 r/min在4℃下離心10 min;轉(zhuǎn)移上清液到新的離心管中,之后對(duì)樣本的吸光度進(jìn)行測(cè)定。將分光光度計(jì)設(shè)定3個(gè)波長(zhǎng)(664、649、470 nm),每個(gè)樣本重復(fù)測(cè)3遍后記錄平均吸光度D664nm、D649nm、D470nm。用95%乙醇調(diào)零后,即可進(jìn)行樣本吸光度的測(cè)定,若樣本的吸光度高于1,可以按1∶10的比例進(jìn)行稀釋。通過(guò)計(jì)算公式可以得到總?cè)~綠素含量及葉綠素a、葉綠素b、類胡蘿卜素、葉黃素的量。
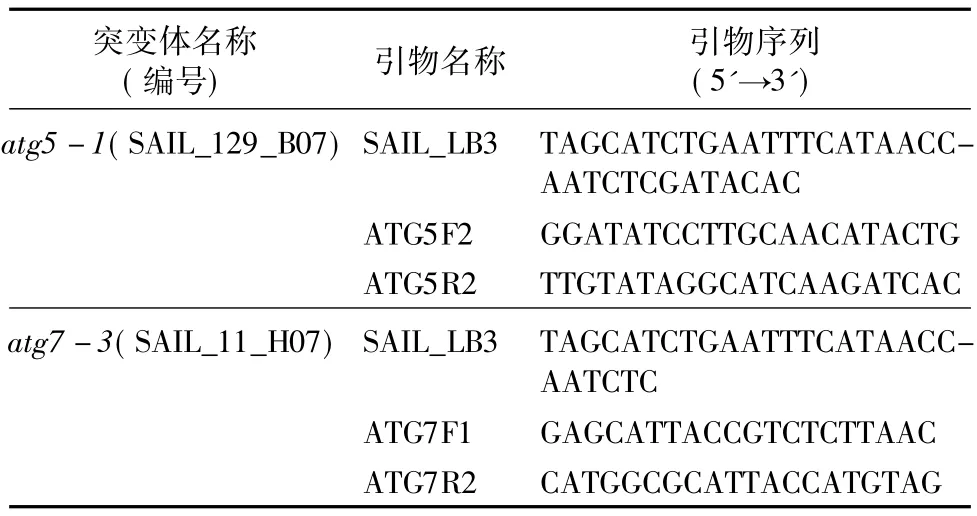
表1 ATG5及ATG7 T-DNA插入突變體鑒定引物
1.2.8 擬南芥葉片總蛋白提取及SDS-PAGE分離 取擬南芥葉片組織(約50 mg)置于1.5 mL離心管中,用千分之一天平精確稱量后放入液氮中瞬時(shí)冷凍。將葉片充分研磨至粉末狀,按1 mg組織加10μL緩沖液的量加入2×蛋白提取緩沖液,顛倒混勻后放入 65℃干浴2 h。2 h后,室溫以14 000 r/min離心10 min,轉(zhuǎn)移上清液(即為所需的蛋白樣品)到新的離心管中,蛋白樣品可于-80℃保存。等量的蛋白樣品經(jīng)10%SDS-PAGE分離后,通過(guò)考馬斯R-250染色液染膠,充分染色后,加入脫色液室溫脫色至凝膠空白處藍(lán)色完全脫去,拍照分析條帶。
2 結(jié)果與分析
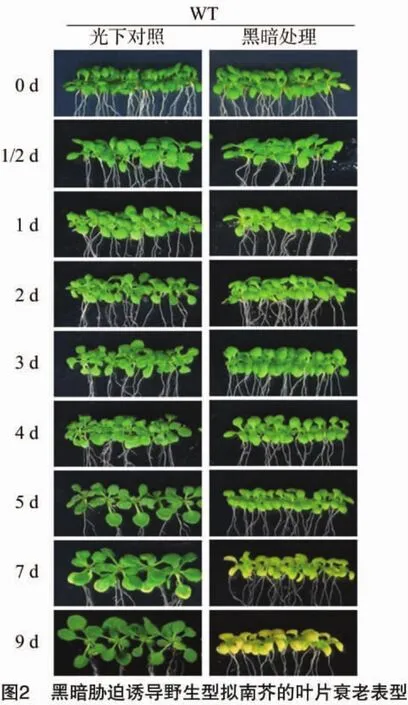
2.1 黑暗脅迫體系誘導(dǎo)野生型擬南芥葉片衰老
利用黑暗脅迫梯度處理體系,首先構(gòu)建了以擬南芥野生型為處理對(duì)象的植物葉片衰老模式,以此尋找葉片出現(xiàn)顯著衰老表型的時(shí)間點(diǎn),同時(shí)鑒定該黑暗處理體系的有效性。將生長(zhǎng)于MS培養(yǎng)基上的7 d的野生型擬南芥,轉(zhuǎn)移到不添加蔗糖的MS培養(yǎng)基上,經(jīng)過(guò)黑暗脅迫(C-)不同天數(shù)處理誘導(dǎo)植物衰老;而對(duì)照組植株轉(zhuǎn)移到含有1%蔗糖的MS培養(yǎng)基上,繼續(xù)光下生長(zhǎng)。黑暗脅迫處理的時(shí)間梯度依次為0、0.5、1、2、3、4、5、7、9 d。取出對(duì)應(yīng)時(shí)間點(diǎn)的植物觀察表型,與光下對(duì)照相比,在黑暗脅迫誘導(dǎo)5 d后植物葉片顏色開(kāi)始變黃,7 d后葉片黃化加劇,衰老表型明顯(圖2)。在處理9 d后,植物葉片基本完全變黃。通過(guò)對(duì)野生型誘導(dǎo)衰老,確定了最為明顯的植物葉片衰老表型開(kāi)始于處理7 d左右,同時(shí)也說(shuō)明了構(gòu)建的黑暗脅迫體系確實(shí)能誘導(dǎo)植物產(chǎn)生快速一致的葉片衰老表型。
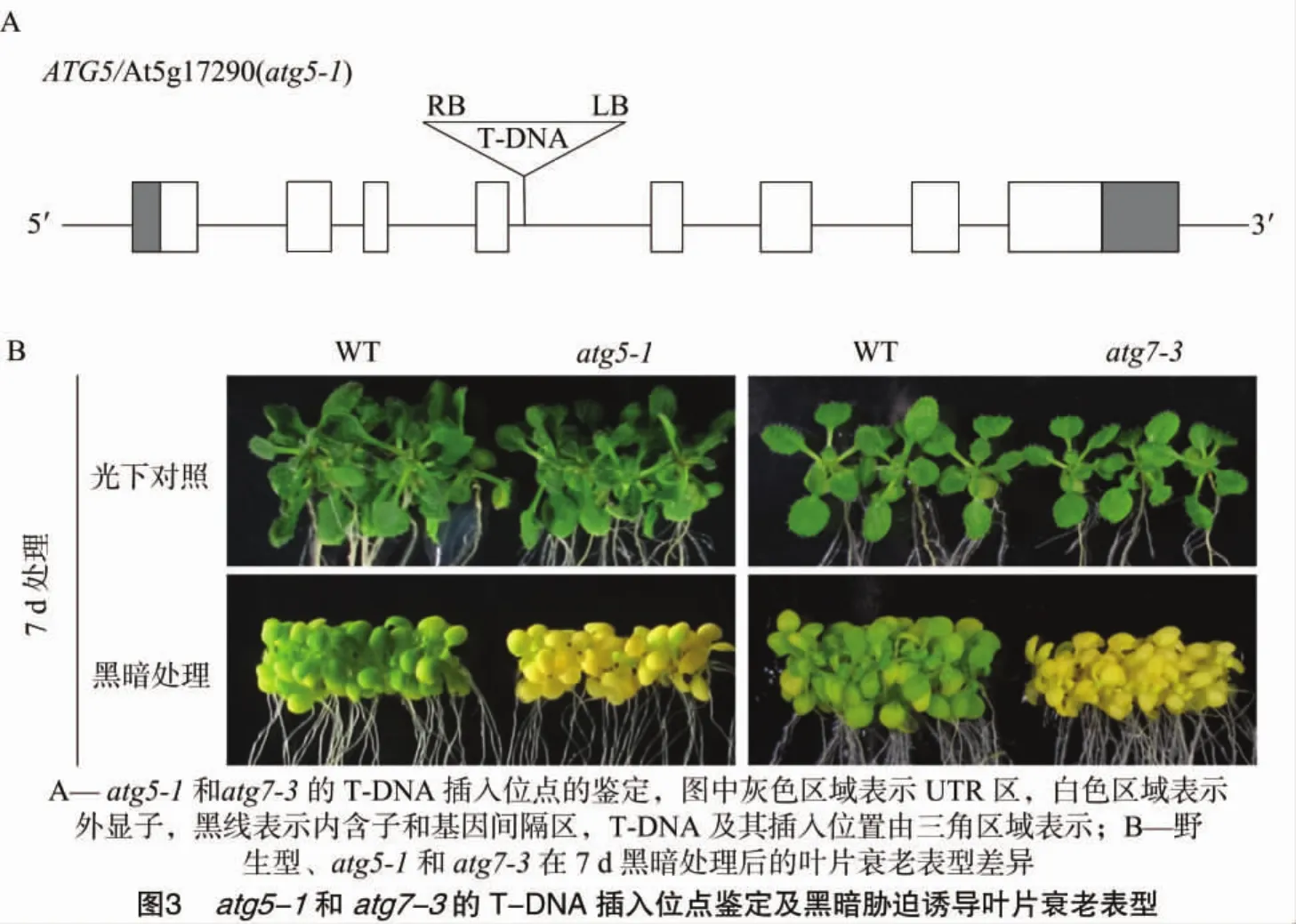
2.2 經(jīng)典自噬基因突變體的T-DNA插入鑒定及黑暗脅迫誘導(dǎo)葉片衰老
Thompson等將在碳源充足的短日照條件下生長(zhǎng)的自噬基因突變體atg5-1和atg7-1,轉(zhuǎn)移到黑暗中生長(zhǎng)一段時(shí)間后又回到短日照下生長(zhǎng)1周,誘導(dǎo)atg5-1和atg7-1產(chǎn)生了生長(zhǎng)減慢和衰老加速的表型,從而證明了其構(gòu)建的碳源缺乏體系的有效性[20]。因此,先通過(guò)從ABRC網(wǎng)站上購(gòu)買(mǎi),分別獲得了ATG5基因和ATG7基因的T-DNA插入功能缺失突變體atg5-1和atg7-3,再通過(guò)設(shè)計(jì)引物進(jìn)行PCR鑒定其T-DNA插入位點(diǎn)(圖3),獲得其T-DNA插入功能缺失純合突變體。
進(jìn)一步將突變體atg5-1和atg7-3作為處理對(duì)象來(lái)檢測(cè)該黑暗脅迫體系在鑒定自噬異常突變體葉片衰老表型中的有效性,處理時(shí)間為7 d,處理方法同上。在黑暗脅迫體系處理7 d后,取出植物觀察表型,可以看到,經(jīng)過(guò)處理的野生型植物葉片已經(jīng)開(kāi)始變黃,這與之前結(jié)果一致。然而相比于野生型,處理后的自噬基因突變體atg5-1和atg7-3均表現(xiàn)出更為明顯的葉片黃化衰老表型(圖3),這與已經(jīng)報(bào)道的經(jīng)典自噬基因突變體在營(yíng)養(yǎng)脅迫下產(chǎn)生的超敏感表型一致。同時(shí),觀察光下正常生長(zhǎng)的對(duì)照組植物,發(fā)現(xiàn)突變體與野生型植物葉片顏色并無(wú)差異,表明在黑暗脅迫后產(chǎn)生的葉片衰老表型并非由植物本身葉色差異造成。通過(guò)已知的自噬突變體在黑暗脅迫誘導(dǎo)下產(chǎn)生的衰老加劇表型,說(shuō)明構(gòu)建的黑暗脅迫體系確實(shí)可以作為篩選或鑒定衰老異常突變體的有效手段。
2.3 衰老異常突變體的篩選與表型鑒定
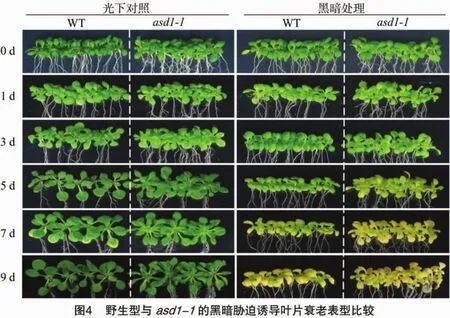
通過(guò)EMS誘變及黑暗脅迫處理體系,在M2代篩到了3個(gè)可能的衰老相關(guān)突變體。其中篩到1個(gè)在黑暗脅迫處理以后植物葉片顏色明顯黃化、衰老加劇的突變體asd1-1,在后續(xù)作為研究對(duì)象。將野生型和asd1-1突變體經(jīng)過(guò)黑暗脅迫梯度處理體系誘導(dǎo),培養(yǎng)時(shí)間梯度為 0.5、1、2、3、4、5、7、9 d,將到達(dá)處理時(shí)間點(diǎn)的植物取出觀察衰老表型,本研究展示了0、1、3、5、7、9 d 這 6 個(gè)時(shí)間點(diǎn)的植物表型圖(圖 4)。從圖中可以看出,隨時(shí)間的延長(zhǎng),黑暗脅迫處理以后的植物葉片逐漸變黃衰老。而對(duì)比野生型與asd1-1突變體可以發(fā)現(xiàn),asd1-1突變體衰老更快,在處理5 d后,野生型與 asd1-1突變體已呈現(xiàn)出葉色黃化差異,而在處理7 d后,葉色差異更為明顯;到處理9 d后,雖然二者都衰老嚴(yán)重,但 asd1-1突變體的葉片已經(jīng)開(kāi)始腐爛。而處理0 d的植物葉片顏色并無(wú)差異,表明在黑暗脅迫后產(chǎn)生的葉片衰老加劇表型并非由植物本身葉色差異造成,而可能是ASD1基因在調(diào)控葉片衰老中的功能引起。
2.4 衰老葉片中的葉綠素含量測(cè)定
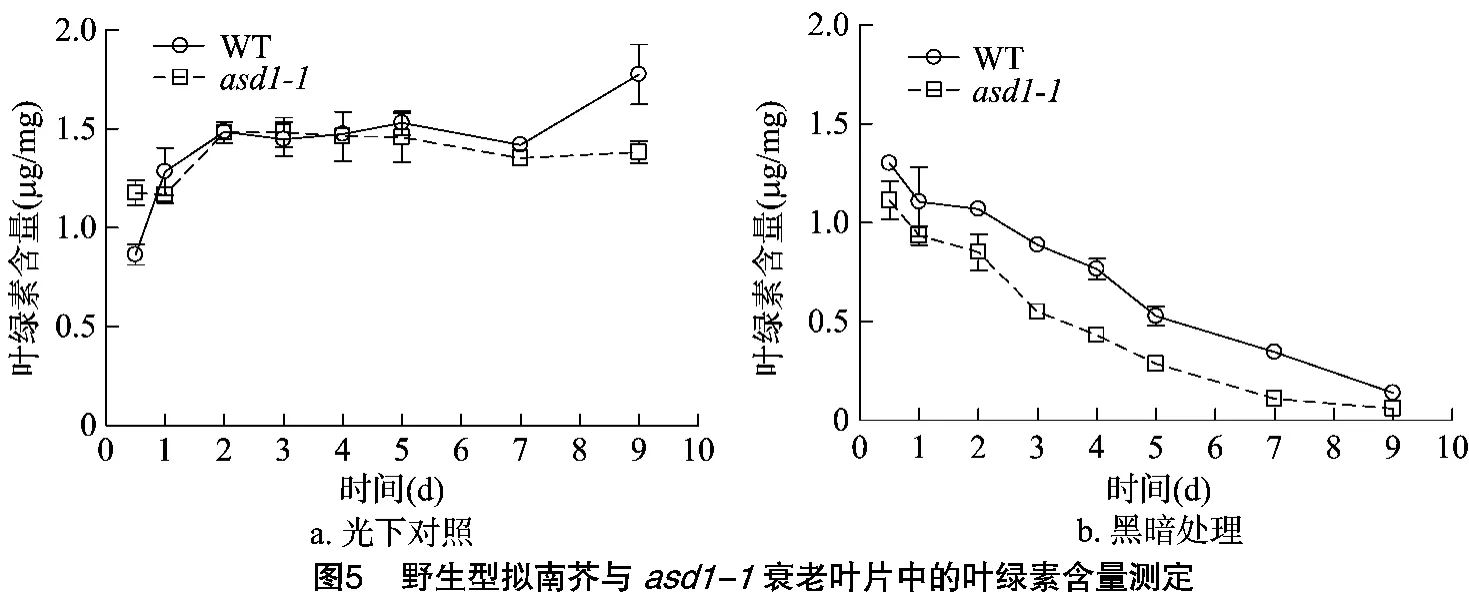
現(xiàn)已建立的表征衰老的標(biāo)記有葉綠素含量、光合效率、基因表達(dá)以及蛋白水平的變化等。其中測(cè)定葉綠素含量是最為方便和簡(jiǎn)單的定量葉片衰老的方法[21-22]。通過(guò)測(cè)量葉片的葉綠素含量,發(fā)現(xiàn)光下對(duì)照中的野生型與asd1-1突變體的葉綠素含量在同一時(shí)間點(diǎn)差異并不明顯;而在黑暗脅迫處理中的2種基因型植物葉綠素含量都隨著處理時(shí)間延長(zhǎng)呈下降趨勢(shì),但asd1-1突變體葉綠素下降速率要高于野生型(圖5)。
2.5 衰老葉片中蛋白的降解
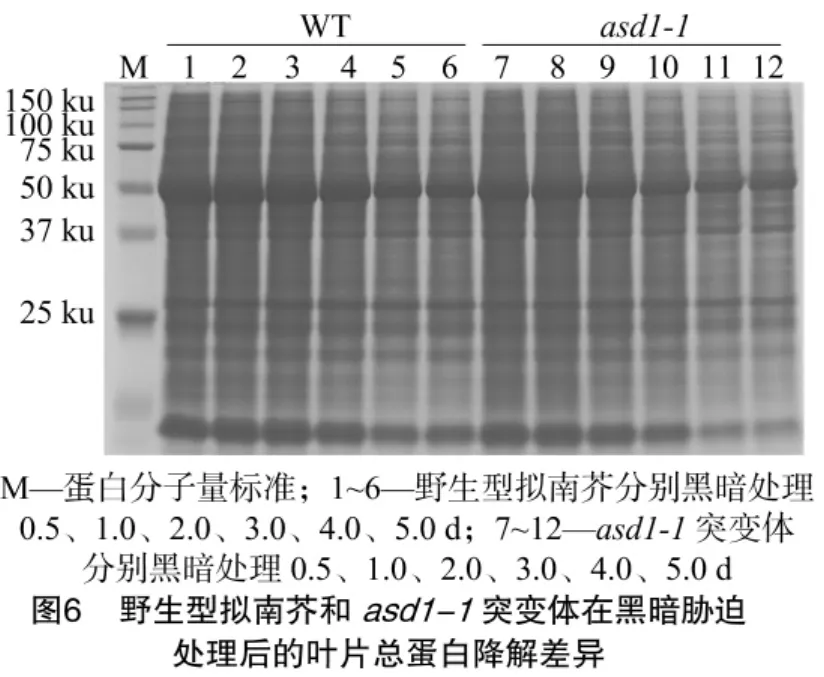
將野生型擬南芥與asd1-1突變體在梯度黑暗處理0.5、1.0、2.0、3.0、4.0、5.0 d 后,通過(guò)提取衰老葉片的總蛋白及SDS-PAGE電泳檢測(cè)葉片總蛋白的降解情況(圖6)。觀察考馬斯亮藍(lán)染色的蛋白膠,可以看到在黑暗脅迫誘導(dǎo)的衰老葉片中,蛋白積累明顯降低,而對(duì)比于野生型,asd1-1突變體中蛋白的降解更為明顯,尤其在處理3 d以后,asd1-1突變體中蛋白積累,特別是葉綠體蛋白R(shí)ubisco大亞基(50 ku)的含量明顯下降。這也間接反映了asd1-1突變體在黑暗脅迫誘導(dǎo)下衰老加劇。
3 結(jié)論與討論
植物葉片衰老是植物自身發(fā)育階段整合外界環(huán)境而表現(xiàn)出的一種自然響應(yīng)的衰退過(guò)程。外界環(huán)境(如黑暗誘導(dǎo)、營(yíng)養(yǎng)限制等)可以促使整個(gè)葉片趨于同步化的衰老[23]。前人的研究中常將單個(gè)葉片避光黑暗或者采用營(yíng)養(yǎng)限制(如缺氮、缺碳等)來(lái)促使植物衰老,將營(yíng)養(yǎng)缺乏和黑暗結(jié)合起來(lái)處理植物幼苗的方法則是一種更為有效的新方法。本研究中,在不提供外源蔗糖的情況下,完全黑暗處理阻止植物進(jìn)行光合作用,從而抑制內(nèi)源糖類的產(chǎn)生,形成完全的碳素缺乏。而梯度黑暗脅迫處理的目的在于觀測(cè)植物表型及細(xì)胞內(nèi)物質(zhì)變化的動(dòng)態(tài)過(guò)程,為后期試驗(yàn)提供合理的植物處理時(shí)間點(diǎn)。這種黑暗脅迫體系不僅可以實(shí)現(xiàn)植物在幼苗期形成快速一致的衰老,并且植物培養(yǎng)基成分易于控制,避免了因外在因素導(dǎo)致的衰老差異。在本研究中建立的黑暗脅迫體系,不僅可以作為篩選植物衰老相關(guān)突變體的有效手段,對(duì)于已有突變體材料進(jìn)行衰老相關(guān)表型的鑒定也是一種快速而簡(jiǎn)便的方法。
利用EMS技術(shù)構(gòu)建突變體庫(kù),從中篩選突變體是一種經(jīng)典的正向遺傳學(xué)方法,該方法有可能篩選到從T-DNA插入突變體庫(kù)中無(wú)法發(fā)現(xiàn)的新基因[24]。在本試驗(yàn)中,通過(guò)對(duì)野生型擬南芥進(jìn)行EMS誘變,篩選到1個(gè)衰老表型加劇的突變體asd1-1,進(jìn)一步對(duì)該突變體通過(guò)黑暗脅迫體系誘導(dǎo)葉片衰老進(jìn)行表型驗(yàn)證,同時(shí)檢測(cè)衰老葉片中葉綠體基質(zhì)蛋白的降解情況,發(fā)現(xiàn)突變體葉片衰老表型和葉綠體蛋白降解都與野生型存在差異,明確了asd1-1為1個(gè)葉片衰老相關(guān)突變體,這為后續(xù)研究ASD1基因在調(diào)控葉片衰老中的功能奠定了基礎(chǔ)。
- 江蘇農(nóng)業(yè)科學(xué)的其它文章
- 基于DEA模型的農(nóng)產(chǎn)品質(zhì)量安全追溯效率分析
——以浙江省德清縣50家農(nóng)產(chǎn)品龍頭企業(yè)為例 - 吉林省土地流轉(zhuǎn)農(nóng)戶生計(jì)變化現(xiàn)狀及滿意度分析
- 農(nóng)業(yè)補(bǔ)貼對(duì)農(nóng)戶農(nóng)地轉(zhuǎn)入行為的影響
——以新疆奇臺(tái)縣為例 - 1種基于收入保障保險(xiǎn)的果蔬三級(jí)供應(yīng)鏈利潤(rùn)優(yōu)化分析
- 功能農(nóng)業(yè)競(jìng)爭(zhēng)力水平指標(biāo)體系構(gòu)建及評(píng)價(jià)方法
- 食品安全視角下農(nóng)戶大米消費(fèi)來(lái)源選擇

