串珠鐮孢菌來源的角質酶基因的克隆表達及其酶學性質
陳志琳,林青君,王 鵬,葉秀云,李仁寬
(福州大學福建省海洋酶工程重點實驗室,福建福州 350116)
角質層是控制植物與環境之間的屏障,它調節植物體溫、水分交換、抵御病菌侵害和防止機械損傷[1]。角質是角質層的主要成分,可被角質酶高效降解;角質是一種不溶性的生物聚合物,主要有脂類單體組成,大部分存在于植物中[2]。不同物種角質的成分并不相同,如在一些高等植物葉片表面區域中,角質含量為20~600 μg/cm2,而在發育良好的某些果實表皮上,角質的含量能達到1.5 mg/cm2[3]。
角質酶是一種能降解角質的酶,角質酶來源很廣,存在于真菌和細菌等微生物中[4-5]。天然角質酶主要有兩個來源途徑:一是真菌植物病原體霉菌,細菌以及放線菌;二是從花粉中分離純化得到[6-8]。角質酶的分子量普遍較小[9],目前對真菌角質酶的研究最多,其相對分子量一般較小,為20~25 kDa左右,最適酶活溫度一般為30~40 ℃,最適pH偏堿,通常為8~10。角質酶在食品也有著廣泛的運用,可用于奶牛脂肪的水解;水果外層角質層降解加快脫水;可與蛋白酶復合使用去除煙草中的蛋白。目前國內外研究對真菌角質酶雖然得到了深入的研究,但仍存在基因工程異源表達時表達量較低和穩定性較差的問題,并且生產成本較高,至今為止沒有實現工業化生產,同時真菌角質酶本身存在熱穩定性差的缺點,不能適合高溫處理環境,限制了角質酶的開發應用[10]。
本文通過篩選酶活較高的角質酶菌株,對該菌株進行克隆表達,并對其進行分離純化和酶學性質研究,為角質酶的生產和應用打下基礎。
1 材料與方法
1.1 材料與儀器
串珠鐮孢菌(FusariummoniliformeSheld)從福建地區采集土壤樣品篩選獲得;大腸桿菌(E.coliDH5α)、畢赤酵母菌株(P.pastorisGS115) Invitrogen 公司。pMD-18 T TAKARA公司;pPIC9K Invitrogen公司;限制性內切酶(EcoR Ⅰ,NotⅠ)、T4 DNA 連接酶、DNA聚合酶 TaKaRa公司;MMLV第一鏈cDNA合成試劑盒,膠回收試劑盒,質粒抽提試劑盒 Sangon Biotech公司;D-半乳糖 國藥集團化學試劑有限公司;DNS試劑參照文獻[11]配制;Trizol試劑 Invitrogen公司。
T6新世紀紫外可見分光光度計 北京普析通用儀器有限責任公司;HWS24電熱恒溫水浴鍋 上海一恒科技有限公司;THZ-82恒溫振蕩器 國華企業;BC/BD-320HCN臥式冷藏冷凍轉換柜 海爾集團;TP-114分析天平。
1.2 實驗方法
1.2.1 培養基的配制 LB 培養基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 10 g/L,固體培養基再添加瓊脂20 g/L;
BMMY培養基:酵母粉:1.0 g,蛋白胨:2.0 g,YNB:1.34 g,0.1 mol/L磷酸緩沖液,甘油:1.0 mL,蒸餾水定容至100 mL,pH為7.0;
RD培養基:1 M山梨醇,2%葡萄糖,1.34% YNB,4×10-5%生物素,0.005%氨基酸;
YPD培養基:1% 酵母膏,2% 蛋白胨,2%葡萄糖,若制固體培養基,加入2%瓊脂。
1.2.2 高產角質酶菌株的篩選 從福建地區采集土壤樣品,用無菌袋裝好,-20 ℃保藏備用,初篩[12-13]:取10 g土樣加入90 mL帶有小玻璃珠的無菌生理鹽水中,充分振蕩后用無菌生理鹽水進行梯度稀釋。用移液槍分別吸取合適稀釋度的稀釋液0.1 mL涂布于篩選平板,于30 ℃培養數天,挑取單菌落進行平板劃線分離純化。將單菌落接種到角質酶篩選培養基上,30 ℃培養數天,觀察菌落周圍是否出現水解透明圈,并記錄H/C值(透明圈直徑/菌落直徑)。
復篩[14-15]:將初篩得到的產角質酶菌株接種于種子培養基(裝液量25 mL/100 mL)中,30 ℃,200 r/min培養12 h后,按1%(v/v)的接種量接入液體發酵培養基(裝液量50 mL/250 mL),30 ℃,200 r/min培養,定期取樣測定發酵上清液酶活力。
采用細菌16S rDNA通用引物從菌株的基因組DNA中擴增得到16S rDNA序列(PCR擴增條件:94 ℃ 5 min;94 ℃ 30 s,48 ℃ 30 s,72 ℃ 90 s,25個循環;72 ℃ 10 min),將PCR擴增得到的DNA片段在1%瓊脂糖凝膠中進行電泳分離,用試劑盒回收純化DNA直接送測。測序結果通過在NCBI中進行序列同源性比對分析,選取同源性較高的菌株利用Mega5.2構建系統進化樹[16-18]。
1.2.3 產角質酶基因的克隆 按照Trizol試劑說明書,取串珠鐮孢菌50 mg用液氮進行研磨,再加入0.5 mL的Trizol進行研磨使得樣品裂解;加入0.2 mL的氯仿進行RNA提取;提取物經吸附柱進行純化,最終獲得純的RNA。
參照第一鏈cDNA合成試劑盒產品說明將mRNA反轉錄成第一鏈cDNA。在20 μL體系中,加入1 μg總RNA、1μL Oligo dT18(500 μg/mL)和Rnase-free水,在70 ℃水浴溫育10 min后,立即置于冰浴冷卻;繼續向冷卻的管中加入4μL 5×Buffer、2 μL 0.1 M的DTT和1 μL 10 mmol/L的dNTPs,混勻后于42 ℃水浴保溫2 min;再加入1 μL(200 U)反轉錄酶,42 ℃繼續保溫50 min;最后,置于70 ℃水浴保溫15 min,滅活反轉錄酶,獲得第一鏈cDNA。
根據NCBI檢索獲得串珠鐮孢菌來源的角質酶基因并進行比對,設計角質酶基因的特異性引物。引物由上海生工合成。
上游引物1:ATGAAGTTCTCCATCATCTCTACTC
上游引物2:AAGGAATTCCTTCCCGCTGGTC AGGATG(下劃線為EcoR I酶切位點)
下游引物3:AATTGCGGCCGCTCAAGCGGCTCC AGCAGCAT(下劃線為Not I酶切位點)
以第一鏈cDNA為模板,用上游引物1和下游引物進行PCR擴增。擴增程序如下:95 ℃,3 min;95 ℃,30 s,60 ℃,30 s,72 ℃,1 min,30個循環;72 ℃延伸7 min。獲得PCR擴增產物1,再以產物1為模板,用上游引物2和下游引物,按上述程序進行擴增,PCR產物用1.2%的瓊膠糖電泳進行檢測,回收與理論大小相同的基因片段。將純化的目的基因進行TA克隆,選取陽性克隆子進行測序。
1.2.4 角質酶工程菌的構建及其在畢赤酵母中的表達 將測序正確的陽性克隆子質粒和pPIC9K質粒分別用EcoR Ⅰ和Not Ⅰ進行雙酶切,回收目的基因和線性載體。用T4 DNA鏈接酶將角質酶目的片段和pPIC9K進行連接,獲得重組質粒pPIC9K-Cut。用堿裂解法大量提取和純化pPIC9K-cut質粒,并用限制性內切酶進行37 ℃保溫,使質粒單限制性內切酶酶切線性化;參照畢赤酵母表達試劑盒操作說明,線性化后的質粒用電轉化的方法轉入pichia pastoris GS115細胞中;涂布在RD培養基中,置于28 ℃培養箱進行培養2~4 d。挑取平板上生長出來的菌落于液體YPD培養基中28 ℃培養過夜,按1%比例將菌液轉入100 mL的小搖瓶,并將培養基替換成BMMY誘導培養基,并用1%甲醇進行誘導表達,誘導后收集表達上清,上清樣品用15% SDS-PAGE電泳檢測。挑遺囑表達量較高的菌株在最優條件下進行誘導表達,每24 h取樣,樣品用于酶活力檢測和蛋白濃度測定。
蛋白濃度的定量:利用BCA 蛋白質定量檢測試劑盒測定蛋白濃度。
酶活力的測定:用連續分光光度計法,在30 ℃條件下,20 μL酶液加入980 μL 含50 mM對硝基苯丁酸脂(pNPB)、0.2%的Triton X-00、0.43 M的四氫呋喃,50 mmol/L的Tris-Hcl緩沖液中(pH8.0),在405 nm處,記錄對硝基酚的生成速率。酶活定義:在30 ℃和pH8.0條件下,每分鐘催化對硝基苯丁酸脂水解生成1 μmol對硝基酚的酶量即為一個酶活力單位。
1.2.5 重組角質酶的分離純化 收集重組菌株發酵液上清100 mL,用55%硫酸銨進行鹽析。10000×g,離10 min,去上清,取沉淀,用5 mL的25 mml/L pH7.4的磷酸鹽緩沖液進行重懸。重懸后12000×g,離心15 min,取上清液用于下一步的純化。
將鹽析獲得的樣品用脫鹽柱HiTrapTMDesalting,替換成25 mmol/L pH7.4磷酸緩沖液。將脫鹽的收集樣品用高效離子交換色譜(CM)進一步分離。分離純化的條件如下:用平衡液平衡柱子后進行上樣,并用平衡沖平上樣柱,0~100%洗脫液梯度洗脫30 min,收集洗脫峰。平衡液:25 mmol/L pH7.4磷酸緩沖液;洗脫液:25 mmol/L pH7.4含1 mol/L NaCl的磷酸鹽緩沖液;流速為1 mL/min;檢測波長為280 nm。
經CM離子交換柱純化收集的樣品,用凝膠過濾注進行進一步分離純化,并把收集的樣品SDS-PAGE電泳檢測。
1.2.6 重組角質酶的酶學性質研究
1.2.6.1 最適反應pH和pH穩定性 在37 ℃條件下,測定重組角質酶在不同pH5.0~11.0緩沖液體系中的酶活力:pH3.0~7.0的McIlvaine緩沖液(0.2 mol/L磷酸氫二鈉/0.1 mol/L檸檬酸),pH7.0~9.0的0.1 mol/L的Tris-HCl緩沖液,以及pH9.0~11.0的0.1 mol/L的Gly-NaOH緩沖液。以測定的最高酶活力為100%,計算不同pH下的相對酶活力,確定最適反應pH。
將重組酶放在不同pH緩沖液中37 ℃水浴中保溫1 h,在最適反應條件下測定酶活力。以未經保溫的酶液為100%,計算各pH下的殘余酶活力,確定該酶的pH穩定性。
1.2.6.2 最適反應溫度和溫度穩定性 在最適pH的條件下,測定酶液在不同溫度(20、30、40、45、50、55、60 ℃)下的酶活力,以測定的最高酶活力為100%,計算不同溫度下的相對酶活力,確定最適反應溫度。
將酶液分別于不同溫度水浴中保溫,并在相應的時間點取樣,測定該酶在最適反應條件下的酶活力。將未處理的酶液作為100%對照,計算各溫度條件下重組酶的殘余酶活力,確定該酶的溫度穩定性。
1.2.6.3 金屬離子和表面活性劑及抑制劑對角質酶活性的影響 在重組酶的最適反應條件下,在酶促反應體系中分別加入9種金屬離子及5種表面活性劑及抑制劑(終濃度分別為10 mmol/L),包括:NaCl、KCl、MgSO4、BaCl2、CuSO4、FeSO4、ZnSO4、MnCl2、NiCl2,測定酶活力,以同樣條件下未加金屬離子和表面活性劑,抑制劑的酶促反應作為對照組,分析不同金屬離子及表面活性劑及抑制劑對重組酶活性的影響。
1.3 統計分析
實驗中每個處理重復3次,采用SPSS 17.0軟件進行數據的顯著性分析,應用Origin 7.0軟件作圖。
2 結果與分析
2.1 高產角質酶菌株的篩選
由表1可見,10株能產生透明圈的細菌中有4株菌具有角質酶活力,其中菌株K35酶活力最高,選取菌株K35進行菌種鑒定、酶學性質研究。

表1 產角質酶菌株的篩選結果Table 1 Screening of strains producing cutinase
2.2 串珠鐮孢菌角質酶基因的克隆
提取串珠鐮孢菌RNA,經反轉錄得到第一鏈cDNA,以cDNA為模板,用角質酶特異性引物進行PCR擴增。PCR產物經1.2%瓊脂糖電泳檢測,從圖1中可以看到,一條清晰的、大小約為700 bp的特異性條帶,角質酶基因的理論大小為693 bp左右,電泳圖與理論值相近,初步確定為所需的目的條帶。基因測序結果(圖2)表明,該基因全長693 bp,編碼231個氨基酸的成熟蛋白,經NCBI序列比對可確定為來源于串珠鐮孢菌(FusariummoniliformeSheld)的角質酶蛋白。

圖1 PCR擴增產物電泳圖Fig.1 PCR product in cutinase gel

圖2 角質酶基因核酸序Fig.2 Nucleic acid sequence of cutinase gene
2.3 重組角質酶的構建與表達
所獲得的角質酶基因,經過酶切、連接和鑒定獲得重組質粒,重組質粒被轉入畢赤酵母GS115細胞中進行表達。搖瓶誘導篩選的表達上清經SDS-PAGE檢測,在20.1 kDa附近有一表達條帶,這與角質酶蛋白的理論大小21 kDa相近。一株高表達量的角質酶重組菌株用1%甲醇進行誘導表達,在表達過程中收集樣品用于酶活測定和蛋白含量測定,表明在甲醇誘導96 h時,角質酶的活性為71.68 U/mL,蛋白表達量達到0.25 mg/mL。畢赤酵母表達系統是一個高效、穩定的表達系統,可以實現蛋白的分泌表達,易于實現產業化生產。角質酶基因在畢赤酵母中GS115實現了高效表達,這將解決角質酶工業化應用中產量不足的問題。
2.4 重組角質酶的分離純化
表達的重組角質酶發酵液,經過硫酸銨沉淀、脫鹽、離子交換色譜和分子篩純化,圖3為純化過程中收集樣品的SDS-PAGE電泳檢測圖譜,可見最終獲得了電泳純的重組角質酶蛋白,其大小約為20 kDa。表2為重組角質酶純化過程,重組角質酶發酵液的比活力為286.6 U/mg,經過純化得到比活為2490.1 U/mg的純蛋白,純化倍數為8.69。由畢赤酵母表達所得到的重組角質酶,易于分離純化,步驟簡單,能夠獲得高純度的角質酶蛋白。
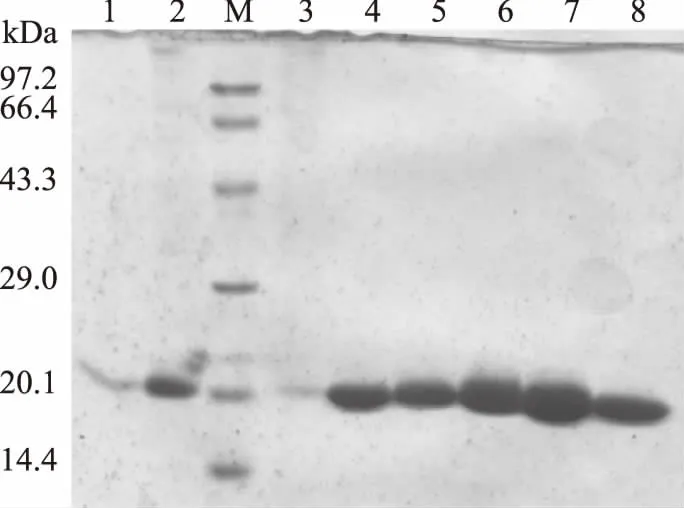
圖3 重組角質酶rAgaLJ-2 SDS-PAGE分析Fig.3 SDS-PAGE analyses of recombinant cutinase注:1:粗酶液;2:脫鹽;3:穿透峰;4~8:洗脫樣品。

表2 角質酶純化表Table 2 Cutinase purification table
2.5 重組角質酶的酶學特性
2.5.1 最適反應pH和pH穩定性 酶的活力受到所處緩沖體系pH的影響,過酸或過堿都會破壞酶的空間構象,以及有關基團的解離,影響酶活部位的構象,導致酶活的喪失;同時pH也影響底物的解離狀態,使底物和酶無法結合或催化,導致酶活力低。不同的緩沖體系中測定重組酶的酶活結果,由圖4可知,pH范圍在5.0~9.0之間重組角質酶的酶活相對穩定;圖5可知,重組酶的最適反應pH為9.0。
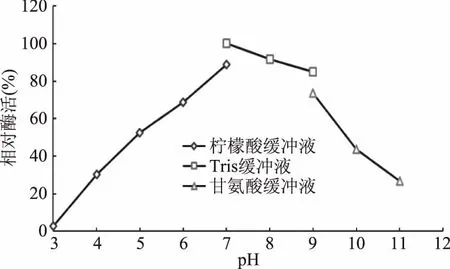
圖4 重組角質酶的pH穩定性Fig.4 pH stability of recombinant cutinase
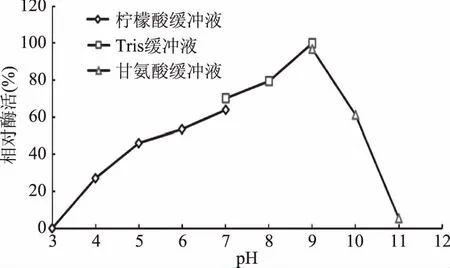
圖5 重組角質酶的最適pHFig.5 Optimal pH of recombinant cutinase
2.5.2 最適反應溫度和熱穩定性 酶的反應在某一低溫范圍內,反應速率隨溫度升高而增大。目前大部分的真菌角質酶的最適反應溫度也在32~40 ℃之間。從圖6可以看出,重組角質酶在20~35 ℃之間隨著溫度升高,相對酶活也逐漸升高,從35~50 ℃之間隨著溫度升高,相對酶活逐漸降低,當溫度高于50 ℃時,酶活快要降到0,重組角質酶的最適反應溫度為35 ℃。從圖7中可知,重組酶在40 ℃穩定性好,保溫一個小時65%以上的酶活,45 ℃保溫1 h能保持40%左右的活性,55 ℃保溫30 min能保持20%左右的活性。
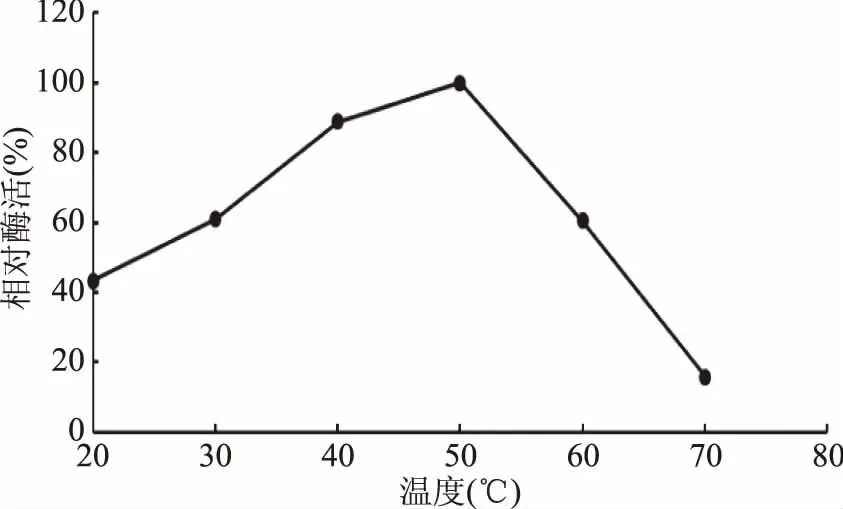
圖6 重組角質酶的最適反應溫度Fig.6 Optimal temperature of recombinant cutinase
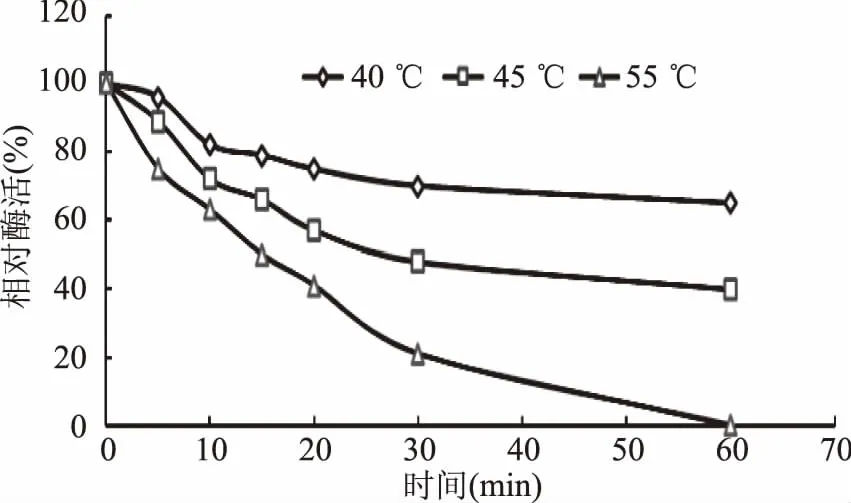
圖7 重組角質酶的熱穩定性Fig.7 Temperature stability of recombinant cutinase
2.5.3 金屬離子和表面活性劑及抑制劑對角質酶活性的影響 不同金屬離子及表面活性劑及抑制劑會破壞角質酶結構進而影響角質酶活力。不同金屬離子及表面活性劑及抑制劑對重組酶活力的影響如表3所示:KCl、Triton X-100、MnCl2、SDS對該酶活有促進作用,NaCl、BaCl2、CuSO4、Tween-20、FeSO4、ZnSO4、NiCl2、EDTA、Tween-80對該酶活有抑制作用。

表3 金屬離子和表面活性劑及抑制劑對角質酶酶活的影響(%)Table 3 Effects of metal ions,surfactants and inhibitors on the activity of cutinase(%)
3 結論
角質酶在工業上具有廣泛的應用前景,如在除草劑中加入角質酶,能提高除草劑的效果;在洗衣液中加入角質酶,能提高洗液的去污能力等[19]。本文通過大通量的篩選,獲取產角質酶的菌株,選取其中酶活力較高的菌株進行種屬鑒定,通過形態學觀察以及16S/18S rDNA序列分析,確定該菌株的種屬為Fusariummoniliforme。再通過克隆角質酶基因,運用pPIC9K質粒及選取畢赤酵母工程菌,成功構建重組角質酶。重組后的工程菌純化的酶學性質研究表明:其最適反應pH為9.0,在pH5.0~9.0范圍內重組角質酶的酶活相對穩定;最適反應溫度為35 ℃,溫度低于40 ℃時重組角質酶的酶活相對穩定,比活為2490.1 U/mg,純化倍數為8.70;KCl、Triton X-100、MnCl2、SDS對該酶活有促進作用,NaCl、BaCl2、CuSO4、Tween-20、FeSO4、ZnSO4、NiCl2、EDTA、Tween-80對該酶活有抑制作用。據報道,陳晟[20]等一種嗜熱細菌的研究中純化后的比活為400.75 U/mg,純化倍數為8.11;麻瑩等[21]在桃褐腐菌角質酶的克隆與表達中純化后的比活為102.00 U/mg。目前報道的角質酶只有少數比活能達到2000 U/mg,說明在畢赤酵母表達純化方面有了較大的提高,具有良好的開發價值。

