微囊化Penicillium purpurogenum Li-3細胞的制備及其催化性能研究
黃曉林,曹 紅,歐陽巧鳳,沈瑞麟,李 春,吳廷華,*
(1.浙江師范大學物理化學研究所,浙江金華 321004;2.嘉興學院生物與化學工程學院,浙江嘉興 314001;3.石河子大學化學化工學院,新疆石河子 832003;4.北京理工大學生命科學與技術學院,北京 100081)
甘草酸(Glycyrrhizic acid,GL)具有抗炎癥、抗病毒、抗腫瘤、抗過敏等作用,在食品中常作為一種甜味劑使用[1-4],但甘草酸分子極性較強,不易穿透細胞膜,因而生物功效受到影響。單葡萄糖醛酸基甘草次酸[5-8](Glycyrrhetic acid 3-O-mono-β-D-glucuronide,GAMG)作為甘草酸衍生物,其分子極性適中,較易穿透細胞被人體充分吸收利用,并且甜度和安全性也更高[9-12]。所以GAMG被認為是發揮甘草酸功效的最佳分子形態。由產紫青霉(PenicilliumpurpurogenumLi-3)[9]表達的β-葡萄糖醛酸苷酶能夠定向催化GL水解外端的一個葡萄糖醛酸基生成GAMG。
相比于化學法合成GAMG,生物法具有條件溫和、反應速率高、能耗低、環境友好等優點[13-18],是合成GAMG最佳選擇[19]。然而傳統游離微生物細胞在生物轉化過程中存在細胞重復利用率低、需菌量大、倒罐易染菌、對培養環境敏感等缺點,微膠囊固定化細胞技術為游離細胞培養過程增強細胞逆境耐受能力、增加底物的轉化量、提高微生物全細胞催化的穩定性和重復利用率提供技術保障。
關于固定化產紫青霉細胞的研究,葉海[20]等采用吸附法以聚氨酯泡沫固定化產紫青霉細胞,其優點在于相比于游離細胞其催化周期縮短了一半,但是固定化細胞容易脫落,重復利用性差。曹紅[21]等利用殼聚糖-海藻酸鈣微膠囊制得了固芯微囊化產紫青霉細胞,固定化細胞的穩定性和重復利用率得到提高。王彩霞[22]等研究硅藻土改性海藻酸鈣固芯微球固定化產紫青霉細胞,表明硅藻土能夠提高固定化細胞催化活力。蔡靜曉[23]等在制得殼聚糖-海藻酸鈣固芯微囊化產紫青霉細胞的基礎上,又研究了固芯液化技術對產紫青霉細胞使用性能的影響,結果顯示,液芯微囊化細胞在細胞的生長情況、傳質性能和催化活性均優于固芯,但制備步驟較繁瑣。為了進一步簡化工藝,溫和反應條件,增大微膠囊內部細胞的生存空間,本文選用具有生物相容性的海藻酸鈉(SA)和羧甲基纖維素鈉(CMC)為囊材,采用兩步法制備液芯微膠囊,研究液芯微膠囊固定化產紫青霉細胞(簡稱液芯微囊化細胞)的制備條件及其催化性能,考察不同因素對微囊化細胞直徑、機械強度、破損率、催化性能的影響,為不斷提高產紫青霉全細胞生物催化劑在甘草酸生物轉化體系中的使用效率提供技術與方法。
1 材料與方法
1.1 材料與儀器
產紫青霉(PenicilliumpurpurogenumLi-3) 實驗室保存菌種;甘草酸 新疆天山制藥廠,純度70%;氯化鈣 上海強順化學試劑有限公司,分析純;羧甲基纖維素鈉(分析純)、海藻酸鈉(化學純)、NaNO3(分析純)、K2HPO4(分析純)、MgSO4·7H2O(分析純)、KCl(分析純) 國藥集團化學試劑有限公司;產酶誘導培養基:甘草酸 2.8 g·L-1,NaNO33.0 g·L-1,K2HPO40.8 g·L-1,MgSO4·7H2O 0.5 g·L-1,KCl 0.5 g·L-1,FeSO4·7H2O 0.001 g·L-1,250 mL錐形瓶分裝100 mL,于120 ℃高壓蒸汽滅菌20 min。
BT101L型蠕動泵 保定雷弗流體科技有限公司;B-011003型酸式滴定管 上海壘固儀器有限公司;AR323CN型電子天平 奧豪斯儀器(上海)有限公司;Agilent 640型紅外分光譜儀 美國安捷倫公司;THZ-C型恒溫振蕩器 太倉市實驗設備廠;CRYODOS-50型凍干機 西班牙艾提艾斯科學醫藥公司;UltiMate-3000型高效液相色譜儀 美國Dionex公司。
1.2 實驗方法
1.2.1 產紫青霉菌懸液的制備 配制產酶誘導培養基,產紫青霉接種量5%,32 ℃ 150 r/min恒溫振蕩培養96 h后,離心(12000 r/min,10 min)棄上清收集菌體,0.9%的生理鹽水洗滌菌體,重懸,重復操作三次后用生理鹽水制成5000 mg/L的產紫青霉菌懸液,于4 ℃冰箱中保存。
1.2.2 微囊化產紫青霉細胞的制備 配制30 mL濃度為1.0% w/v的CMC與濃度為1.5% w/v的CaCl2的混合溶液,無菌條件下加入3% v/v菌懸液,磁力攪拌均勻。混合液經蠕動泵(120 r/min)勻速滴入經磁力攪拌的100 mL 1.0% w/v的SA溶液后,迅速形成球狀微囊化細胞,滴加結束后攪拌5 min,用孔徑約1 mm漏網濾去SA溶液,無菌水沖洗三次微囊化細胞,濾紙吸干其表面水分,隨后置于100 mL的1% w/v的CaCl2溶液中靜置固化囊膜30 min,再經無菌水沖洗三次,即得微囊化產紫青霉細胞,以上所需溶液除菌懸液均120 ℃高壓蒸汽滅菌20 min后冷卻至室溫使用。
1.2.3 微膠囊宏觀形態表征 按1.2.2實驗方法制得微膠囊,將微膠囊分為三組,a:不做任何處理;b:冷凍干燥36 h;c:經1.2.6.3中方法生物催化第1批次后回收的微囊化細胞,濾去培養基,經去離子水沖洗;用普通相機分別對三組拍照。
1.2.4 紅外分析(FT-IR)分析 樣品充分干燥后,取少量樣品與KBr混合,研細、壓片,光譜掃描范圍4400~400 cm-1,掃描速度中速,掃描16次。
1.2.5 不同因素對微囊化細胞的影響 分別對CMC濃度、SA濃度、滴注液中CaCl2濃度、固化過程CaCl2濃度、加菌量進行優化,各因素優化條件如表1所示,其余按照1.2.2項下的方法與條件制備微囊化細胞,以各因素對微囊化細胞直徑、機械強度、破損率及催化特性的影響為考察指標,各因素在前一因素最佳水平下逐級優化。

表1 各因素優化條件Table 1 Optimization conditions of various factors
1.2.6 指標測定

1.2.6.2 微囊化產紫青霉細胞物理機械強度的測定 采用單軸按壓法[25]測定微囊化產紫青霉細胞機械強度,用藥匙在電子天平上按壓微囊化細胞,臨界破裂時電子天平最大讀數表示其機械強度,測量30粒微囊化細胞,取平均值。

色譜分析條件:戴安UltiMate-3000,色譜柱:InertSustain C18,ODS(250 mm×4.6 mm i.d.,5 μm),檢測器:SPD,工作站:LCsoLution,檢測波長:254 nm,柱溫箱:30 ℃,進樣量:20 μL,流速:0.7 mL/min,流動相:甲醇:重蒸水(加入適量醋酸,pH3.0)=81∶19。

1.2.7 微囊化產紫青霉細胞重復利用 微囊化細胞按1.2.6.3培養,每批次培養終點取樣檢測GAMG濃度,取出微囊化細胞無菌水沖洗三次,加入到新配產酶誘導培養基,進行重復利用催化反應,以微囊化細胞相對活性(%)=每批次生物轉化反應結束時GAMG產率/第1批次生物轉化反應結束時GAMG產率×100計算。
1.3 數據處理
微囊化細胞直徑、破損率、催化特性、重復利用性均平行測量三次,機械強度平行測量30次,數據差異顯著性分析采用SPSS 17.0軟件,應用Origin 8.0軟件作圖。
2 結果與分析
2.1 微膠囊宏觀形態分析
由圖1可知,CMC與SA制備的是透光性良好的微膠囊(a),微膠囊球形度良好且表面光滑;冷凍干燥后的微膠囊(b),部分保持了球狀,部分癟皺,說明微膠囊具有一定抗收縮能力[26]。生物催化后的微囊化細胞(c),可以清晰看出微囊化產紫青霉細胞形態完整,晶瑩通透,肉眼可見囊內菌絲,說明此微囊化環境對產紫青霉具有良好生物相容性。

圖1 微膠囊及微囊化細胞的外觀Fig.1 The appearance of microencapsule and microencapsulted cells注:a:微膠囊;b:凍干微膠囊;c:生物催化第1批次后,回收的微囊化細胞;“”代表比例尺為5 mm。
2.2 微膠囊樣品紅外分析
圖2為不同樣品的紅外光譜圖,從圖2a可以看出樣品CMC具有典型的特征峰,其中3424 cm-1是-OH伸縮振動,2923 cm-1是-CH2不對稱伸縮振動,1615、1425 cm-1分別是-COO-的不對稱伸縮振動峰和對稱伸縮振動峰,1055 cm-1為伯醇C-O伸縮振動峰,1115 cm-1為CMC的醚鍵O-C-O。對比樣品a、b,峰位置一致,紅外分析結果表明CMC與氯化鈣混合物可能僅僅發生物理共混,即CMC為Ca2+的增稠劑[27]。從圖2c可見,樣品SA在1300 cm-1處為C-C-H和O-C-H伸縮振動峰,1030 cm-1是由C-O-C伸縮振動引起[28]。圖2d為SA與CaCl2混合物紅外圖譜,2923 cm-1處是環上的-CH伸縮振動,峰強度降低,是因為海藻酸鈣的網狀結構限制了六元環上-CH的伸縮振動,945 cm-1峰消失,882 cm-1峰減弱,說明部分羥基氧參與了配位反應,O-H的鍵能降低[29]。對比樣品c、d紅外圖譜,說明SA與Ca2+發生了交聯作用。樣品e與a、b、c、d紅外圖譜對照可知,形成的微膠囊結構類似SA與Ca2+混合物。

圖2 微膠囊樣品紅外圖譜Fig.2 The infrared spectrum of microcapsule 注:a:CMC;b:CMC和CaCl2混合物;c:SA;d:SA和CaCl2混合物;e:微膠囊。
2.3 微囊化產紫青霉細胞工藝研究
2.3.1 滴注液中CMC濃度對微囊化細胞的影響 由圖3a可知,隨著CMC濃度增大,微囊化細胞直徑明顯減小,這是因為CMC濃度較低時,其粘度較低,對Ca2+的束縛能力較弱,Ca2+迅速向外擴散,與SA結合形成直徑較大的微囊化細胞。當CMC濃度增大,芯材粘度增大,對Ca2+束縛的能力增強,Ca2+向外擴散速率降低,與SA結合形成直徑較小的微囊化細胞。由圖3b可知,隨著CMC濃度增大,微囊化細胞的機械強度先增大后減小。機械強度先增大,是因為CMC粘度增大,對保持微囊化細胞形態具有一定支撐作用,增強了微囊化細胞的抗壓能力、柔韌性,故破損率也較小,而當CMC粘度過大時,根據斯托克斯-愛因斯坦[30](Stocks-Einstein)方程(Dt=TKB/3πηd),溶液粘度η越大,擴散系數Dt越小,Ca2+向外擴散能力減弱,CMC對Ca2+的束縛作用加強,減少了SA與Ca2+的結合,囊膜的抗壓能力減弱,破損率略上升;當CMC濃度為1.4%時破損率差異性顯著(p<0.05),微囊化細胞具有較好的機械強度,而囊膜的抗壓能力也較好,破損率最小。GAMG產率先增加后減小,這是由于CMC濃度增大,微囊化細胞的機械強度增加,破損率減小,產率增加;當CMC濃度過高,芯材粘度較大,會阻礙GL與GAMG在微囊化細胞中的擴散,使得GAMG產率降低。綜上所述,CMC濃度為1.4%最佳。

圖3 CMC濃度對細胞微囊化效果的影響Fig.3 Effect of the concentration of CMCon the microencapsulated cells注:同一指標字母相同,表示差異不顯著(p>0.05), 字母不相同,表示差異顯著(p<0.05);圖4~圖7同。
2.3.2 SA濃度對微囊化細胞的影響 如圖4a,隨著SA濃度增大,微囊化細胞的直徑逐漸減小,這是因為Ca2+濃度固定時,SA濃度增大,Ca2+來不及向外擴散即與SA位點結合,SA濃度越大,Ca2+向外擴散距離越短,故形成的微囊化細胞直徑越小。由圖4b可知,隨SA濃度增大,微囊化細胞的機械強度增大,破損率逐漸減小,這是因為SA濃度增大,Ca2+與SA位點結合越致密,微囊化細胞抗壓能力增大,抗流體剪切能力增大。GAMG產率先增加后減小,是因為SA濃度低時,Ca2+與SA結合較疏松,利于底物的傳入和產物傳出,因此GAMG產率較大,而當SA濃度過大時,微囊化細胞結構致密,不利于產物與底物的擴散,進而導致了GAMG產率的減小。因此選用SA濃度為1.2%。
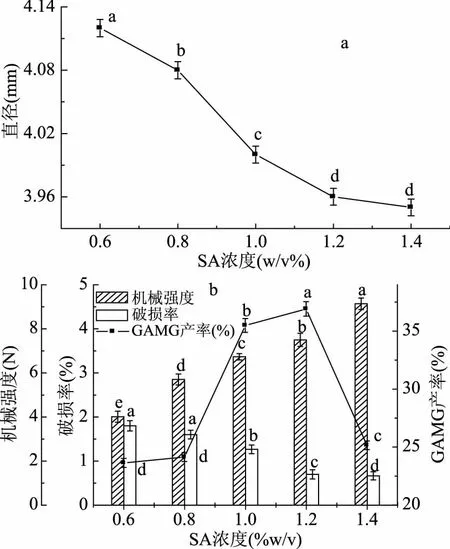
圖4 SA濃度對細胞微囊化效果的影響Fig.4 Effect of the concentration of SA on the microencapsulated cells
2.3.3 滴注液中CaCl2濃度對微囊化細胞的影響 由圖5a可知,隨著CaCl2的濃度增加,微囊化細胞直徑逐漸增大,是因為Ca2+濃度增大,由于濃度梯度推動力,Ca2+向外擴散能力增強,與SA結合形成較大直徑的微囊化細胞[27]。圖5b中微囊化細胞的機械強度先增大后持平,破損率先降低保持不變,這是由于CaCl2的濃度越大,SA與Ca2+凝膠結構越來越緊密,當Ca2+濃度恰好與濃度為1.2%的SA充分結合,則機械強度無法繼續增大。GAMG的產率先增大后減小,當CaCl2的濃度為1.0%時,GAMG的產率最高,這是由于CaCl2的濃度較小時,CaCl2與SA所形成的凝膠結構較疏松,其表面包覆的多余的SA,則導致微囊化細胞表面通孔結構被堵塞,GAMG產率較小;當CaCl2的濃度越高時,SA與Ca2+結合越致密,傳質受阻,導致了GAMG產率減小。在保證一定物理機械強度下,以GAMG產率最大化為優先,選擇CaCl2濃度為1.0%。

圖5 CaCl2濃度對細胞微囊化效果的影響Fig.5 Effect of the concentration of CaCl2on the microencapsulated cells
2.3.4 固化過程CaCl2溶液濃度對微囊化細胞的影響 固化囊膜過程是在微囊化細胞成形后,將微囊化細胞置于低于成囊CaCl2濃度的Ca2+溶液中,低濃度Ca2+可以從微膠囊外表面由外向內擴散,相比未固化的微囊化細胞,固化的微囊化細胞直徑明顯變小,隨著固化過程CaCl2濃度增大,直徑越來越小(見圖6a)。這是由于成囊過程中較高濃度Ca2+滴入SA后,Ca2+向外擴散與SA位點結合,Ca2+擴散平衡后,微囊外層仍有較多SA,囊膜層也較厚,而放置在低濃度的Ca2+溶液,Ca2+由外向內擴散與微囊化細胞外層SA空缺位點結合,結構變得更加致密,因而直徑逐漸減小。由圖6b可知,固化過程CaCl2濃度對微囊化細胞的機械強度影響最大,破損率從54.0%降至0,機械強度也迅速增大。這是由于固化過程CaCl2濃度越大,更能充分與SA結合,使微膠囊囊膜結構更加致密,因而機械強度較大。固化過程CaCl2濃度增大,GAMG產率先增加后迅速減小,是因為固化過程CaCl2濃度較低時,Ca2+與SA形成的凝膠結構疏松,利于傳質,而當固化過程CaCl2濃度增大,微囊化細胞結構致密,傳質受阻較大,甚至底物較難傳遞到囊膜內,細胞因缺乏營養而生長代謝過程受阻,故GAMG降低。綜上所述,固化囊膜過程CaCl2的濃度選擇0.5%,此時GAMG產率最高、具有一定機械強度。

圖6 固化過程CaCl2濃度對細胞微囊化效果的影響Fig.6 Effect of the concentration of the post cured CaCl2 on the microencapsulated cells
2.3.5 滴注液中加菌量對微囊化細胞的影響 由圖7a可以看出,加菌量增加,微囊化細胞直徑先增大后減小,加菌量為3.0%時差異性顯著(p<0.05),直徑最大。加入2.0%菌體,芯材粘度稍大,細胞直徑較小,而菌體含量超過3.0%且繼續增加時,對芯材有稀釋作用,Ca2+濃度降低,Ca2+向外擴散能力減弱,微囊化細胞直徑減小。圖7b中,隨著加菌量增加,機械強度先增大后減小,機械強度增大,是因為加入少量菌體,降低了芯材的粘度,促進了Ca2+與SA的結合,使機械強度增大,而加菌量越多,對Ca2+的稀釋作用越大,能與SA結合Ca2+相應減少,從而降低了微膠囊結構的致密性,導致機械強度越來越小。隨著加菌量增加,GAMG的產率先增大后減小,當加菌量為3.0%時,GAMG的產率最大。這是由于當加菌量過低時,微膠囊包埋的菌體量少,GAMG的產率不高;當加菌量增加時,微膠囊包埋的菌體量增加,形成了細胞團聚纏繞,細胞團內部的供氧困難,造成中心細胞團出現壞死現象[31],GAMG的產率降低。綜上所述,選擇加菌量為3.0%。
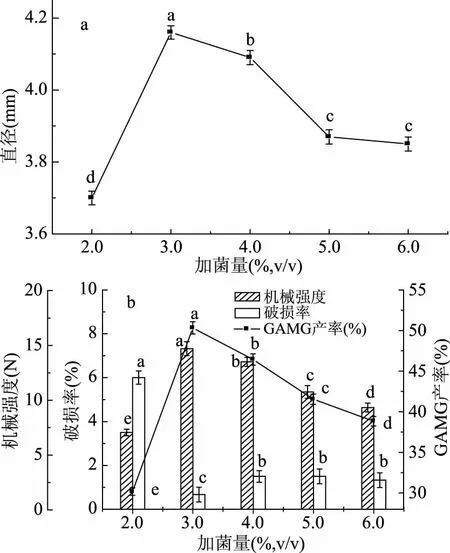
圖7 加菌量對細胞微囊化效果的影響Fig.7 Effect of the concentration of cells on the microencapsulated cells
2.3.6 微囊化細胞重復利用 在最優條件下制備微囊化產紫青霉細胞進行重復利用實驗,如圖8所示,隨著使用批次的增加,微囊化細胞的相對活性逐漸降低,但重復使用9次后微囊化細胞相對活性仍能達到56.9%。

圖8 微囊化細胞重復使用Fig.8 Repeated use of microencapsulated cells
3 結論
以SA與CMC制備的微囊化產紫青霉細胞為載體,表征發現微膠囊表面平整,微膠囊的紅外圖譜表明樣品為SA與CaCl2的混合物,可見SA與Ca2+發生交聯作用形成了微膠囊,以微囊化細胞的直徑、機械強度、破損率及催化特性為考察指標,優化微膠囊制備條件,最優制備條件為:羧甲基纖維素鈉的濃度為1.4%,海藻酸鈉的濃度為1.2%,CaCl2的濃度為1.0%,固化囊膜過程CaCl2濃度為0.5%,加菌量為3.0%,此條件下,微囊化細胞重復利用9次后,相對活性達到56.9%,具有較好的重復利用性能。

