清熱化痰解毒方預處理對腦缺血再灌注損傷大鼠的保護作用及其對TXNIP/NLRP3通路的影響
王 濤,劉宏祥,王 穎,齊 姣,史小盼,王 丹
(河北大學附屬醫院中西醫結合科,河北保定 071000)
缺血性腦卒中屬于臨床常見腦損傷疾病,近年來發病率逐漸升高,對人類健康造成嚴重的威脅,給患者帶來經濟、心理負擔[1]。近年來中藥在治療腦出血方面取得較好的療效,其中清熱化痰解毒方具有清熱解毒效果,在腦缺血治療中應用較多[1]。硫氧還蛋白結合蛋白(TXNIP)是機體內重要的氧化應激因子,在心肌缺血及腦缺血中研究較多,有文獻報道機體處于疾病狀態時,其能夠結合NALP3炎性體,激活NALP3信號通路,進而激活炎性反應導致腦梗死[2]。然而清熱化痰解毒方對TXNIP/NLRP3通路的作用機制,目前尚不清楚。本研究通過制備腦缺血再灌注損傷大鼠模型,觀察清熱化痰解毒方預處理后對大鼠神經功能及TXNIP/NLRP3通路的影響,以探究清熱化痰解毒方的藥理機制。
1 材料與方法
1.1動物 SPF清潔級SD大鼠90只,8周齡,體質量200~260 g,由北京生命科學研究所動物實驗中心提供,合格證號SYXK(京)2015-0002,所有動物均嚴格按照動物飼養規則喂養,溫度為25 ℃,濕度為60%。本研究經北京動物倫理委員會批準同意,批號為IACUC-01(20160917)。
1.2藥品及試劑 清熱化痰解毒方(主要成分:瓜蔞10 g,郁金10 g,石菖蒲10 g,蒲公英10 g,丹參10 g,桔梗10 g,杏仁10 g,射干10 g,川貝10 g,黃芩10 g,均購自于張仲景大藥房);尼莫地平注射液(山東新華制藥股份有限公司;批號D14202003034;規格10 mL/2 mg);三苯基氯化四氮唑(Amresco 公司,批號298964);TXNIP、NLRP3兔抗鼠單抗(英國Abcam公司,批號分別為14623S、14781S);凋亡相關斑點樣蛋白(ASC)、白細胞介素1β(IL-1β)、半胱天冬酶1(caspase-1)兔抗鼠單抗(美國Santa Cruz公司,批號分別為752610、752916、753304);羊抗鼠IgG二抗(上海容創生物科技有限公司,批號RJC1793);蘇木素染液、伊紅染液(美國Sigma公司,批號YYJK-923、230251);BCA試劑盒(上海經科化學科技有限公司);RNA提取試劑盒(北京天根生化科技有限公司);反轉錄試劑盒(美國Genecopoeia公司);尼康SMZ745光學顯微鏡(上海普赫生物科技有限公司);CFX96 PCR儀(美國BioRad公司);GIS-500凝膠成像儀(杭州Miulab公司)。
1.3方法
1.3.1動物分組與給藥 所有大鼠按照隨機數字表法分為假手術組、模型組、尼莫地平預處理組(8.0 mg/kg),清熱化痰解毒方低、中、高劑量預處理組,每組15只預處理組大鼠在進行造模前3天開始每天2次(每天上午9:00和下午16:00)灌胃給藥,最后一次給藥于造模前3 h,共計給藥7次,假手術組、模型組大鼠均灌胃等量0.9%生理鹽水。預處理對應給藥劑量為成人的6.25倍,所有大鼠平均體質量220 g,則大鼠每天給藥劑量為 6.5 mg/kg,設置清熱化痰解毒方低、中、高劑量藥物劑量為6.5、13.0、26.0 mg/kg,尼莫地平給藥劑量為8.0 mg/kg。
1.3.2腦缺血再灌注損傷模型大鼠制備 于大鼠腹腔注射10% 3.5 mg/kg水合氯醛麻醉,參考文獻[3],依次使右頸總動脈及頸外、頸內動脈暴露,在頸外動脈遠端處結扎,在其殘端處插入直徑為0.24 mm栓線,穿過頸總動脈進入內動脈,進而阻斷大腦中動脈血流,持續10 min后,完成預缺血處理。3 d后重新麻醉大鼠,并推進栓線,2 h后將栓線完全抽出,模型制備結束。假手術組大鼠僅進行右頸總動脈分離處理。
1.3.3大鼠神經功能缺損評分 造模后待大鼠醒后觀察其行為變化,參照LONGA[4]分級法對神經功能進行評定,大鼠無神經功能缺損為0分;出現不能完全伸展對側前爪等輕度神經功能缺損為1分;行走出現對側旋轉等輕中度神經功能缺損為2分;行走出現對側傾倒等輕重度神經功能缺損為3分;意識完全喪失,不能行走為4分。重復評定3次,取平均值作為最終評分,評分為1~3分說明模型制備成功。
1.3.4大鼠腦梗死面積測定 造模后24 h,隨機選取6只大鼠,斷頭取腦后,將額極、枕極切除,沿冠狀切面切割為5片,置于2%三苯基氯化四氮唑(TTC)磷酸鹽緩沖液中,放置37 ℃恒溫水浴鍋中,黑暗下孵育30 min,染色均勻后,棄去TTC,將腦切片放置于4%多聚甲醛中,4 ℃固定24 h,拍照后,采用Image pro軟件進行分析處理,計算大鼠腦梗死面積。腦梗死面積=全腦梗死面積/全腦片面積×100%。
1.3.5蘇木素-伊紅(HE)染色觀察大鼠腦組織病理學變化[5]造模后選取6只大鼠,處死后將腦組織放置于4%多聚甲醛溶液固定,制備石蠟切片,在二甲苯中固定30 min,隨后在質量分數為100%、95%、85%、75%的乙醇溶液中分別脫水5 min;蒸餾水沖洗后,加入蘇木素染色10 min,隨后置于1%鹽酸5 s后,蒸餾水進行沖洗。滴加伊紅染液進行復染5 min,在不同濃度的乙醇溶液中脫水2 min,加入二甲苯進行透明處理,滴加中性樹脂封片,置于光學顯微鏡下進行觀察。
1.3.6RT-PCR法檢測腦皮質中NLRP3、ASC、IL-1β、caspase-1 mRNA表達 大鼠處死后取大鼠缺血側腦皮質,參照RNA提取試劑盒提取總RNA,用反轉錄試劑盒反轉錄為cDNA,PCR引物序列見下表1。反應體系為20 μL:2×SYBR Mix 10.0 μL,H2O 8.0 μL,上、下游引物各0.5 μL,10×cDNA模板1.0 μL。反應條件設定為:95 ℃預變性5 min;95 ℃ 變性10 s、60 ℃ 退火30 s,72 ℃ 2 min,40個循環;72 ℃ 10 min。以GADPH作為內參基因根據2-ΔΔCt算法計算各組mRNA表達水平。

表1 PCR引物序列
1.3.7Western blot檢測腦皮質中 TXNIP、NLRP3、ASC、IL-1β、caspase-1蛋白表達 將缺血側腦皮質剪碎,添加蛋白裂解液置于冰上放置30 min,離心后收集上清液,參照BCA試劑盒測定腦皮質蛋白總濃度,配制10%分離膠和5%濃縮膠,取50 μg蛋白上樣進行電泳和轉膜反應,結束后用TBST溶液清洗,加入5%脫脂牛奶室溫下進行1 h封閉,TBST溶液清洗后,加入一抗(TXNIP、NLRP3、ASC、IL-1β、caspase-1抗體,稀釋倍數1∶500),4 ℃過夜,TBST溶液清洗后加入羊抗鼠IgG二抗(稀釋倍數1∶10 000),室溫下孵育2 h,TBST清洗后ECL顯色后置于凝膠成像儀中觀察各組蛋白表達情況。
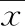
2 結 果
2.1清熱化痰解毒方對大鼠神經功能缺損評分的影響 假手術組,模型組,尼莫地平組,清熱化痰解毒方低、中、高劑量組大鼠神經功能缺損評分分別為0、(2.56±0.48)、(1.47±0.29)、(2.02±0.31)、(1.75±0.27)、(1.35±0.19)分。與假手術組比較,模型組大鼠神經功能缺損評分升高,差異有統計學意義(P<0.05);與模型組比較,尼莫地平組,清熱化痰解毒方低、中、高劑量組神經功能缺損評分均下降,呈劑量依賴性,差異有統計學意義(P<0.05)。
2.2清熱化痰解毒方對大鼠腦梗死面積的影響 假手術組,模型組,尼莫地平組,清熱化痰解毒方低、中、高劑量組大鼠腦梗死面積分別為0、(33.47±3.21)%、(9.38±1.26)%、(26.36±3.19)%、(15.74±3.27)%、(11.26±2.13)%。與假手術組比較,模型組大鼠腦梗死面積升高,差異有統計學意義(P<0.05);與模型組比較,尼莫地平組和清熱化痰解毒方低、中、高劑量組大鼠腦梗死面積均下降,呈劑量依賴性,差異有統計學意義(P<0.05),見圖1。

A:假手術組;B:模型組;C:尼莫地平組;D:清熱化痰解毒方低劑量組;E:清熱化痰解毒方中劑量組;F:清熱化痰解毒方高劑量組
圖1各組大鼠腦組織TTC染色情況
2.3清熱化痰解毒方對大鼠腦皮質組織病理學的影響 假手術組大腦皮質細胞未出現明顯病理學損害,細胞形態規則,排列緊密。模型組大腦皮質細胞出現明顯破裂、排列紊亂,細胞核固縮,且周圍出現較大空泡,細胞明顯壞死;清熱化痰解毒方各劑量組細胞損害有所降低,隨著藥物處理濃度的升高,細胞出現腫脹減輕,壞死細胞數量逐漸減少,見圖2。

A:假手術組;B:模型組;C:尼莫地平組;D:清熱化痰解毒方低劑量組;E:清熱化痰解毒方中劑量組;F:清熱化痰解毒方高劑量組
圖2清熱化痰解毒方對大鼠腦皮質組織病理學的影響(HE×100)
2.4清熱化痰解毒方對腦皮質中NLRP3、ASC、IL-1β、caspase-1 mRNA的影響 與假手術組比較,模型組大鼠腦皮質中NLRP3、ASC、IL-1β、caspase-1 mRNA表達升高,差異有統計學意義(P<0.05);與模型組比較,尼莫地平組,清熱化痰解毒方低、中、高劑量組NLRP3、IL-1β、ASC、caspase-1 mRNA表達降低,呈劑量依賴性,差異有統計學意義(P<0.05)。見表2。
2.5清熱化痰解毒方對腦皮質中TXNIP、NLRP3、ASC、IL-1β、caspase-1蛋白的影響 與假手術組比較,模型組大鼠腦皮質中TXNIP、NLRP3、ASC、IL-1β、caspase-1 蛋白表達升高,差異有統計學意義(P<0.05);與模型組比較,尼莫地平組,清熱化痰解毒方低、中、高劑量組TXNIP、NLRP3、IL-1β、ASC、caspase-1蛋白表達降低,呈劑量依賴性,差異有統計學意義(P<0.05)。見圖3、表3。
2.6清熱化痰解毒方對腦皮質中TXNIP、NLRP3、ASC、IL-1β、caspase-1蛋白陽性表達率的影響 與假手術組比較,模型組大鼠腦皮質中TXNIP、NLRP3、ASC、IL-1β、caspase-1 蛋白陽性表達率升高,差異有統計學意義(P<0.05);與模型組相比,尼莫地平組,清熱化痰解毒方低、中、高劑量組TXNIP、NLRP3、IL-1β、ASC、caspase-1蛋白陽性表達率降低,呈劑量依賴性,差異有統計學意義(P<0.05),見表4。

A:假手術組;B:模型組;C:尼莫地平組;D:清熱化痰解毒方低劑量組;E:清熱化痰解毒方中劑量組;F:清熱化痰解毒方高劑量組

圖3 清熱化痰解毒方對腦皮質中TXNIP、NLRP3、ASC、IL-1β、caspase-1蛋白的影響
a:P<0.01,與假手術組比較;b:P<0.05,c:P<0.01,與模型組比較

表3 清熱化痰解毒方對腦皮質中TXNIP、NLRP3、ASC、IL-1β、caspase-1、β-actin蛋白表達影響±s)
a:P<0.01,與假手術組比較;b:P<0.05,c:P<0.01,與模型組比較

表4 清熱化痰解毒方對腦皮質中TXNIP、NLRP3、ASC、IL-1β、caspase-1蛋白陽性表達率的影響±s,%)
a:P<0.01,與假手術組比較;b:P<0.05,c:P<0.01,與模型組比較
3 討 論
腦缺血發生率、致死率較高,以往臨床上治療腦缺血常用的方式為溶栓,但其容易引發缺血再灌注損傷,加重病情。TXNIP介導的NLRP3信號通路在缺血性灌注損傷中發揮重要作用[6-7]。目前在早期心肌缺血再灌注損傷中已對TXNIP/NLRP3信號通路進行研究,抑制該通路后能夠保護小鼠缺血再灌注心肌受損[8],但在腦缺血再灌注損傷中研究較少,本研究通過對腦缺血再灌注損傷大鼠采用清熱化痰解毒方預處理,觀察大鼠神經功能及TXNIP/NLRP3通路的變化,以探究清熱化痰解毒方治療的分子機制,為腦缺血再灌注損傷治療提供一定的參考。
NLRP3是機體內識別免疫系統病原體的重要蛋白,其能夠在ATP、病毒、尿酸鈉誘導下激活,促進其C端結構LRR與配體結合,改變NALP3結構,促進ASC、caspase-1集合形成復合物活化caspase-1,促使IL-1β成熟并分泌至細胞外引發炎性反應,進而在多個系統、器官中發揮致病作用[7-9]。王敏等[10]研究顯示在腦組織小膠質細胞及血管內皮細胞中均有NLRP3炎性體表達。在心肌缺血模型研究中顯示心肌纖維細胞中NLRP3表達水平升高會加劇缺血性再灌注損傷程度[11]。而在腦缺血再灌注損傷發生中NLRP3信號通路的作用尚不明確。本研究結果顯示NLRP3信號通路中NLRP3、ASC、IL-1β、caspase-1表達均升高,提示NLRP3炎性體可能參與腦缺血再灌注損傷的發生,通過給予尼莫地平、大鼠清熱化痰解毒方預處理顯示NLRP3、ASC、IL-1β、caspase-1表達成劑量依賴性降低,并且大鼠腦神經缺損評分及腦梗死面積也降低,說明清熱化痰解毒方可通過抑制NLRP3減輕腦缺血再灌注損傷程度,進而對大鼠腦組織發揮保護作用,效果與尼莫地平相似。
TXNIP屬于機體抗氧化應激反應硫氧還蛋白中重要一員,主要發揮氧化應激作用,近期有研究發現在機體處于疾病狀態下,TXNIP可結合NLRP3使其發生活化,進而激活NLRP3信號通路[12]。本研究結果顯示,大鼠TXNIP/NLRP3信號通路中關鍵蛋白mRNA、蛋白及蛋白陽性表達率均降低,提示清熱化痰解毒方可能抑制TXNIP的表達進而抑制NLRP3信號通路,說明TXNIP/NLRP3信號通路可能參與腦缺血再灌注損傷的發生。
綜上所述,本研究結果提示清熱化痰解毒方預處理能夠抑制TXNIP/NLRP3通路,減輕大鼠腦缺血再灌注損傷,這可能為其作用機制之一,為臨床腦缺血再灌注損傷治療提供了一定的參考。但本研究也存在一定的不足,并未在研究中設計通路抑制劑進行驗證,這還有待后續深入研究。

