探究如何能盡可能多的減少粉筆末
摘要:通過實驗研究粉筆的主要成分,并判斷其溶解性,確定其在何種溶液中溶解度大,借此解決平常粉筆制造及使用過程中粉筆末多的問題,并提出黑白擦制作與應用方法。
關鍵詞:粉筆 硫酸鈣 強酸 銨鹽
一、提出問題
目前粉筆廣泛應用于教學活動,而使用時產生的粉筆末卻隨空氣進入老師及前排學生的呼吸道,不利于健康,并且給值日生造成很大的困難,因此我提出如何可以使粉筆盡量少的產生粉筆末,便利教學活動,并有利于師生身體健康。
二、實驗確定粉筆主要成分及其在各種物質中溶解情況
(一)定性分析
1.研磨粉筆,使其成粉末狀。
2.配成溶液。
3、取上層溶液倒入三個試管中,標號A、B、C。
4.分別向四個試管中加入氫氧化鋇、碳酸鈉、鹽酸觀察現象。
5.確定粉筆主要成分為硫酸鈣。
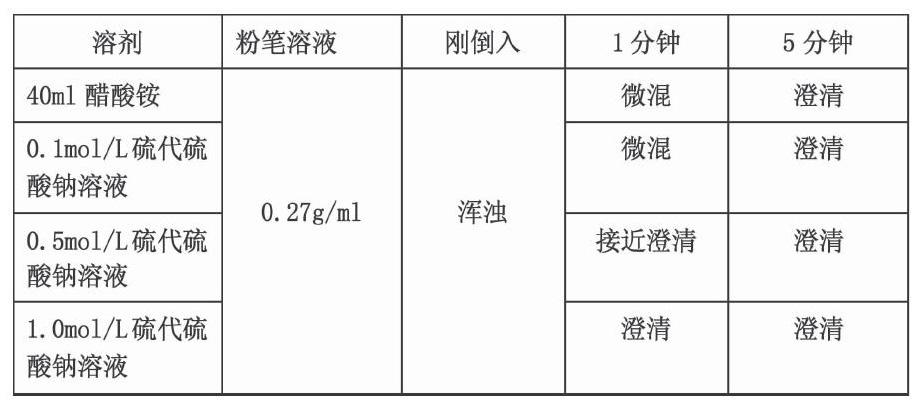
6.再取上層溶液倒入四支試管中,分別加入鹽酸、醋酸、醋酸銨,硫代硫酸鈉,觀察現象。
7.硫酸鈣在鹽酸、醋酸銨溶液、硫代硫酸鈉溶液中溶解性較強。
(二)定量分析
三、實驗原理解釋
(一)粉筆的成分
粉筆是由硫酸鈣的水合物(俗稱生石膏)制成。也可加入各種顏料做成彩色粉筆。在制作過程中把生石膏加熱到一定溫度,使其部分脫水形成熟石膏,后將熟石膏加水攪拌成糊狀,灌入模型凝固而成。生石膏變成熟石膏的反應為(加熱):
CaSO4·2H2O=CaSO4·H2O+H2O
熟石膏加水變成生石膏的反應為(常溫):
CaSO4·H2O+H2O=CaSO4·2H2O
硫酸鈣是白色單斜結晶或結晶性粉末。無氣味。有吸濕性。128℃失去1分子結晶水,163℃全部失水。溶于酸、硫代硫酸鈉和銨鹽溶液,溶于400份水,在熱水中溶解較少,極慢溶于甘油,幾乎不溶于乙醇和多數有機溶劑。相對密度2.32。有刺激性。通常含有2個結晶水,自然界中以石膏礦形式存在。硫酸鈣可用作磨光粉、紙張填充物、氣體干燥劑以及醫療上的石膏繃帶,也用于冶金和農業等方面。
(二)硫酸鈣溶于酸
根據鹽效應理論,加入酸后,除鈣離子與硫酸根離子以外的其它離子都不能形成沉淀。同時,由于離子強度增加,離子間的相互牽制作用加強,使得鈣離子與硫酸根離子在硫酸鈣表面碰撞的幾率降低,硫酸鈣的沉淀變得更加困難,增加了硫酸鈣的溶解度。而且,由于硫酸根離子可與氫離子結合為硫酸氫根離子,生成硫酸氫鈣(易溶于水)使硫酸鈣的溶解度增加。
(三)硫酸鈣溶于醋酸銨溶液
根據鹽效應原理:
醋酸銨是強電解質,在水中完全電離CH3COONH4=CH3COO-+NH4+硫酸鈣屬微溶物質,微電離CaSO4=Ca2++SO42-SO42-與NH4+形成的硫酸銨極易溶于水,因此促進了硫酸鈣的電離,使得CaSO4=Ca2++SO42-的反應向右,硫酸鈣的溶解度增大。
(四)硫酸鈣溶于硫代硫酸鈉溶液
硫代硫酸鈉,又名大蘇打、海波,為單斜晶系白色結晶粉末,易溶于水,不溶于醇,用于分析試劑等,用途非常廣泛。化學式:Na2S2O3,比重1.667,受熱易分解。
絡合(Complexation)是電子對給予體與電子接受體,互相作用而形成各種絡合物的過程。給予體有原子或離子,不論構成單質或化合物,凡能提供電子對的物質;接受體有金屬離子和有機化合物。分子或者離子與金屬離子結合,形成很穩定的新的離子的過程就叫絡合反應,也成配位反應。
硫代硫酸鈉具有很強的絡合能力,它的水溶液能溶解鹵素,能跟溴化銀形成絡合物,反應式:AgBr+2Na2S2O3=NaBr+Na3[Ag(S2O3)2],AgBr+2Na2S2O3=NaBr+Na3[Ag(S2O3)2]。硫酸鈣溶于硫代硫酸鈉溶液正是利用了絡合反應,Ca離子作為絡合物中心原子,生成硫代硫酸鈣,可以溶解。
四、理論應用
一塊黑板擦長12cm,寬5.5cm,高1.5cm,材料為毛氈(主要是羊毛和化纖合成),如果能將黑白擦用海綿制成,在每次使用前放在濃度較低醋酸銨的溶液中,再去擦黑板,可以減少產生粉筆末且易于清洗,簡單用水沖洗即可。
參考文獻:
[1]張英鋒,張永安.新〈高中化學課程標準〉提高學生科學素養的理念[J].教育學報,2004,(11):40-45.
[2]肖雁.運用聯合試驗設計法確定鹽效應適宜條件的研究[D].河北工業大學,2004.
[3]潘曉梅,肖國民,楊志才.鹽效應數學模型及鹽效分離過程綜述[A].第七屆全國精細化學品化學學術會議論文集[C],2004.
[4]楊林.金屬絡合反應的簡介[DB/OL].上海輕工業研究所有限公司研發中心,2016-03-28.
(作者簡介:仲凱音,山東省濟南市山東省實驗中學16級33班,學生。)

