水脅迫下沙漠小球藻蛋白質組學分析
譚君 牟云 周光普 周永順 徐杰 高劍峰
(石河子大學生命科學學院,石河子 832003)
資源、能源和環境是當前人類社會發展面臨和必須解決的三大難題。目前,我國能源短缺,形勢嚴峻,石油等化石能源儲備嚴重不足,遠遠不能滿足經濟和社會高速發展的需要,迫切需要從戰略角度發展新的可再生能源[1]。微藻已被作為重要的可再生能源資源,并已經有許多研究報道了有關微藻的生物學特性。例如,運用雙向電泳技術(2-DE)、研究了集胞藻(Synechocystissp. PCC 6803)的蛋白質[2], 不同濃度 NaCl脅迫下魚腥藻(Anabaena doliolum)蛋白質組學差異[3]以及紡錘形馬尾藻在鎘脅迫下的蛋白質組分的差異[5]。利用2-DE、Western-blot等技術研究熱休克蛋白在逆境中誘導表達并證實了chaperonin 家族的一員HSP60蛋白可通過熱激的方式進行誘導[7]。通過挑選單克隆及多克隆抗體來分析強壯前溝藻(Amphidinium carterae)膜骨架中兩種不同類型的骨架蛋白[8]。此外, Song等[4]研究了在正常和缺氮組球等鞭金藻在油脂積累過程中的蛋白組學變化。Simon等[6]通過質譜分析鑒定了聚胞藻的192種可溶性蛋白。
綜上可知,國內外有關微藻蛋白質組學的研究已有較大的突破,這不僅提高了人們認識微藻及其生命過程的能力,也促進了微藻生物柴油制備的產業化發展。與高等植物相比,有關微藻抗逆的蛋白組學研究就相對滯后;并且有關微藻蛋白組學研究大多集中在海洋藻類,對于沙漠藻類的干旱脅迫蛋白組學研究還未見報道。本研究基于前期建立了沙漠小球藻蛋白質組雙向電泳體系[9],以小球藻為研究對象,改進研究方法,從蛋白質組學水平研究干旱脅迫下小球藻的蛋白質表達特點,旨在為探索沙漠小球藻應答干旱脅迫的分子機制提供試驗依據,為沙漠微藻制備生物柴油的工廠化生產奠定基礎。
1 材料與方法
1.1 材料
所用藻種(Chlorellasp.)由石河子大學生命科學學院細胞與分子生物學實驗室從新疆塔克拉瑪干沙漠沙樣中分離、純化并鑒定。將藻種接種于BBM液體培養基中進行活化,取活化后處于對數生長期的藻液以10%的接種量分別接種至BBM液體培養基和PEG6000添加量為20%的BBM液體培養基中培養,光照強度4 000 lx,12 h光照,溫度為23℃。
1.2 方法
1.2.1 蛋白質提取和定量試驗 采用Trisol法[9-10]提取蛋白質。取適量培養至對數生長期的藻液4℃6 000 r/min離心5 min,所得藻泥用ddH2O清洗3次,得鮮藻泥;經液氮研磨,裝入1.5 mL離心管中,加入1 mL Trisol試劑,震蕩混勻,室溫靜置5 min;加入200 μL氯仿,充分混勻后靜置5 min,4℃ 12 000r/min離心15 min;棄上層無色液體后加入300 μL無水乙醇懸浮下層深紅色液體,4℃ 12 000 r/min離心5 min;轉移上清液至新的離心管中,加入1 mL異丙醇混勻,靜置20 min以沉淀蛋白,4℃ 12 000 r/min離心10 min,沉淀用95%乙醇清洗后空氣中干燥,待蛋白表面光滑后加入一定比例的裂解液溶解蛋白(干粉5 mg:50 μL),于30℃水浴中孵育2-4 h;4℃12 000 r/min離心30 min,所得上清液即為蛋白溶液。采用2D Quant Kit[10]定量蛋白質。分別制備干旱后0、6、12、18、24和30 d的沙漠小球藻全蛋白,備用。
1.2.2 雙向電泳檢測 雙向電泳體系為24 cm IPG膠條水化上樣量450 μg,在泡脹盤中對膠條進行過夜被動泡脹后,使用Ettan IPGphor3等電聚焦儀進行第一向等電聚焦,程序設定為100 V 2 h;300 V 3 h;1 000 V 3 h;3 000 V 3 h;8 000 V 3 h;8 000 V,分別聚焦600 000 Vh、70 000 Vh、80 000 Vh;500 V,任意時間。分兩步平衡,每次15 min(平衡液Ⅰ含6 mol/L尿素、2%SDS、75 mmol/L Tris-HCL(pH8.8)、20% Glycetol(甘油)、0.0002% 溴酚藍和 1%DTT,平衡液Ⅱ含6 mol/L尿素、2%SDS、75 mmol/L Tris-HCL(pH8.8)、20% Glycetol( 甘 油 ) 和 2.5%Lodacetamide(碘乙酰胺)。使用EttanDaltSix垂直板電泳系統,采用厚度為1 mm 12.5%SDS-PAGE分離膠進行第二向SDS-PAGE蛋白電泳。按照以上方法對干旱脅迫后0、6、12、18、24和30 d的蛋白樣品進行雙向電泳[9-10]。以 AgNO3染色法染色[11]。每個樣品進行3次重復,以獲得穩定的差異電泳圖譜。
1.2.3 差異蛋白的篩選 使用ImageScannerⅢ對圖像進行掃描,并用Labscan軟件進行照相,圖像分辨率300 dpi;用ImageMaster Platinum 7.0對掃描結果進行分析,通過背景消減、蛋白質點的檢測與匹配及差異表達量的比較后,將表達量上調或下調2倍以上的蛋白點視作表達量差異點,經ANOVA分析(P<0.05)且重復性較好的蛋白差異點。
1.2.4 質譜分析和數據庫檢索 從凝膠上挖去差異表達蛋白點,委托上海生工生物工程股份有限公司完成膠內酶解及質譜分析;將得到的肽質量指紋圖提交到Mascot(www.matrixscience.com)蛋白數據庫進行搜索參數設定如下:(1)Database:NCBInr;(2)species:Green plants;(3)Enzyme hydrolysates:Trypsin;(4)Fixed modification:Carbamidomethyl(C);(5)Variable modification:Acetyl(Protein N-term)、Deamidated(NQ)、Dioxidation(W)、Oxidation(M);(6)Peptide segment deviation:100 ppm[9]。 符 合質譜要求的蛋白質序列在Gene ontology數據庫中(http://amigo1.geneontology.org/cgi-bin/amigo/go.cgi)進行功能分類。
1.2.5 差異表達蛋白的生物信息學分析 根據小球藻NA64數據庫和網絡數據庫,BLAST鑒定所獲得的差異表達蛋白。用Agri GO進行Gene Ontology(GO)注釋和富集分析[12],用OBAS進行京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)代謝通路富集分析[13]。對沒有獲得GO注釋的蛋白,于文獻搜索和蛋白質同源物手動注釋。因單一工具分類并不能完全詮釋蛋白質的功能,研究參照Bevan等[14]的標準對這些蛋白質進行分類。用STRING v10進 行protein-protein interaction(PPI)網絡互作分析差異表達蛋白質之間的關系[15],使用Cytoscape 2.8.3對網絡圖進行編輯[16]。
2 結果
2.1 沙漠小球藻雙向蛋白質電泳分析
基于前期的宏觀生理指標和轉錄組組學的研究結果,沙漠小球藻在干旱脅迫后0、6、12、18、24和30 d存在較大的差異,其中第18天沙漠小球藻生長情況和油脂的合成明顯的升高。因此,以20%PEG 6000模擬干旱處理沙漠小球藻,選取0、6、12、18、24和30 d 6個時間點,對干旱脅迫這6個時間點進行全蛋白的提取并使用蛋白樣品進行雙向電泳(圖1),在干旱脅迫后0、6、12、18、24和30 d,分別檢測到(1 098±21)、(1 033±19)、(1 036±32)、(1 026±22)、(1 021±16)、(1 030±25)個蛋白點,同一處理的3塊重復膠之間蛋白點的匹配率高達90%。
采用ImageMaster Platinum 7.0軟件分析干旱脅迫0、6、12、18、24和30 d的小球藻蛋白組學變化,發現有32個具有統計學顯著差異的蛋白點(圖2)。其中豐度上調的有12個(點3、4、5、6、7、18、19、20、21、22、24及29),豐度下調的有12個( 點 2、10、11、12、13、14、15、16、23、25、31及32),豐度先下調后上調的有8個(點1、8、9、17、26、27、28及 30)。采用 ImageMaster Platinum 7.0軟件對差異表達的蛋白進行分析,差異蛋白相對表達量按Vol%提取,并進行統計(圖3)。
2.2 差異表達蛋白的鑒定和功能分類
采用MALDI-TOF-MS對32個表達差異的蛋白進行分析,發現均具有差異顯著性,其中豐度上調的有12個,豐度下調的有12個,豐度先下調后上調的8個,通過MASCOT軟件對蛋白進行鑒定,獲得29個蛋白點(表1)。
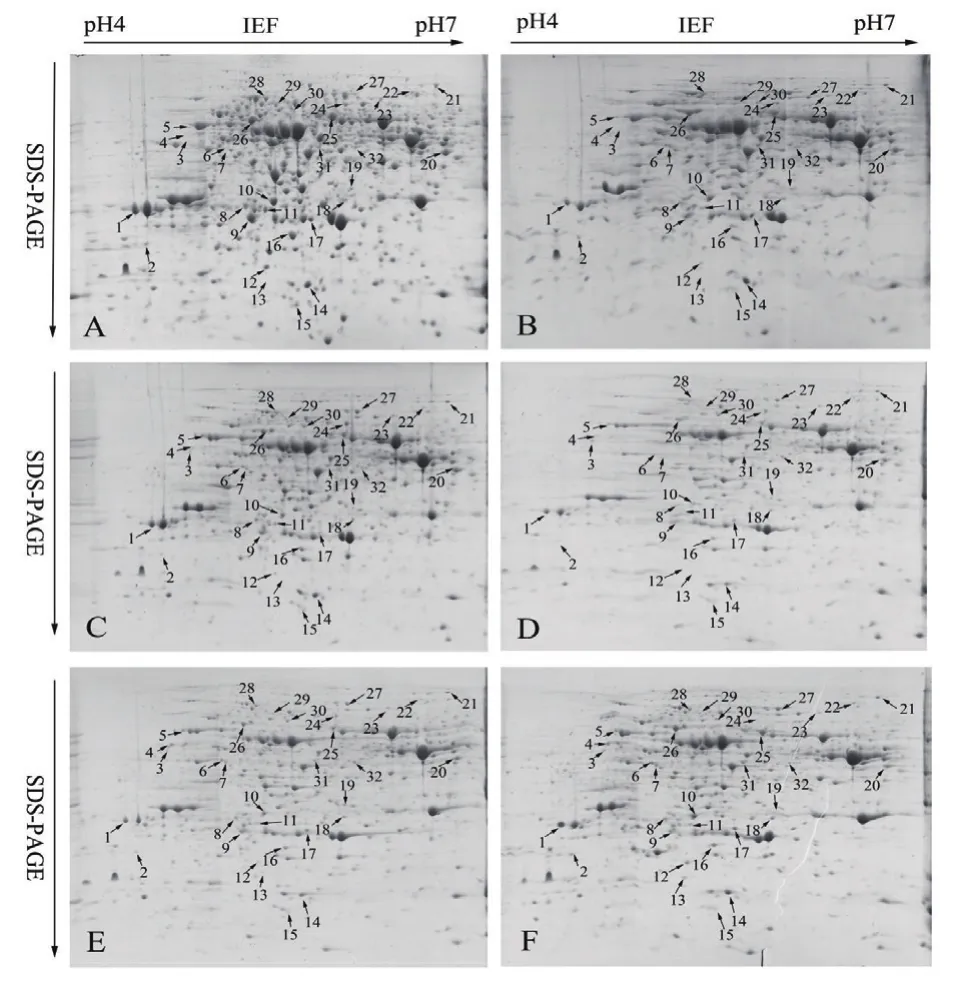
圖1 沙漠小球藻蛋白質雙向電泳圖譜
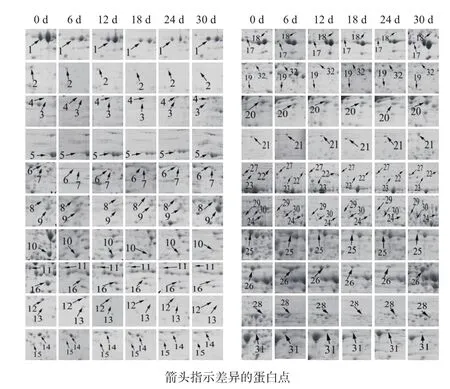
圖2 不同時間的干旱脅迫條件下蛋白質表達的動態變化
質譜分析確定的32個差異表達蛋白點的身份,涉及29個差異蛋白。GO功能分析(圖4)表明,獲得的差異表達蛋白參與的生物過程主要有應激反應(Response to stress,GO:0006950)和小分子代謝過程(small molecule metabolic process,GO:004-4281);細胞組成主要有線粒體(Mitochondrion,GO:0005739)和類囊體(thylakoid,GO:0009579);分子功能主要有離子結合(GO:0043167)和氧化還原酶活性(Oxidoreductase activity,GO:0016491)。
KEGG途徑富集分析(圖5)表明,獲得的差異表達蛋白主要參與光合作用、氧化磷酸化、檸檬酸循環(TCA循環)等途徑。
根據差異表達蛋白序列在Gene ontology中功能分析的結果,按參與生物代謝過程被分為7類:物質代謝相關蛋白(13.79%)、能量生成與轉化相關蛋白(10.34%)、光合作用相關蛋白(10.34%)、抗逆相關蛋白(6.89%)、轉運與細胞結構相關蛋白(6.89%)、抗氧化相關蛋白(3.45%)和其他未知功能蛋白(48.28%)(圖6-A)。
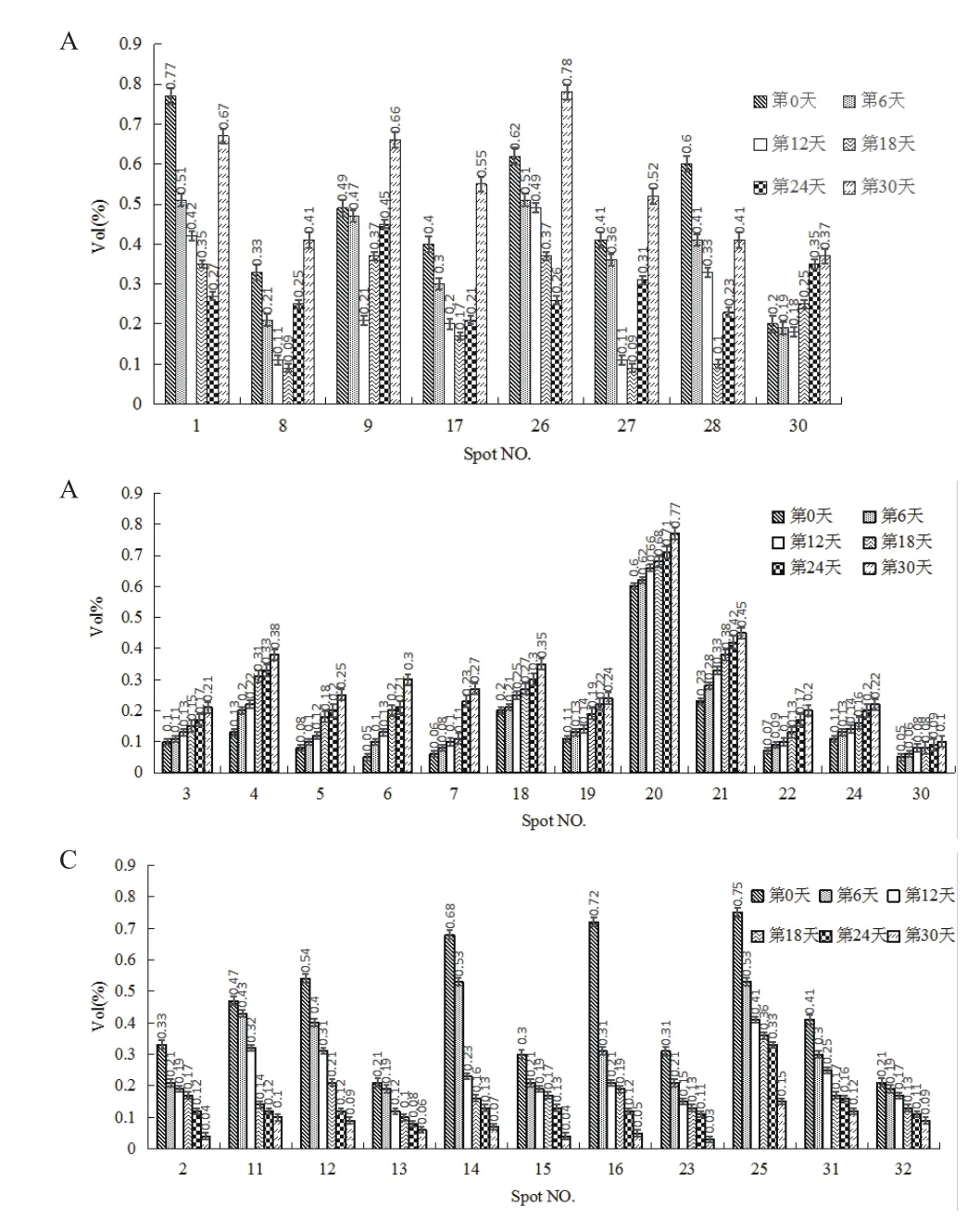
圖3 差異蛋白的相對表達量
2.3 差異表達蛋白質的互作網絡分析
PPI分析結果(圖6-B)顯示,部分表達差異蛋白構成一個結構復雜的多中心互作網絡,該網絡含19個蛋白質節點,有19種互作關系,各差異表達蛋白質間通過多條通路進行調節。在PPI網絡中,相互作用較強的蛋白質主要為光合作用、物質代謝、轉運與細胞結構、能量生成與轉化、物質代謝及抗逆等相關的蛋白。
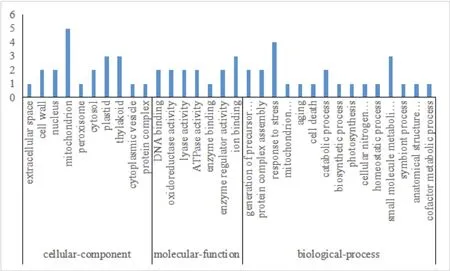
圖4 差異表達蛋白的GO分析
3 討論
本研究采用蛋白質組學方法研究干旱脅迫下沙漠小球藻蛋白表達特點。對獲得的29個差異表達蛋白分析表明,干旱脅迫影響了沙漠小球藻的多個生物學過程,其中光合作用、物質代謝和能量合成受到的影響最大,此外抗逆、抗氧化和轉運過程也受到影響。
3.1 光合作用相關蛋白
葉綠體是光合作用的重要場所,捕光葉綠素a/b結合蛋白(點1)是高等植物和藻類中類囊體膜上接收太陽能最終同化CO2的一類蛋白,其通常與葉綠素和葉黃素形成捕光色素蛋白復合體[17]。綠色植物中大部分的葉綠素分子都被光系統I(PSI)和光系統II(PSII)上的天然捕光色素復合體結合,其中光系統II捕光色素復合體的含量最為豐富。有研究表明,捕光葉綠素a/b結合蛋白不僅可以行使光能傳遞、轉化和分配的功能,其在適應環境脅迫中也起到了重要的作用[18-19],并且其表達受ABA信號調控[20]。Fan等[21]通過雙向電泳技術研究了耐鹽植物海蓬子在高鹽條件下的蛋白組學差異,結果發現位于PSI和PSII上的捕光葉綠素a/b結合蛋白的表達量均明顯上調。NADPH:醌還原酶(點11)能夠還原多種電子受體,具有NADPH的底物特異性。本研究中發現干旱脅迫下一個捕光葉綠素a/b結合蛋白的表達上調,說明脅迫條件一定程度上提高了光合系統的光合能力,促進機體的物質代謝,從而來抵抗干旱脅迫。干旱、高鹽等脅迫會導致植物機體受到損傷,高等植物和藻類能通過多種途徑減少這種損傷。光捕獲復合物的調節就是一種有效的光保護途徑。NADPH:醌還原酶(點11)能夠還原多種電子受體,具有NADPH的底物特異性。核酮糖-1,5-二磷酸羧化/加氧酶(點31)不僅能在光合作用中固定CO2,還能催化二磷酸核酮糖加氧反應[22]。Agrawal等[23]發現水稻幼苗在臭氧脅迫下,核酮糖-1,5-二磷酸羧化/加氧酶表達受到抑制。本研究中發現干旱脅迫下該蛋白的表達量下調,其抗旱機制還有待于進一步研究。
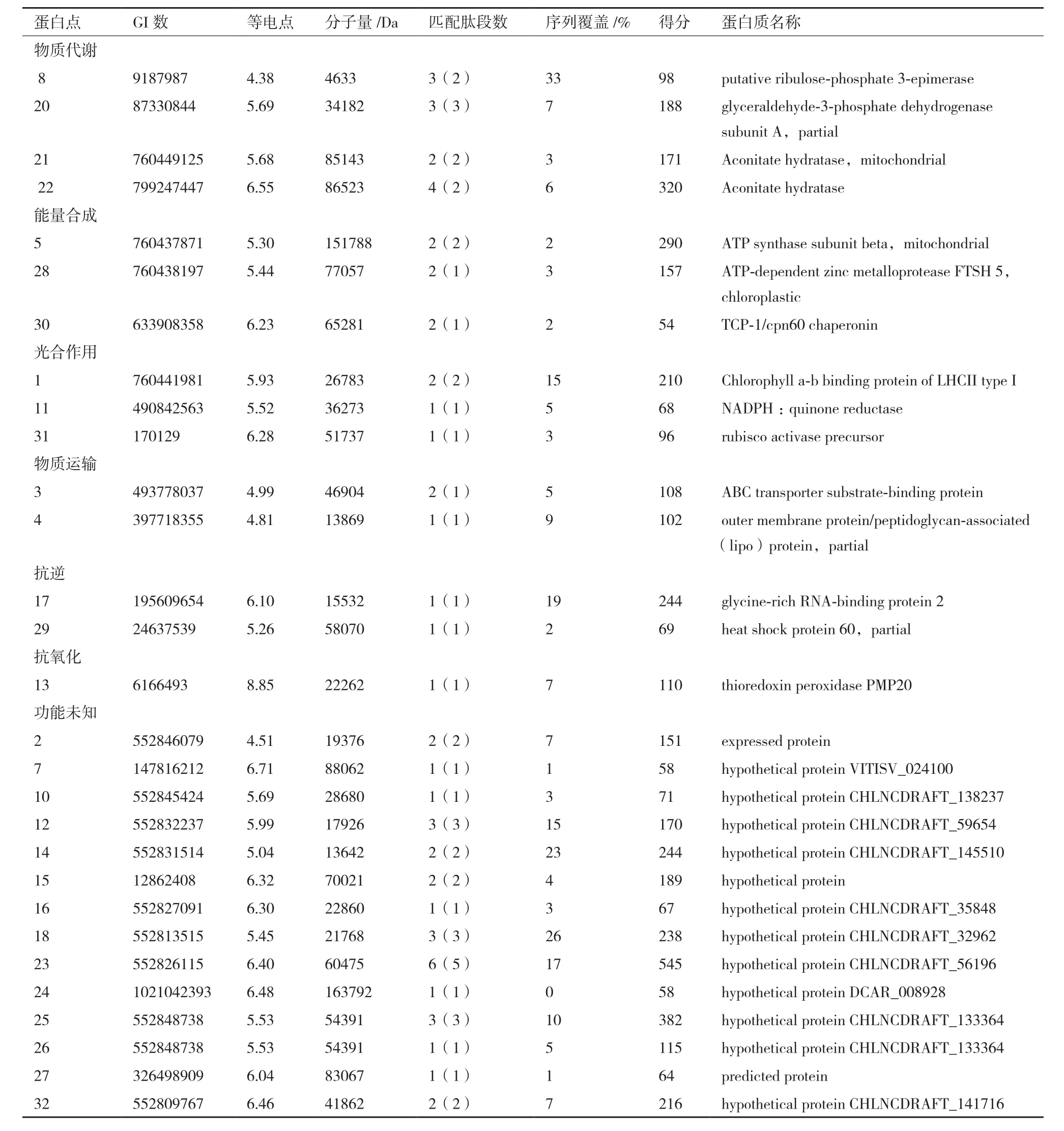
表1 沙漠小球藻響應干旱脅迫差異表達蛋白點的MALDI-TOF-TOF質譜鑒定結果
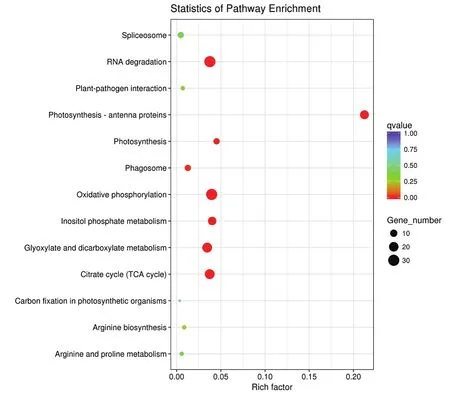
圖5 差異表達蛋白的KEGG分析
3.2 物質代謝和抗逆相關蛋白
核酮糖磷酸異構酶(點8)是參與碳水化合物代謝和其他有機復合物生成的一類重要酶。甘油醛-3-磷酸脫氫酶(GAPDH,點20)不僅催化二羥丙酮磷酸(DHAP)轉化為3-磷酸甘油酸,也催化3-磷酸甘油醛(GAP)轉化為1,3-二磷酸甘油酸;是生物體內糖酵解和糖異生過程中的關鍵酶[24],也是維持生命基本活動的酶之一。同時,GAPDH還具有抵抗外界逆境脅迫的功能,Khanna等[25]研究干旱脅迫下鷹嘴豆GAPDH等基因的表達,結果表明干旱脅迫下GAPDH表達的轉錄水平明顯提高;Ahsan等[26]運用雙向電泳技術研究了砷脅迫下水稻葉片的蛋白組學變化,發現砷脅迫下GAPDH的表達量上調2倍以上。本研究中發現此蛋白表達量上調,說明GAPDH可使植物體內新陳代謝加快,從而提供更多的能量抵御外界脅迫環境。烏頭酸水合酶(點21、22)參與三羧酸循環,可催化檸檬酸和異檸檬酸之間的相互轉化。
脅迫環境下,富含甘氨酸RNA結合蛋白2(GRP2,點17)是一種植物首先參與信號轉導的響應蛋白。研究發現GRPs的表達可受干旱、高鹽、植物激素等因素的誘導[27-28]。本研究中GRP2在干旱脅迫下先下調后上調表達,說明干旱脅迫誘導該蛋白的表達。熱休克蛋白60(HSP60,點29)屬于熱休克蛋白家族,其作為分子伴侶廣泛分布于線粒體中,主要參與蛋白質折疊、移位和降解等過程,對抑制細胞凋亡也有重要作用。該蛋白在細胞處于應激條件時(如熱休克、高鹽及干旱等)表達量明顯提高[29-31]。Sato等[32]在研究水稻抗寒性時發現該蛋白的上調表達。本研究中干旱脅迫下該蛋白的表達量上調,可能是因為其與變性蛋白質結合形成聚合體從而而減少對小球藻的傷害。
干旱脅迫條件下,核酮糖磷酸異構酶這類基礎代謝有關酶的表達量先下調后上調,甘油醛-3-磷酸脫氫酶、烏頭酸水合酶的表達量上調。說明脅迫條件下小球藻的新陳代謝速度加快,將儲備的能量及時轉化為各種細胞活動所需的動力,從而使機體正常生長以抵御外界脅迫。
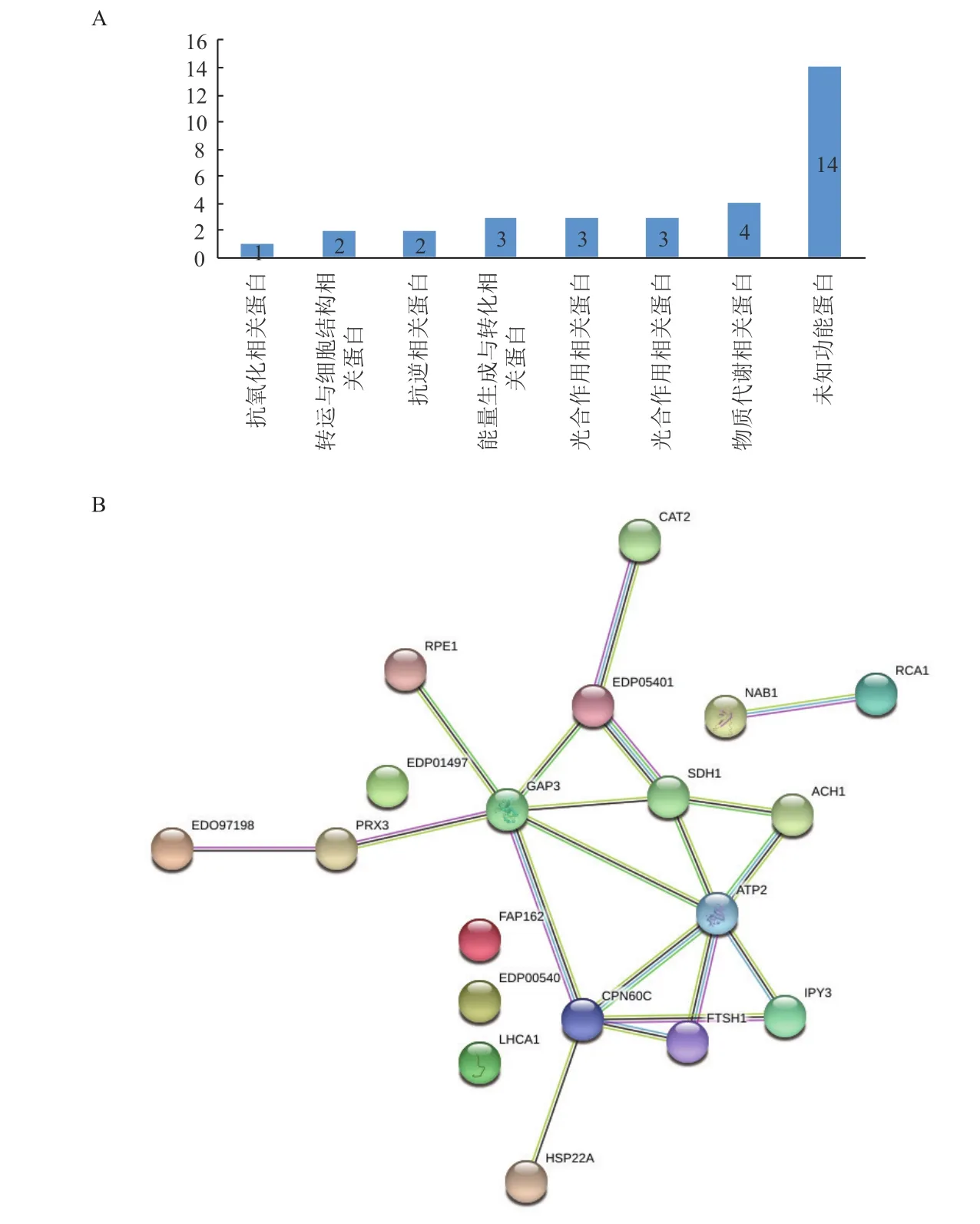
圖6 沙漠小球藻差異蛋白的功能分類(A)與蛋白質互作網絡圖(B)
3.3 能量生成與轉化相關蛋白
ATP合成酶廣泛分布于線粒體內膜、葉綠體類囊體和細胞核中,參與氧化磷酸化和光合磷酸化反應,在跨膜質子動力勢的推動下催化合成ATP,是生物體能量代謝的關鍵酶,又稱三磷酸腺苷合成酶[33]。本研究鑒定的蛋白點5為ATP合成酶相關蛋白,其表達量在干旱脅迫下上調,為各類代謝活動提供能量。ATP依賴的鋅金屬蛋白酶FTSH5(點28)具有ATP酶活性、蛋白水解活性和分子伴侶活性,還與熱激、高鹽、病害等脅迫響應有關[34]。Zhang等[35]從磷酸化蛋白組水平探究了干旱脅迫對兩種小麥的影響,結果表明干旱脅迫下兩種小麥的ATP依賴的鋅金屬蛋白酶FTSH 5表達均下調。Das等[36]在研究大豆葉片對干旱脅迫及熱激的響應時發現該蛋白在2種脅迫下的表達均下調。本研究中也發現此蛋白表達量先下調后上調,但對于其在沙漠小球藻中油脂積累機制中的作用有待進一步的探究和驗證。分子伴侶TCP-1/cpn60(點30)主要在ATP水解時幫助蛋白質的折疊和組裝,本研究中干旱脅迫能誘導分子伴侶TCP-1/cpn60表達量先下調后上調可能是因為其參與了小球藻干旱脅迫相關蛋白的折疊與組裝,并與小球藻干旱脅迫相關蛋白的合成密切相關。
3.4 轉運與細胞結構、抗氧化相關蛋白
ABC轉運蛋白底物結合蛋白(點3)通過水解ATP產生的能量對溶質中各種生物分子(如氨基酸、蛋白質、糖等)進行跨膜運輸[37]。干旱脅迫條件下,該蛋白的表達上調,組織中的糖類、蛋白質的運輸可能受到抑制,其抗旱機制還有待于進一步的研究。外膜蛋白/肽聚糖結合(脂)蛋白(點4)具有為外膜提供通透性,維持外膜結構穩定的作用。小球藻可能通過調節細胞內外滲透壓,從而抵御干旱脅迫。
硫氧還蛋白過氧化物酶PMP20(點13)在進化中高度保守,從低等原核生物到高等生物人類中均有表達。該蛋白具有過氧化物酶和分子伴侶的雙重性能,不僅可以參與細胞內抗氧化物代謝,還可以調節細胞內信號轉導[38]。研究發現,其在不同物種中都可以發揮抗逆特性來維持體內氧化還原平衡。本研究中干旱脅迫條件下其表達量下調,其作用機制還有待于進一步研究。
除以上具有已知信息的蛋白外,2-DE中檢測的差異蛋白中有53.13%的未知功能蛋白,主要因為小球藻不屬于模式植物,其蛋白數據庫還不完善。而其中必定蘊藏著和抗旱脅迫相關的蛋白和基因,這將是以后具有研究價值的方向。
3.5 蛋白質互作網絡呈現的整體調控機制
在PPI調控網絡中,具有19個蛋白節點。干旱脅迫下差異表達的蛋白中,光合作用有關蛋白、能量生成與轉化相關蛋白和抗逆相關的蛋白普遍上調。說明干旱脅迫影響了葉綠體、線粒體,其干旱的核心是葉綠體結構和光合作用的維持。此外,其他的細胞器和細胞質的蛋白也發生了變化,這些蛋白的變化說明沙漠小球藻可以通過細胞中各細胞器的協同變化以應對干旱脅迫。
3.6 干旱脅迫下沙漠小球藻蛋白質組和轉錄組的結果比較
本課題組此前已對干旱和鹽脅迫下沙漠小球藻開展了轉錄組學的研究,兩者都顯示脅迫18天比第0天脅迫得到的差異表達基因/蛋白數量更多,基因/蛋白在功能分類上差異較大。蛋白質組學發現,大量的蛋白質定位在葉綠體中,轉錄研究也發現了光合作用相關基因。在GO分析中,細胞組分的結果也發現基因在葉綠體中明顯富集。蛋白質組學研究結果顯示物質代謝相關蛋白、能量生成與轉化相關蛋白和光合作用相關蛋白數目最多,轉錄組結果中次生代謝物的生物合成、生物過程調節、代謝過程和油脂的合成富集最多。兩種方法在研究結果上的差異反映研究水平不同,合二者獲得的數據,從不同水平、不同角度為沙漠小球藻抗逆機制的研究提供依據。
4 結論
干旱脅迫影響沙漠小球藻部分蛋白的表達,共獲得29個差異表達蛋白,主要涉及光合作用、物質代謝和抗逆、能量生成與轉化等相關蛋白。沙漠小球藻能夠通過改變不同功能蛋白的表達來維持光合作和脂質代謝的過程,以適應干旱脅迫。

