硬膜外自控鎮痛對原發性肝癌肝部分切除術患者院內感染及炎癥因子的影響
羅宇 李軍
目前,手術切除仍為原發性肝癌患者首選、最有效的治療方法。但肝癌手術尤其是開腹手術,切口損傷較大,術后疼痛劇烈,容易出現機體免疫功能障礙和急性應激反應,導致術后呼吸道感染、肺不張等并發癥,嚴重影響患者的術后恢復及后續生活質量,也加重了患者術后死亡的風險[1],這也可能與患者術后因局部疼痛限制,影響翻身、咳痰等動作,加重呼吸道負擔有關。研究顯示,采用合理的麻醉與鎮痛方式可有效降低患者術后呼吸道感染等并發癥的發生率[2]。因此,尋找適宜原發性肝癌部分肝切除手術患者的鎮痛治療方式,有助于降低院內感染的發生率。本研究探討硬膜外自控鎮痛對原發性肝癌肝部分切除術患者術后院內感染及圍術期炎癥指標的影響,以期為臨床提供研究基礎。
1 對象
1.1 對象 選取2015年9月至2017年9月我院肝膽外科擇期行原發性肝癌部分肝切除患者86例。納入標準:(1)年齡 20~85 歲;(2)病理診斷明確,符合手術指征,均采用腹腔鏡下肝部分切除術;(3)ASA分級為Ⅱ~Ⅲ級,Child-Pugh評分<5分;(4)腫瘤最大直徑5~8cm。排除標準:(1)對研究用麻醉藥物、鎮痛藥物過敏;(2)嚴重心肺功能不全;(3)精神疾病患者;(4)長期服用鎮痛、鎮靜藥物或酗酒、吸毒者;(5)長期吸煙者;(6)慢性支氣管炎者。按隨機數字表法分為靜脈鎮痛組(I組)與硬膜外鎮痛組(E組),每組43例。兩組患者年齡、性別、手術情況等一般資料的比較差異均無統計學意義(均P>0.05),見表1。本研究經醫院倫理委員會批準,患者或授權家屬簽署知情同意書。

表1 兩組患者一般資料的比較
1.2 方法 手術均由具有相關資質的高年資副主任醫師及以上職稱進行。患者在進入手術室后予持續心電監測,并建立輸液相關通路。E組行硬膜外穿刺(T8~9或T9~10),確定穿刺針在硬膜外間隙后向頭側置管3~4cm,給予2%利多卡因3ml作為實驗劑量,確定導管在位后妥善固定,手術消毒時予0.375%羅哌卡因10ml,以后每隔1.5h硬膜外追加0.375%羅哌卡因5ml。兩組均以丙泊酚1.5~2.5mg/kg、羅庫溴銨0.6mg/kg、舒芬太尼0.6μg/kg誘導后氣管插管。氣管插管后接麻醉機行機械通氣,潮氣量初定8ml/kg,頻率12/min,維持呼氣末二氧化碳分壓(PETCO2)30~35mmHg水平,根據PETCO2適當調整呼吸參數。術中靜脈輸注丙泊酚2~4mg/(kg·h)及瑞芬太尼2~10μg/(kg·h),復合吸入1%~2%七氟醚,并根據術時長短,間斷靜脈輸注羅庫溴銨0.2mg/kg維持肌松。術后E組行硬膜外自控鎮痛(PCEA),配方為:0.125%羅哌卡因+0.5μg/ml舒芬太尼,總量100ml,硬膜外鎮痛負荷劑量5ml,背景輸注速率2ml/h,自控鎮痛(PCA)劑量0.5ml,鎖定時間15min。I組行靜脈自控鎮痛(PCIA),配方:舒芬太尼 1μg/ml,總量 100ml,背景輸注速率 2ml/h,PCA劑量 0.5ml,鎖定時間15min。
1.3 觀察指標 比較兩組患者術后視覺模擬評分(visual analogue score,VAS)、術后 48hPCA 次數、下呼吸道感染情況及炎癥因子水平。
1.3.1 患者術后VAS評分及PCA次數 于患者清醒時進行評價,分別記錄患者術后 6h(T1)、24(T2)、48h(T3)的VAS評分及48hPCA次數。評分標準:傷口處無疼痛感覺為0分;傷口處有輕微疼痛為1~2分;傷口處疼痛稍明顯,同時疼痛次數較多為3~4分;傷口處疼痛明顯,但是在能忍受的范圍內,為5~7分;傷口處疼痛劇烈不能耐受為8~10分。
1.3.2 下呼吸道感染評價標準[3]參照《醫院獲得性肺炎診斷和治療指南(草案)》中的相關標準進行判斷:(1)術后24h臨床出現發熱、咳嗽及肺部啰音等癥狀體征;(2)胸部X線檢查顯示肺部浸潤性陰影;(3)氣道吸出物、痰培養或血培養檢測病原菌陽性。
1.3.3 炎癥因子指標 于麻醉前及術后24h采取患者頸內靜脈血樣15ml,應用ELISA法檢測患者血清TNF-α、IL-6、高敏 C-反應蛋白(hs-CRP)、降鈣素原(PCT)水平。
1.4 統計學處理 采用SPSS 18.0統計軟件,正態分布的計量資料用表示,兩組間及組內不同時點的比較采用t檢驗,計數資料組間比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者VAS評分及術后48hPCA次數的比較E組患者T1、T2和T3的VAS評分及術后48hPCA次數和I組比較,差異均無統計學意義(均P>0.05),E組和I組鎮痛效果相同,見表2。
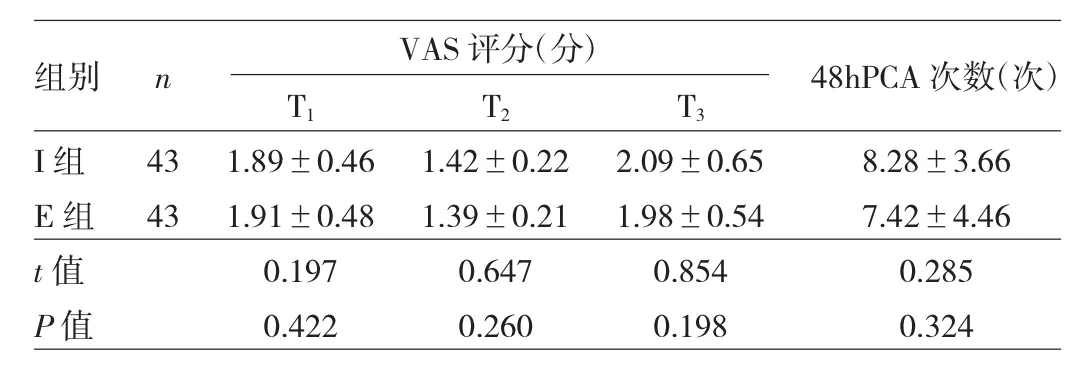
表2 兩組患者術后VAS評分及48hPCA次數的比較
2.2 兩組患者術后下呼吸道感染發生率的比較 E組術后下呼吸道感染發生率為 9.30%(4/43),I組為27.91%(12/43),差異有統計學意義(χ2=4.914,P=0.027),E組下呼吸感染發生率明顯低于I組。E組4例術后感染患者胸部X線均顯示肺部浸潤性陰影且呼吸道送檢標本檢測病原菌陽性,其中3例出現發熱癥狀。I組12例術后感染患者胸部X線均顯示肺部浸潤性陰影且呼吸道送檢標本檢測病原菌陽性,其中9例出現發熱癥狀,見表3。
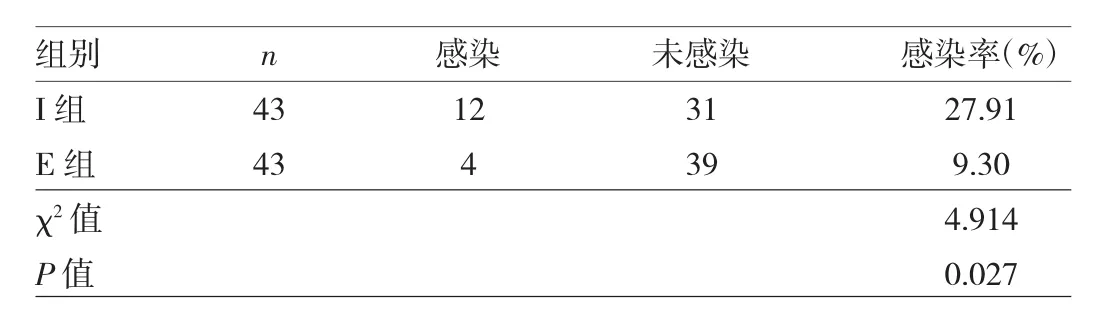
表3 兩組患者術后下呼吸道感染發生率的比較(例)
2.3 兩組患者炎癥因子的比較 麻醉前,兩組患者血清炎癥因子水平比較均無統計學差異(均P>0.05)。經過不同的鎮痛方式,E組患者手術后24h的TNF-α、hs-CRP、IL-6、PCT水平和I組比較,E組患者術后上述炎癥因子水平均低于I組,差異均有統計學意義(均P<0.05),見表 4。
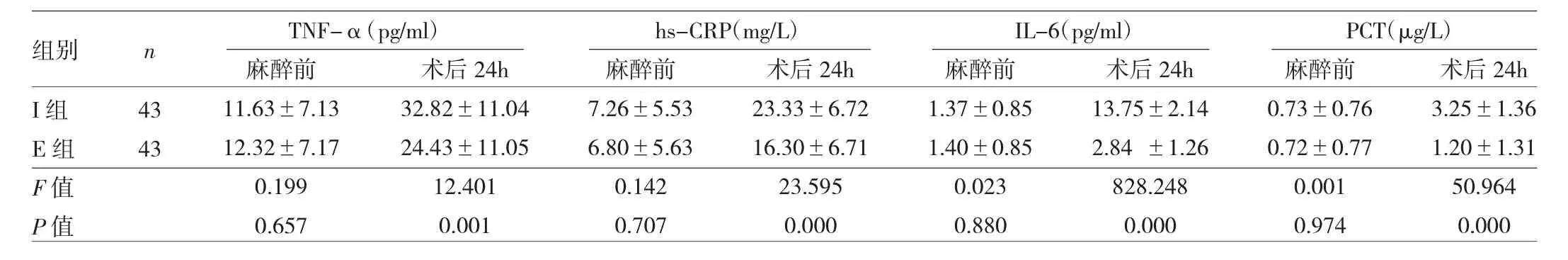
表4 兩組患者術后炎癥因子水平的比較
3 討論
疼痛可增加手術應激反應以及自主神經反射,加重腸麻痹、惡心等,導致器官功能障礙,延長患者術后康復時間。因此,盡可能的幫助患者緩解疼痛,避免由手術、疼痛限制等引起的術后感染,是原發性癌癥患者術后治療的重要環節[4]。雖然大劑量的阿片類藥物能夠阻斷手術應激引起的特異性激素(如兒茶酚胺、皮質醇等)的釋放,但硬膜外鎮痛能更有效地減少傷害性刺激誘發的應激反應,減少炎性介質以及特異性激素的釋放,改善患者預后[5]。研究表明,PCEA實施過程中多選用局麻藥和阿片類類藥物,通過藥物作用,阻滯脊神經后根纖維的神經傳導,阻斷疼痛刺激的上傳通路,改善傷口局部的微循環及新陳代謝,被認為是上腹部手術術后鎮痛的金標準[6]。
研究發現,不同的鎮痛和麻醉方式,對患者術后感染等并發癥的影響程度不同[7]。如全身麻醉將抑制患者自主的呼吸肌功能,通過氣管插管等外源器械輔助通氣,必將損傷局部黏膜組織,同時有可能帶入外界感染源,誘發術后感染;此外,由于麻醉鎮痛藥物抑制患者呼吸系統的纖毛運動,影響其自身清除異物的功能,可能導致異物滯留引發感染。原發性肝癌患者由于自身免疫和抵抗力較弱上述情況更為常見。同時,手術本身的創傷性以及患者麻醉狀態時的易感因素,也加重了患者呼吸道感染的風險[8]。所以,選取適宜的手術鎮痛方式,降低原發性癌癥手術患者術后感染率,是臨床麻醉醫師術后工作的重中之重。
本研究顯示,通過對兩組患者實施不同的麻醉及鎮痛方法,兩組患者術后6、24、48h的VAS評分及術后48hPCA次數并無統計學差異,說明上述兩種方式均具有較好的鎮痛效果。hs-CRP和PCT是臨床上最常用的鑒別感染與否的生物標志物[9],本研究表明,原發性肝癌肝臟部分切除患者術后24hE組 hs-CRP、PCT、IL-6、TNF-α等水平均較靜脈自控鎮痛組更低。因此,筆者推斷PCEA可能阻滯了手術創傷刺激的脊髓傳導通路,減弱了交感神經-腎上腺髓質和下丘腦-垂體-腎上腺皮質應激軸,從而減少炎性細胞因子的產生。而PCIA可能不能影響創傷應激的脊髓傳導通路,從而不能有效抑制對炎性細胞因子的表達調控。而且E組患者術后下呼吸道感染發生率明顯低于I組,差異有統計學意義,說明硬膜外自控鎮痛治療用于原發性肝癌部分肝切除術患者,可有效緩解患者術后應激狀態,減少炎癥因子的釋放[10],降低術后感染的發生。這可能是由于PCEA可以有效鎮痛,解除了術后因切口疼痛而對有效咳嗽、排痰的限制;同時通過減少阿片類藥物的用量以及抑制手術應激引起的神經內分泌反應,大大降低患者術后肺炎和呼吸抑制的發生率。
綜上所述,PCEA可以緩解原發性肝癌部分肝切除術后疼痛癥狀,降低患者炎癥因子水平,減輕呼吸道感染的發生風險,可在臨床中進一步探索應用。

