家蠶BmCaspase-8-Like(BmCasp8L)的免疫負調控功能
胡杰,王鑫怡,王菲
?
家蠶BmCaspase-8-Like(BmCasp8L)的免疫負調控功能
胡杰,王鑫怡,王菲
(西南大學家蠶基因組生物學國家重點實驗室,重慶 400716)
【目的】在個體和細胞水平上探討家蠶()BmCaspase-8-Like(BmCasp8L)的免疫負調控功能,為研究昆蟲免疫負調控機制提供參考。【方法】通過RT-PCR技術克隆并進行結構域預測和進化分析;利用熒光定量PCR檢測在家蠶各齡期、5齡第3天及預蛹期各組織中的時空表達特征和家蠶感染細菌后的免疫誘導表達特征;合成用于RNAi的dsRNA,通過注射dsRNA在個體中降低的表達水平,并檢測對抗菌肽基因表達水平的影響;構建的細胞表達載體,通過質粒或dsRNA的轉染在BmE細胞中過表達或降低的表達水平,并利用Western blot或定量PCR予以確認,同時檢測抗菌肽基因表達水平的變化及轉錄因子BmRelish的切割。【結果】BmCasp8L與鱗翅目Caspase-6、哺乳動物Caspase-8同源,其序列與BmDredd、DmDredd N端分別具有61%、42%的相似性,但缺少C端的Caspase結構域。時空表達特征分析表明,在眠蠶期表達量高于起蠶期,在預蛹期、蛹第7天、蛾第1天表達量明顯升高;在5齡第3天幼蟲體內,在血細胞中的表達量明顯高于其他組織,而在預蛹期,主要在絲腺中表達。免疫誘導表達譜顯示,5齡第3天家蠶在注射感染黑胸敗血芽孢桿菌或粘質沙雷氏菌1 h內,的表達水平上升,此后逐漸恢復正常。對5齡第2天家蠶注射dsCasp8L或dsEGFP,24 h后通過熒光定量PCR檢測到的表達量在注射dsCasp8L的家蠶中顯著下調,而抗菌肽的表達水平顯著上調。在BmE細胞中過表達,抗菌肽的表達水平與對照相比顯著降低,且轉錄因子BmRelish的切割受到抑制。在細胞中轉染dsRNA后,的表達水平被有效降低,抗菌肽的表達水平顯著上調。【結論】進化分析、表達特征以及細胞和個體上的功能研究表明BmCasp8L是一個具有免疫負調控作用的分子,通過抑制BmRelish的切割,抑制抗菌肽的表達,從而負調控Imd信號通路,降低的表達水平則導致抗菌肽表達水平升高,有助于家蠶抵御微生物病原的侵染。
家蠶;免疫負調控;BmCaspase-8-Like(BmCasp8L);表達特征;抗菌肽;BmRelish
0 引言
【研究意義】昆蟲靠進化上保守的先天免疫系統(tǒng)抵御病原微生物的侵染,其免疫方式主要包括抗菌肽表達、吞噬作用、包埋作用和黑化作用,其中抗菌肽的表達主要依賴于兩條NF-κB信號通路——Toll和Imd信號通路[1-2]。但NF-κB信號通路的過度激活,往往導致昆蟲腸道菌群紊亂、壽命縮短、神經退行性疾病等現(xiàn)象[3-8],因此,免疫負調控分子和負調控機制逐漸被認可為免疫系統(tǒng)的一個重要組成部分。家蠶()作為鱗翅目模式昆蟲,對其免疫負調控機制的研究,有助于設計合理的抗病品系,同時有助于深入研究家蠶及其他昆蟲先天免疫系統(tǒng)。【前人研究進展】昆蟲Imd信號通路主要由革蘭氏陰性細菌所激活,革蘭氏陰性細菌的胞壁組分DAP型肽聚糖(DAP-PGN)被細胞膜受體蛋白PGRP-LC或胞內受體PGRP-LE所識別,進而招募Imd分子,免疫信號經Imd、FADD、Dredd分子傳遞,最終激活轉錄因子Relish[9]。在信號傳遞過程中,被認為是哺乳動物Caspase-8同源分子的Dredd,既切割Imd又切割Relish:切割后的Imd被E3泛素化連接酶DIAP2催化形成K63-多聚泛素化鏈從而招募TAK1和IKK使Relish磷酸化;而Relish經Dredd切除其C端的錨蛋白重復序列(ankyrin repeat)后,具有轉錄活性的N端即進入細胞核啟動抗菌肽分子的表達[10-11]。通過突變分析和全基因組RNAi等方法,已鑒定了多種參與Imd信號通路負調控的分子[12-14]。例如PGRP-LB、PGRP-SC1、PGRP-SC2等分泌型PGRPs能通過降解肽聚糖來抑制Imd信號通路的激活[15-18];Pirk通過干擾PGRP-LC、PGRP-LE和Imd的結合從而阻止信號的傳遞[19-21];IκB蛋白Pickle與Relish相互作用并招募HDAC1蛋白抑制Relish靶基因的啟動子活性[22];E3泛素連接酶Dnr1則通過促進Dredd蛋白酶體降解來抑制Imd信號通路[23]。筆者研究團隊在研究參與家蠶抗病毒免疫的BmSTING分子時,通過免疫共沉淀和質譜鑒定了一個與BmSTING具有相互作用的蛋白,其氨基酸序列與BmDredd的N端序列相似性高,而缺少其C端酶活結構域[24]。基于其序列特征,將其命名為BmCaspase-8-Like(BmCasp8L)。過表達該分子降低了由BmSTING介導的抗病毒免疫應答水平。該分子是否參與Imd信號通路的調控尚未可知。【本研究切入點】目前,對于Imd信號通路免疫負調控機制的認識主要建立在對果蠅的研究上,而缺乏對其他昆蟲免疫負調控分子的鑒定和研究。本研究針對家蠶BmCasp8L,通過研究該分子對轉錄因子BmRelish的活化及抗菌肽基因表達的影響,解析其負調控機制。【擬解決的關鍵問題】分析BmCasp8L的序列特征并構建系統(tǒng)進化樹,研究的時空表達及細菌免疫誘導表達特征,在此基礎上進一步研究其對BmRelish的活化及抗菌肽基因表達的抑制作用。
1 材料與方法
試驗于2016年9月至2018年3月在西南大學家蠶基因組生物學國家重點實驗室完成。
1.1 供試材料與試劑
供試家蠶品種為大造,由西南大學家蠶基因庫提供。試驗所用家蠶胚胎細胞系BmE,以及感染家蠶所需黑胸敗血芽孢桿菌()和粘質沙雷氏菌(),均由筆者實驗室保存。
RNase抑制劑、反轉錄試劑盒、T7體外轉錄試劑盒均購自Promega公司;Total RNA Kit購自OMEGA公司;Tubulin抗體(AT819)、HRP標記山羊抗小鼠抗體(A0216)、Myc抗體(AM933)、RIPA細胞裂解液、BCA蛋白濃度測定試劑盒均購自碧云天公司;彩色預染蛋白質分子量標準、Super Signal West Femto化學發(fā)光檢測試劑均購自Thermo Scientific;DAP型肽聚糖(Peptidoglycan,DAP-PGN)、Flag抗體(F1804-200UG)均購自Sigma公司;細胞轉染試劑購自Roche公司;Grace昆蟲細胞培養(yǎng)基和胎牛血清均購自Gibco公司;熒光定量PCR相關試劑、pMD-19T載體均購自TaKaRa公司;Myc-BmRelish真核表達載體的構建參考文獻[25]。
1.2 BmCasp8L序列分析及系統(tǒng)發(fā)育樹構建
從家蠶基因組數據庫SilkDB(http://silkworm. genomics.org.cn/)中下載BmCasp8L序列BGIBMGA008021(GenBank登錄號:XP-012552745.1),通過ClustalX軟件進行多個物種同源序列比對,采用MEGA 4.0軟件構建系統(tǒng)發(fā)生樹。
1.3 樣品RNA的提取及熒光定量PCR
取各齡期家蠶個體、5齡第3天幼蟲及預蛹期個體的各組織,液氮研磨后,用Trizol法提取總RNA,或采用Total RNA Kit提取細胞樣品的總RNA,按照反轉錄試劑盒說明書反轉錄為cDNA。
熒光定量PCR采用相對定量法,根據目標基因序 列設計特異定量引物,以sw22934作為參比基因,引物序列見表1。擴增程序為95℃ 3 s,60℃ 30 s,共40個循環(huán),在退火/延伸階段進行熒光信號數據采集,最后對熔解曲線進行分析。
1.4 BmCasp8L dsRNA的合成
根據的mRNA序列,用Primer 5.0軟件設計引物BmCasp8L-FL(表1),經PCR擴增得到N端帶有FLAG標簽的BmCasp8L全長cDNA,連接到pMD19-T載體,經測序驗證的陽性克隆用H I和I酶切后,插入pSL1180-A4載體中,用于真核細胞表達。
按照T7體外轉錄試劑盒的操作說明,用Primer 5.0軟件設計用于干涉和(對照)的特異引物dsCasp8L和dsEGFP(表1),并合成相應的dsRNA,用于細胞和個體水平的基因干涉。

表1 引物序列
1.5 細胞轉染
在27℃條件下,用含10%胎牛血清的Grace昆蟲細胞培養(yǎng)基培養(yǎng)BmE細胞,血球計數板計數后接種至12孔板中(1×105個細胞/孔),24 h后按照轉染試劑操作說明每孔轉染1 μg DNA或5 μg dsRNA。轉染48 h后加DAP-PGN刺激細胞12 h(10 μg·mL-1),收集細胞用于RNA提取或Western blot檢測。
1.6 Western blot檢測
用RIPA細胞裂解液裂解細胞后提取總蛋白,然后用BCA蛋白濃度測定試劑盒按照操作說明測定蛋白濃度,等量上樣進行12% SDS-PAGE電泳,采用轉膜儀將蛋白轉移到PVDF膜上,5%脫脂奶粉封閉1 h后,用FLAG抗體、Myc抗體、Tubulin抗體室溫孵育1 h,TBST清洗5次后用二抗室溫孵育1 h,再用TBST清洗5次,最后用Super Signal West Femto化學發(fā)光檢測試劑進行顯色反應。
1.7 細菌感染試驗
將黑胸敗血芽孢桿菌和粘質沙雷氏菌于37℃過夜培養(yǎng)并計數后4℃保存?zhèn)溆谩_x取5齡第2天家蠶幼蟲60頭,分別用毛細管在腹部倒數第2對氣孔處注射dsEGFP、dsCasp8L(2 μg·μL-1,10 μL/頭),各注射30頭。注射24 h后各取3頭經液氮速凍后保存于-80℃用于RNA提取和干涉效率的定量PCR檢測,其余幼蟲注射粘質沙雷氏菌(1×102個/μL,10 μL/頭),并在注射后0、1、3、6、12和18 h各取3頭家蠶,經液氮速凍后保存于-80℃用于RNA提取。另取5齡第3天家蠶幼蟲60頭,以同樣的方法直接注射黑胸敗血芽孢桿菌或粘氏沙雷氏菌,各注射30頭,并在注射后0、0.5、1、3、6和12 h各取3頭家蠶,經液氮速凍后保存于-80℃用于RNA提取。
1.8 數據統(tǒng)計與分析
熒光定量PCR依據各樣品中目標基因和內參基因的臨界循環(huán)數(Ct)值,利用2-??Ct計算分析。數據表示為平均值±標準偏差(SD),采用Student’s檢驗進行顯著性差異分析或ANOVA單因素方差分析。<0.05表示差異顯著,<0.01表示差異極顯著。
2 結果
2.1 BmCasp8L序列分析及系統(tǒng)發(fā)生樹的構建
BmCasp8L CDS全長858 bp,編碼285個氨基酸,位于家蠶第9號染色體nscaf2889上,預測蛋白分子量大小為30 kD。其序列與BmDredd和DmDredd N端分別具有61%、42%的相似性,對該基因進行結構域預測,發(fā)現(xiàn)其缺少Dredd分子C端Caspase結構域(圖1-A)。進化分析表明BmCasp8L、BmDredd與鱗翅目昆蟲Caspase-6均為哺乳動物Caspase-8的同源分子(圖1-B)。除家蠶外,在野蠶基因組中也發(fā)現(xiàn)了缺少編碼Caspase結構域的。但在其他鱗翅目昆蟲中,可能由于其基因組數據不完善,尚未鑒定到類似的。果蠅DmDredd具有多種剪接形式,其中Dredd-PF亞型缺乏Caspase酶活結構域。人Caspase-8也有多種剪接異構體,其中Caspase-8L亞型缺少C端酶活結構域。
2.2 BmCasp8L的時空表達及免疫誘導表達
采用熒光定量PCR對5齡第3天各組織內的表達水平進行檢測,結果顯示在各組織均有表達,在血細胞中表達量明顯高于其他組織(圖2-A)。對家蠶整個發(fā)育時期的表達情況進行定量檢測,結果顯示的表達水平在眠蠶期顯著高于起蠶期;在發(fā)育變態(tài)期,如預蛹期、蛹第7天及蛾第1天的表達量顯著升高(圖2-B)。對在預蛹期各組織的表達水平進行熒光定量PCR檢測,結果顯示在絲腺中表達量最高(圖2-C)。
5齡第3天家蠶個體在注射感染黑胸敗血芽孢桿菌或粘質沙雷氏菌后的1 h內,的表達水平上升,1 h后的表達水平逐漸恢復正常水平(圖2-D),而抗菌肽的表達量在注射粘質沙雷氏菌后持續(xù)上升(圖2-E)。
2.3 家蠶幼蟲干涉BmCasp8L
對5齡第2天家蠶幼蟲注射 dsCasp8L(對照為dsEGFP),24 h后再注射感染粘質沙雷氏菌,然后通過熒光定量PCR檢測家蠶中抗菌肽的表達量。結果顯示,注射dsCasp8L的家蠶與注射dsEGFP的對照家蠶相比,的表達水平下降了53%(圖3-A),且在感染粘質沙雷氏菌后,抗菌肽的表達水平明顯升高(圖3-B)。這一結果說明下調的表達水平導致抗菌肽的表達升高。
2.4 細胞中過表達及干涉BmCasp8L
BmE細胞轉染質粒pSL1180-A4-Caspase-8-like后,對BmCasp8L的表達通過Western blot予以了驗證(圖4-A)。用DAP-PGN刺激過表達BmCasp8L的細胞,其抗菌肽的表達顯著低于對照(圖4-B)。
將合成的dsRNA轉入BmE細胞中干涉的表達,并用熒光定量RCR檢測干涉效率,結果顯示在轉染dsCasp8L的細胞中的表達水平下降了70%(圖4-C)。干涉48 h后用DAP-PGN刺激細胞,在干涉的細胞中,抗菌肽的表達水平與對照細胞相比顯著上升(圖4-D)。
BmE細胞共表達BmCasp8L和BmRelish后,用DAP-PGN刺激細胞,通過Western blot對BmRelish的切割水平進行檢測。DAP-PGN的刺激導致BmRelish(BmRelishFL)的活化增強,而過表達BmCasp8L后,BmRelish的活化形式(BmRelishact)明顯減弱(圖4-E)。這說明BmCasp8L的表達會抑制BmRelish的活化。
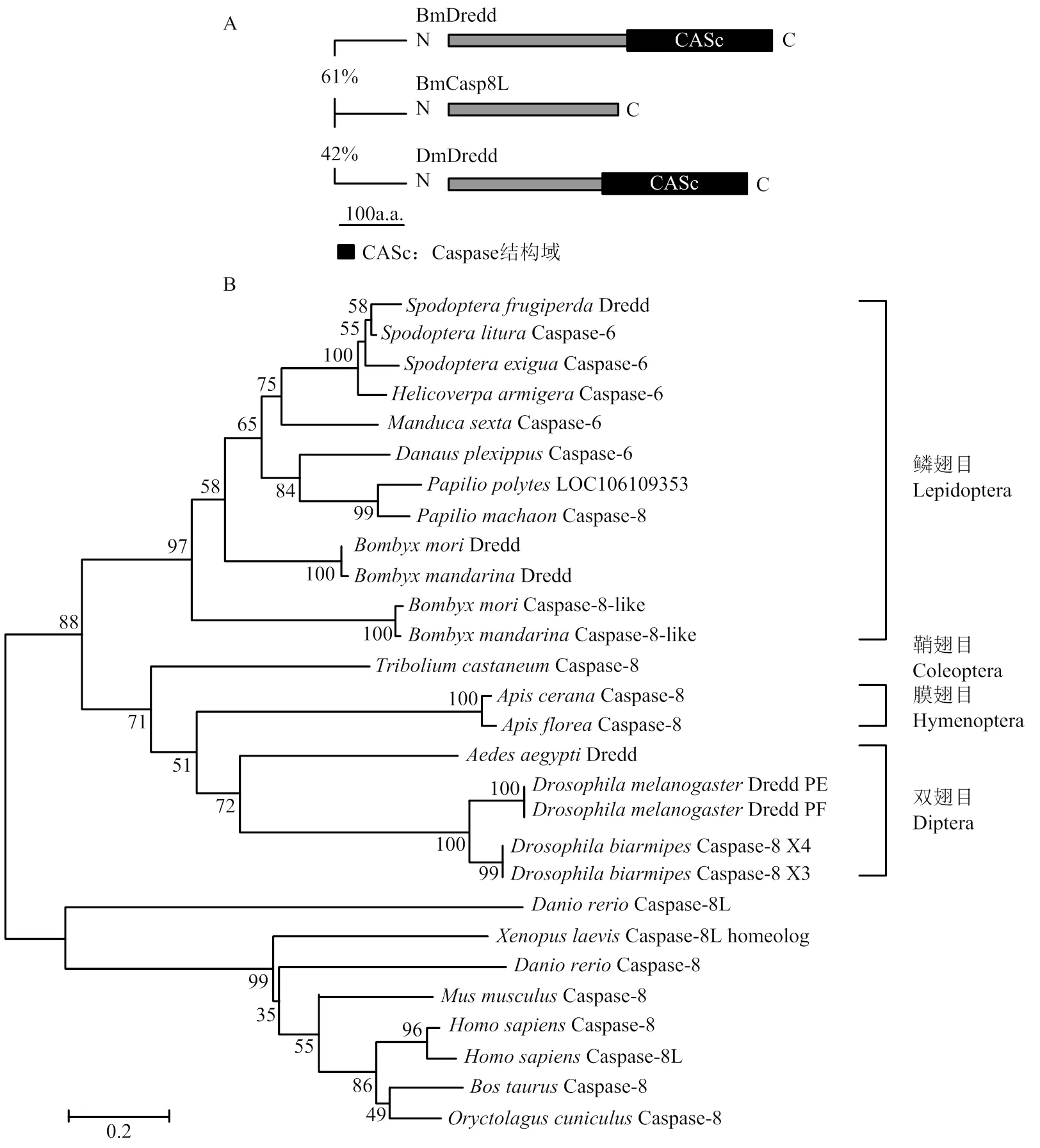
A:BmCasp8L與BmDredd、DmDredd結構域預測Domain prediction of BmCasp8L compared with BmDredd and DmDredd;B:BmCasp8L系統(tǒng)進化樹Phylogenetic tree of BmCasp8L
3 討論
與哺乳動物類似,昆蟲的NF-κB信號通路受到嚴格的調控。Imd信號通路從信號識別、受體復合物的形成到信號傳遞及轉錄因子的切割活化等各階段,均存在不同的負調控分子。對家蠶免疫負調控研究發(fā)現(xiàn),Caspar的同源分子BmFAF,能與轉錄因子Relish結合并促進其降解,從而抑制抗菌肽的表達[25-26];家蠶肽聚糖識別蛋白PGRP-S5能利用其酰胺酶活性負調控Imd信號通路[27]。本研究在細胞和個體水平上對家蠶BmCasp8L是否影響抗菌肽的表達和BmRelish的活化進行了探索,結果表明其參與Imd信號通路的負調控。
和抗菌肽在家蠶受到細菌感染時,呈現(xiàn)相反的變化規(guī)律,暗示其可能對抗菌肽表達具有抑制作用。該抑制作用繼而在家蠶個體水平上和細胞水平給予了驗證,并且在細胞中過表達BmCasp8L后,BmRelish的活化形式減少,進一步說明BmCasp8L是通過抑制BmRelish的切割來抑制抗菌肽的表達。在預蛹期各組織的表達水平顯示其在絲腺中表達量最高。預蛹期為蠶剛吐完絲向蛹期變化的過渡時期,在這個時期高表達可能暗示其參與絲腺細胞的凋亡,但具體作用尚不明確。的時空表達譜還顯示,該基因在家蠶變態(tài)時期的表達水平顯著升高,說明除免疫功能外,BmCasp8L還可能參與家蠶的發(fā)育進程。實際上,已有多項研究表明免疫負調控因子在昆蟲發(fā)育過程中發(fā)揮作用。例如,Imd信號通路負調控因子Trabid的缺失會造成果蠅壽命縮短[7]。
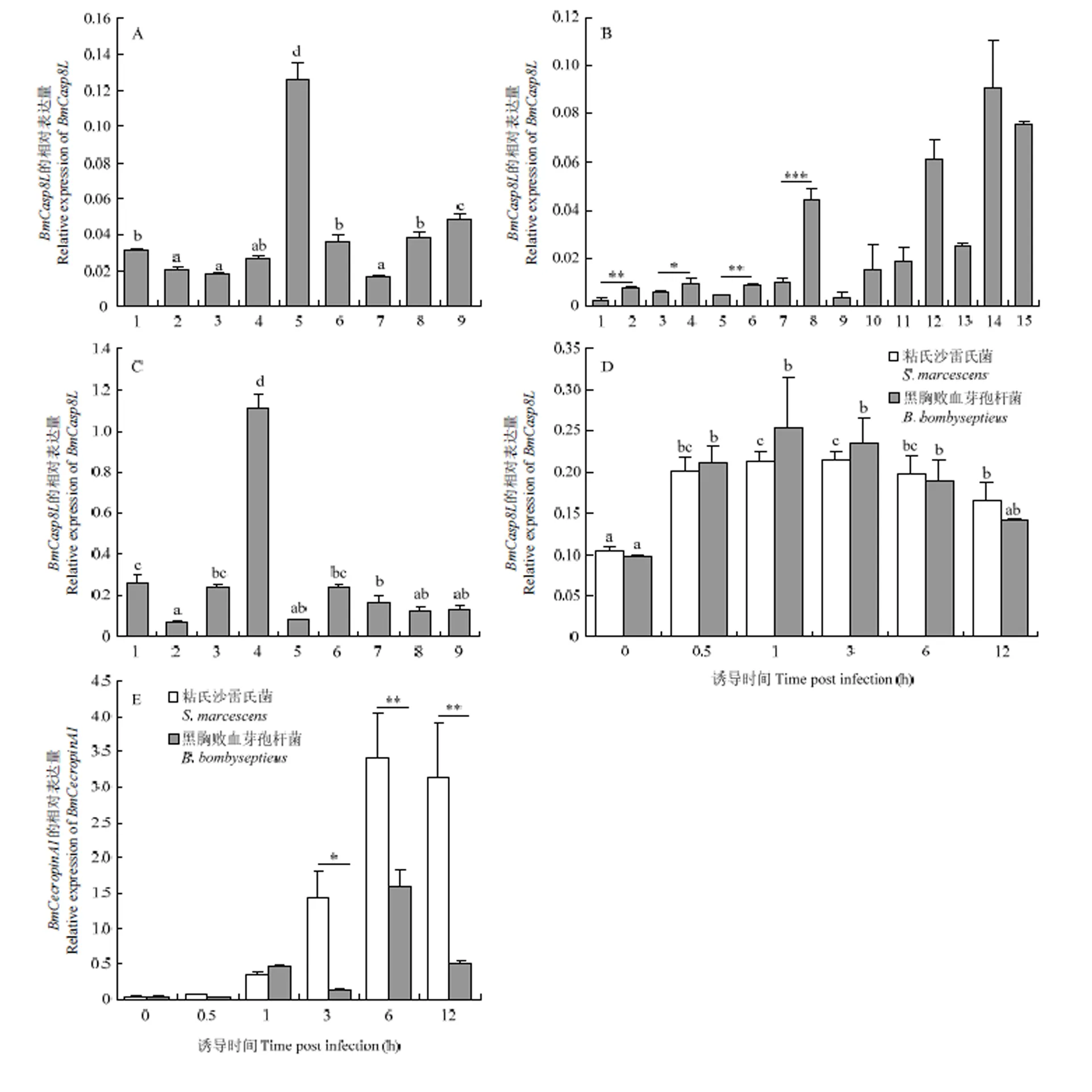
A:BmCasp8L的組織表達譜Expression profile of BmCasp8L in different tissues。1:頭部Head;2:表皮Integument;3:精巢Testis;4:卵巢Ovary;5:血細胞Hemocyte;6:中腸Midgut;7:絲腺Silk gland;8:脂肪體Fat body;9:馬氏管Malpighian tubule。B:BmCasp8L的時期表達譜Expression profile of BmCasp8L at different development stages。1:蟻蠶Hatch;2:1齡眠蠶1st-instar molting;3:2齡起蠶2nd-instar newly exuviated larva;4:2齡眠蠶2nd-instar molting;5:3齡起蠶3rd-instar newly exuviated larva;6:3齡眠蠶3rd-instar molting;7:4齡起蠶4th-instar newly exuviated larva;8:4齡眠蠶4th-instar molting;9:5齡起蠶5th-instar newly exuviated larva;10:5齡第3天3rd day of 5th-instar;11:5齡第7天7th day of 5th-instar;12:預蛹Prepupa;13:蛹第3天3rd day of pupa;14:蛹第7天7th day of pupa;15:蛾第1天1st day of moth。C:BmCasp8L預蛹期組織表達譜Expression profile of BmCasp8L in different tissues at prepupa stage。1:中腸Midgut;2:頭部Head;3:脂肪體Fat body;4:絲腺Silk gland;5:表皮Integument;6:馬氏管Malpighian tubule;7:血細胞Hemocyte;8:精巢Testis;9:卵巢Ovary。D:細菌感染家蠶后,BmCasp8L的表達Expression of BmCasp8L after injection of microbes。E:細菌感染家蠶后,抗菌肽BmCecropinA1的表達Expression of BmCecropinA1 after injection of microbes。P<0.05 *, P<0.01 **, P<0.001 ***
當DAP-PGN刺激細胞后,由Imd招募FADD,F(xiàn)ADD通過其DED結構域與BmDredd N端DED結構域相互作用,從而形成復合物。而BmCasp8L與BmDredd N端相似性高達61%,因此BmCasp8L可能也具有與FADD結合的能力;通過與FADD的相互作用,干擾了BmDredd與FADD的結合,從而抑制了轉錄因子Relish的活化并最終影響了抗菌肽的表達。
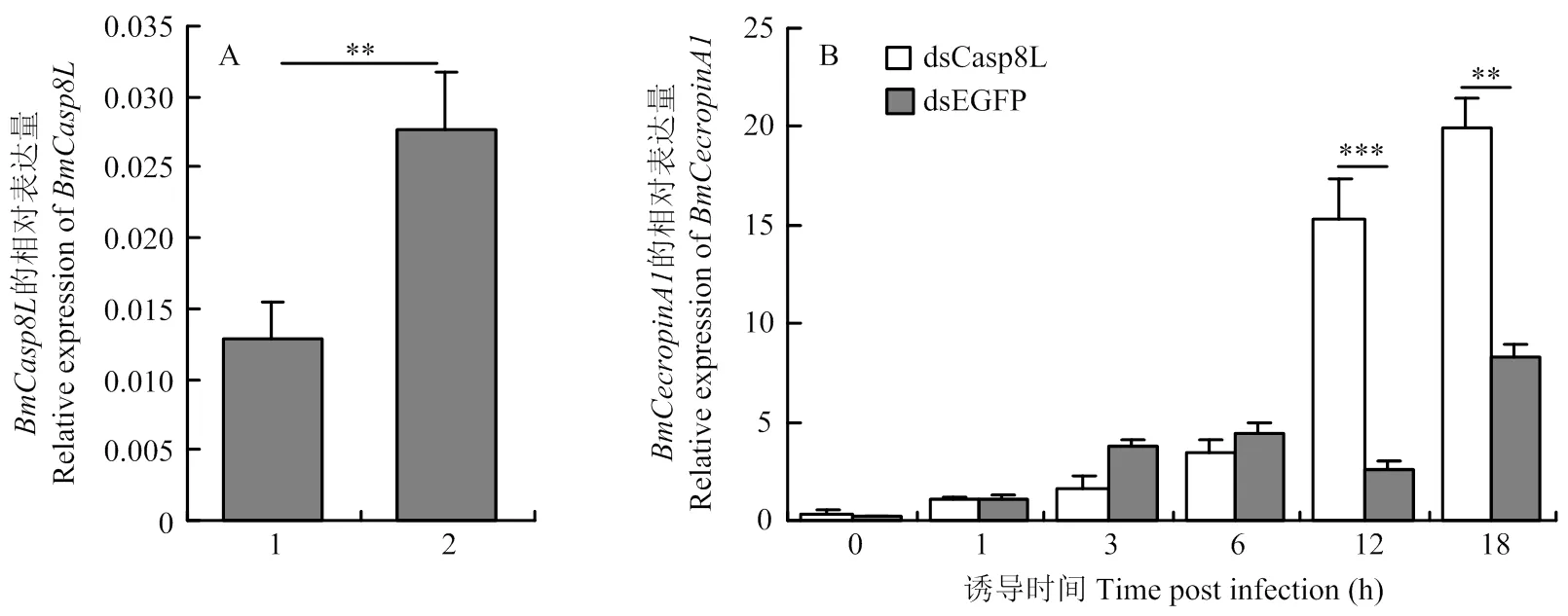
A:注射不同dsRNA的家蠶中BmCasp8L的表達水平定量檢測Quantitative analysis of the expression level of BmCasp8L in B. mori injected with different dsRNA。1:dsCasp8L;2:dsEGFP。B:注射不同dsRNA的家蠶中抗菌肽BmCecropinA1的表達水平定量檢測Quantitative analysis of the expression level of BmCecropinA1 inB. mori injected with different dsRNAs。P<0.01 **, P<0.001 ***
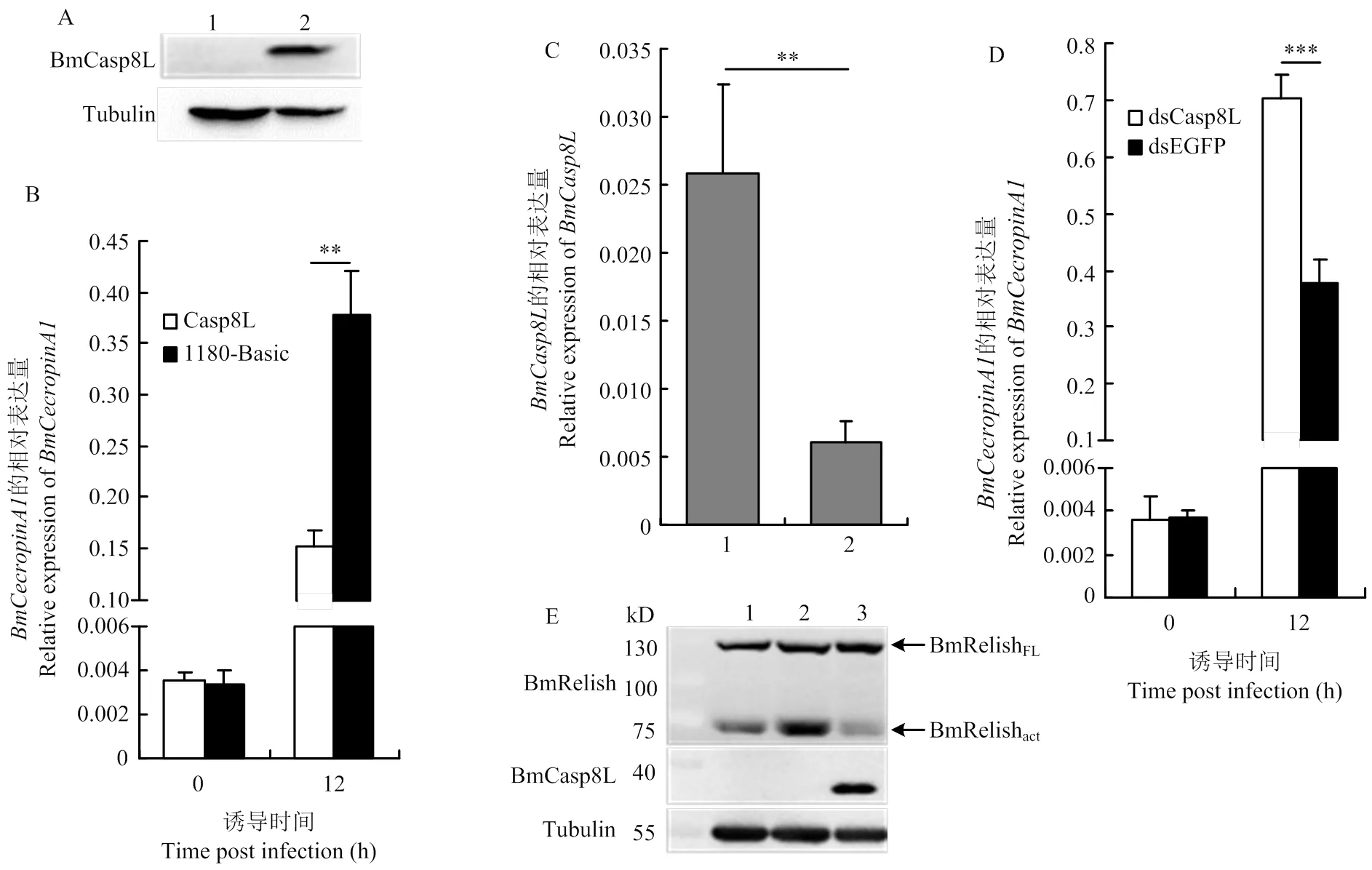
A:BmCasp8L的Western blot檢測Western blot detection of BmCasp8L。1:轉染pSL1180-A4空質粒的細胞Cells transfected with pSL1180-A4 empty vector;2:轉染pSL1180-A4-Caspase-8-like質粒的細胞Cells transfected with pSL1180-A4-Caspase-8-like。B:轉染pSL1180-A4-Caspase-8-like并用DAP-PGN刺激后抗菌肽BmCecropinA1的定量檢測Quantitative analysis of BmCecropinA1 expression level. Cells transfected with pSL1180-A4-Caspase- 8-like, treated with DAP-PGN。C:BmCasp8L的定量檢測Quantitative analysis of BmCasp8L expression level。1:轉染dsEGFP的細胞Cells transfected with dsEGFP;2:轉染dsCasp8L的細胞Cells transfected with dsCasp8L。D:轉染dsCasp8L并用DAP-PGN刺激后抗菌肽BmCecropinA1的定量檢測Quantitative analysis of BmCecropinA1 expression level. Cells transfected with dsCasp8L, treated with DAP-PGN。E:BmRelish的Western blot檢測Western blot detection of BmRelish。1:轉染pSL1180-A4-Relish質粒的細胞Cells transfected with pSL1180-A4-Relish;2:轉染pSL1180-A4-Relish質粒并用DAP-PGN刺激的細胞Cells transfected with pSL1180-A4-Relish and treated with DAP-PGN;3:轉染pSL1180-A4-Relish及pSL1180-A4-Caspase-8-like質粒并用DAP-PGN刺激的細胞Cells transfected with pSL1180-A4-Relish and pSL1180-A4-Caspase-8-like, treated with DAP-PGN。P<0.01 **, P<0.001 ***
有意義的是,果蠅和人均存在類似的與Caspase N端相似度高但缺乏其酶活結構域的分子。果蠅的Dredd基因編碼5個轉錄本。亞型和亞型(Flybase數據庫中現(xiàn)命名為Dredd-PE和Dredd-PD亞型)編碼全長的Dredd蛋白,亞型(Dredd-PG亞型)編碼的蛋白缺失Dredd的1—54 aa,亞型(Dredd-PF亞型)的mRNA因包含第2個內含子而導致蛋白翻譯提前終止,故缺失C端的Caspase結構域。研究表明Dredd-PF亞型在不同組織中均有表達,且Dredd-PF亞型能抑制細胞凋亡。凋亡誘導因子的活性會影響果蠅體內Dredd-PE和Dredd-PF亞型之間的比例——負調控Dredd-PF亞型的積累;且缺失的果蠅在感染后存活率較野生型果蠅低,這些現(xiàn)象說明Dredd-PF亞型參與果蠅的發(fā)育和免疫,其高水平表達可能抑制果蠅的免疫應答[28]。人Caspase-8也具有多個剪接異構體,其中Caspase-8L缺少C端的Caspase結構域,研究表明Caspase-8L是Caspase-8a(即全長Caspase-8)的抑制分子,它能與FADD和Caspase-8a結合從而阻止Caspase 8a與FADD結合,因此負調控Fas介導的細胞凋亡[29-30]。并且在自身免疫疾病系統(tǒng)性紅斑狼瘡患者的外周血細胞中,Caspase-8L mRNA的水平明顯低于正常個體,可能與過度免疫反應相關[31]。因此,BmCasp8L是否與Dredd-PF和Caspase-8L類似,在細胞凋亡中發(fā)揮負調控作用,也值得深入研究。
4 結論
從家蠶中克隆得到BmCasp8L,序列分析顯示該分子與Dredd同源,時空表達和免疫誘導表達檢測表明其具有免疫負調控分子特征,細胞及個體中該分子的過表達或干涉試驗證明該分子能夠抑制轉錄因子BmRelish的切割,并且抑制抗菌肽的表達從而發(fā)揮其免疫負調控功能,為進一步解析該分子在家蠶先天免疫信號通路中的負調控機制打下了基礎。
[1] Lemaitre B, Hoffmann J. The host defense of., 2007, 25: 697-743.
[2] Imler J L. Overview ofimmunity: a historical perspective., 2014, 42(1): 3-15.
[3] Dantoft W, DAVIS M M, Lindvall J M, Tang X, Uvell H, Junell A, Beskow A, Engstr?m Y. The Oct1 homolog Nubbin is a repressor of NF-κB-dependent immune gene expression that increases the tolerance to gut microbiota., 2013, 11: 99.
[4] Libert S, Chao Y, Chu X, Pletcher S D. Trade-offs between longevity and pathogen resistance inare mediated by NF-κB signaling., 2006, 5: 533-543.
[5] Kounatidis I, Chtarbanova S, Cao Y, Hayne M, Jayanth D, Ganetzky B, Ligoxygakis P. NF-κB immunity in the brain determines fly lifespan in healthy aging and age-related neurodegeneration., 2017, 19(4): 836-848.
[6] Cao Y,Chtarbanova S, Petersen A J, Ganetzky B. Dnr1 mutations cause neurodegeneration inby activating the innate immune response in the brain., 2013, 110(19): 1752-1760.
[7] Fernando M D, Kounatidis I, Ligoxygakis P. Loss of Trabid, a new negative regulator of theimmune- deficiency pathway at the level of TAK1, reduces life span., 2014, 10(2): e1004117.
[8] Bonnay F, COHEN-BERROS E, Hoffmann M, Kim S Y, Boulianne G L, Hoffmann J A, Matt N, Reichhart J M.gene modulates gut immune tolerance in., 2013, 110(8): 2957-2962.
[9] Myllymaki H, VALANNE S, Ramet M. Theimd signaling pathway., 2014, 192(8): 3455-3462.
[10] Meinander A, RUNCHEL C, Tenev t, Chen l, Kim C H, Ribeiro P S, Broemer M, Leulier F, Zvelebil M, Silverman N, Meier P. Ubiquitylation of the initiator caspase DREDD is required for innate immune signalling., 2012, 31(12): 2770-2783.
[11] 王菲, 李顯揚, 化曉婷, 夏慶友. 家蠶抗BmNPV細胞因子的篩選和分析. 中國農業(yè)科學, 2018, 51(4): 789-799.
WANG F, LI X Y, HUA X T, XIA Q Y. Screening and analysis of Anti-BmNPV cytokines in silkworm ()., 2018, 51(4): 789-799. (in Chinese)
[12] Foley E, O’farrell P H. Functional dissection of an innate immune response by a genome-wide RNAi screen., 2004, 2(8): e203.
[13] Brennan C A, Anderson K V.: The genetics of innate immune recognition and response., 2004, 22(1): 457-483.
[14] Hoffmann J A. The immune response of., 2003, 426(6962): 33-38.
[15] Bischoff V, Vignal C, Duvic B, Boneca I G, Hoffmann J A, Royet J. Downregulation of theimmune response by peptidoglycan-recognition proteins SC1 and SC2.2006, 2(2): e14.
[16] Zaidman-Remy A, HERVE M, Poidevin M, Pili-Floury S, Kim M S, Blanot D, Oh B H, Ueda R, Mengin-Lecreulx D, Lemaitre B. Theamidase PGRP-LB modulates the immune response to bacterial infection., 2006, 24(4): 463-473.
[17] 陳康康, 呂志強. 昆蟲肽聚糖識別蛋白研究進展. 昆蟲學報, 2014, 57(8): 969-978.
Chen K K, Lü Z Q. Peptidoglycan recognition proteins (PGRPs) in insects., 2014, 57(8): 969-978. (in Chinese)
[18] Costechareyre D, Capo F, Fabre A, CHaduli D, KELLENBERGER C, ROUSSEL A, CHARROUX B, ROYET J. Tissue-specific regulation ofNF-κB pathway activation by peptidoglycan recognition protein SC., 2016, 8(1): 67-80.
[19] Kleino A, MYLLYMAKI H, Kallio J, Vanha-Aho L M, Oksanen K, Ulvila J, Hultmark D, Valanne S, Ramet M. Pirk is a negative regulator of theImd pathway., 2008, 180(8): 5413-5422.
[20] Aggarwal K, RUS F, Vriesema-Magnuson C, Ertürk- Hasdemir D, Paquette N, Silverman N. Rudra interrupts receptor signaling complexes to negatively regulate the IMD pathway., 2008, 4(8): e1000120.
[21] Lhocine N, RIBEIRO P S, Buchon N, Wepf A, Wilson R. Tenev T, Lemaitre B, Gstaiger M, Meier P, Leulier F. PIMS modulates immune tolerance by negatively regulatinginnate immune signaling., 2008, 4(2): 147-158.
[22] Morris O, LIU X, Domingues C, Runchel C, Chai A, Basith S, Tenev T, Chen H, Choi S, Pennetta G, Buchon N, Meier P. Signal integration by the IkappaB protein pickle shapesinnate host defense., 2016, 20(3): 283-295.
[23] Guntermann S, Primrose D A, Foley E. Dnr1-dependent regulation of theimmune deficiency signaling pathway., 2009, 33(1): 127-134.
[24] Hua X, Li B, Song L, Hu C, Li X, Wang D, Xiong Y, Zhao P, He H, Xia Q, Wang F. Stimulator of interferon genes (STING) provides insect antiviral immunity by promoting Dredd caspase- mediated NF-κB activation., 2018, 293(30): 11878-11890.
[25] Ma X J, Li X Y, Dong S F, Xia Q Y, Wang F. A Fas associated factor negatively regulates anti-bacterial immunity by promoting Relish degradation in., 2015, 63: 144-151.
[26] 馬曉娟, 李亞明, 胡翠美, 王菲, 夏慶友. 家蠶免疫負調控分子的功能. 中國農業(yè)科學, 2014, 47(15): 3085-3093.
Ma X J, Li Y M, Hu C M, Wang F, Xia Q Y. Functional characterization ofas an immune negative regulatory molecule in silkworm ()., 2014, 47(15): 3085-3093. (in Chinese)
[27] Chen K, Zhou L, Chen F, Peng Y, Lu Z. Peptidoglycan recognition protein-S5 functions as a negative regulator of the antimicrobial peptide pathway in the silkworm,., 2016, 61: 126-135.
[28] Di Fruscio M, STYHLER S, Wikholm E, Boulanger M C, Lasko P, Richard S.interacts genetically with/, andmutants alter the balance ofisoforms., 2003, 100(4): 1814-1819.
[29] Himeji D, HORIUCHI T, Tsukamoto H, Hayashi K, Watanabe T, Harada M. Characterization of caspase-8L:a novel isoform of caspase-8 that behave as an inhibitor of the caspase cascade., 2002, 99(11): 4070-4078.
[30] Miller M a, KARACAY B, Zhu X, O'dorisio M S, Sandler A D. Caspase 8L, a novel inhibitory isoform of caspase 8, is associated with undifferentiated neuroblastoma., 2006, 11(1): 15-24.
[31] Horiuchi T, HIMEJI D, Tsukamoto H, Harashima S I, Hashimura C, Hayashi K. Dominant expression of a novel splice variant of caspase-8 in human peripheral blood lymphocytes., 2000, 272(3): 877-881.
Functional Characterization of BmCaspase-8-Like (BmCasp8L) as an Immune Negative Regulatory Molecule in Silkworm ()
HU Jie, WANG XinYi, WANG Fei
(State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716)
【Objective】The objective of this study is to characterize BmCaspase-8-like (BmCasp8L) as an immune negative regulatory molecule in silkworm () cell line as well as inlarvae, and to provide a basis for further studies of negative regulation mechanism in insect immunity.【Method】Domain prediction and phylogenetic analysis were performed after cloning ofby RT-PCR. Then fluorescence quantitative PCR was used to investigate the spatial-temporal expression profile ofat different development stages and in different tissues extracted from the 3rd day of 5th-instar larvae and prepupa, as well as the larvae body after bacterial infection. The dsRNA for RNAi was synthesized to silencein thelarvae, and the effect ofon expression of the anti-microbial peptides was studied. The plasmid for expressingin cells was constructed. After transfection of BmE cells with the expression constructs or dsRNA, Western blot or quantitative PCR was performed to confirm the over-expression or knock-down ofin cells. Meanwhile, the change in expression of the anti-microbial peptides and cleavage of nuclear transcription factor BmRelish were detected.【Result】BmCasp8L is homologous to Lepidoptera Caspase-6 and mammalian Caspase-8. The similarity between BmCasp8L and N-terminal of BmDredd, DmDredd is 61% and 42%, respectively, but it lacks the C-terminal Caspase domain. Spatial-temporal expression profile showed that in molting larvaelevel was higher than in newly exuviated ones, and theexpression level was significantly increased in the prepupa, 7th day of pupa and 1st day of moth stage. theexpression level in the hemocyte was significantly higher than in other tissues in the 3rd day of 5th-instar, but in the prepupa stage, it was mainly expressed in the silk gland. theexpression level in the 3rd day of 5th-instar larvae increased within 1 h post infection ofor, and then gradually returned to normal. Injection of dsCasp8L or dsEGFPinto the 2nd day of 5th-instar larvae,the expression ofwas significantly down-regulated ininjected with dsCasp8L, while the expression of antimicrobial peptidewas up-regulated after 24 h. Over-expression ofin BmE cells led to a remarkable decrease of the anti-microbial peptide. In addition, over-expression ofsuppressed the cleavage of the transcription factor BmRelish. Moreover, the expression level ofcould be efficiently knocked down by dsRNA, at the same time, the expression level ofwas significantly up-regulated. 【Conclusion】Phylogenetic analysis, expression features and functional studies in cells as well as inlarvae all indicated that BmCasp8L acts as an immune negative regulatory molecule by suppressing the cleavage of BmRelish and the expression of anti-microbial peptides, thereby negatively regulating the Imd signaling pathway, and down-regulation ofresulted in an increase of anti-microbial peptides which would potentially increase the resistance oflarvae to bacterial infection.
; immune negative regulation; BmCaspase-8-Like (BmCasp8L); expression feature; anti-microbial peptide; BmRelish
10.3864/j.issn.0578-1752.2018.21.017
2018-06-26;
2018-08-15
國家自然科學基金面上項目(31672495)
胡杰,Tel:023-68250748;E-mail:swuHj2016@163.com。通信作者王菲,Tel:023-68251569;E-mail:fwangswu@gmail.com
(責任編輯 岳梅)

