雙重病理所致顳葉癲癇邊緣系統MRI影像學表現
成麗娜, 汪文勝, 郭圣文, 賴春任, 趙地, 沈君
雙重病理(dual pathology,DP)是導致顳葉癲癇(temporal lobe epilepsy,TLE)的一種比較特殊的病理類型[1],在藥物難治性顳葉內側癲癇中DP的發生率為5%~30%,甚至高達55.5%[2]。最常見的類型為海馬硬化(hippocampal sclerosis,HS)合并局灶性腦皮質發育不良(focal cortical dysplasia,FCD)[3-5]。兩種致癇灶共存,相對其他類型TLE,DP所致TLE對患者邊緣系統(limbic system,LS)損傷情況的影像學研究報道不多[6]。基于體素的形態學(voxel based morphometry,VBM)及基于體素分析(voxel based ananlysis,VBA)可進行客觀全腦數據分析,本研究旨在完成MRI中T1WI、高b值擴散加權成像(diffusion weighted imaging,DWI)、三維偽連續動脈自旋標記(3D-pseudo-continuous arterial spin labeling,3D-pCASL)灌注成像在內的多模態成像,利用腦灰質體積、指數化表觀擴散系數(exponential apparent diffusion coefficient,eADC)、腦血流量(cerebral blood flow,CBF)協同分析該類型癲癇中邊緣系統的變化及其特征。
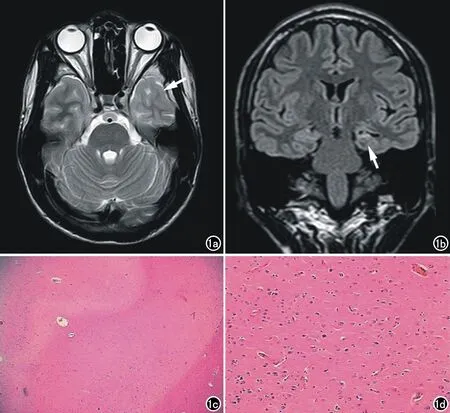
圖1 左側顳葉FCD(Ⅰb型)及左側HS。男,25歲。a) 左側顳葉(顳極顳下回)T2WI示局部腦灰白質分界模糊,灰質略增厚,白質減少(箭); b) T2WI FLAIR示左側海馬體積縮小,信號異常增高,左側顳角增寬(箭); c) 鏡下見海馬結構層次欠完整,神經元顯著減少,局部見少量核群,膠質細胞增生(×40,HE); d) 鏡下見顳葉神經元層狀結構紊亂,可見形態異常神經元和不成熟神經元,未見異型神經元及氣球樣細胞(×100,HE)。
材料及方法
1.臨床資料
搜集2014-2016年36例經手術病理證實的DP(HS合并FCD)TLE患者,其中左側組20例(男14例,女6例,平均年齡24.1±6.5歲),右側組16例(男8例,女8例,平均年齡23.6±7.6歲)。搜集36例健康對照組(男18例,女18例,平均年齡22.3±2.9歲)。TLE組間以及與對照組間性別、年齡、病程及發病年齡差異均無統計學意義(P>0.05)。本研究經醫院倫理委員會批準,所有研究對象均由家屬及本人簽署知情同意書。
2.影像學檢查
采用GE Signa HDxT 3.0T MR儀,以連合間線(AC-PC線)為基準。檢查包括T1WI(3D BRAVO序列,TR 8.8 ms,TE 3.5 ms,TI 450 ms,翻轉角13°,矩陣320×320,激勵次數1,視野240 mm×240 mm;層厚1.2 mm),DWI(TR 6000 ms,TE 95.2 ms,矩陣320×320,b值為0,3000 mm/s2,激勵次數1和6,視野240 mm×240 mm,層厚4 mm),3D-pCASL(TR 4599 ms,TE 9.8 ms,標記后延遲時間1525 ms,激勵次數3,視野240 mm×240 mm,層厚4 mm)。
3.圖像分析
在統計參數圖(statistical parametric mapping,SPM,http://www.fil.ion.ucl.ac.uk/spm/software/spm8)中使用工具包VBM8:T1WI原始圖像經過復位對齊、分割、標準化、平滑等預處理,獲得灰質圖像后分析。使用GE functool 4.6軟件對DWI及3D-pCASL原始數據進行后處理獲得eADC及CBF原始灰階圖,該灰階圖經過復位、頭動校正、配準對齊、標準化、平滑等預處理后分析。
4.統計學分析
采用兩獨立樣本t檢驗分析左、右側癲癇組與對照組灰質體積、eADC值、CBF值差異。所有被試者年齡、性別作為協變量參與統計分析,P≤0.001(FDR 校正),分別以體素閾值K>100voxels認為差異有統計學意義,以解剖自動標記(anatomical automatic labeling,AAL)模板標識腦區。
結 果
病理證實為HS合并FCD的DP,FCD檢出部位包括前顳葉、杏仁核所在腦區。依據2011年國際抗癲癇聯合會(international league against epilepsy,ILAE)FCD分型,在20例左側TLE組中,FCDⅠ型11例,FCDⅡ型7例,FCDⅢ型2例;16例右側TLE組中,FCDⅠ型9例(圖1),FCDⅡ型5例,FCDⅢ型2例(圖2)。其中FCDⅠb型數量最多,共14例。
左、右側TLE組分別與正常對照組比較,邊緣系統所在腦區差異均具有統計學意義,t值均為正,即灰質體積減小、eADC值降低、CBF值降低。三種檢查中均檢出異常為病側海馬及海馬旁回、眶額皮質,二種檢查檢出異常為杏仁核、內側額上回、扣帶回,僅一種檢查檢出異常為額葉直回、丘腦,右側癲癇組同時組累及對側邊緣系統腦區包括對側眶額皮質、內側額上回、額葉直回、丘腦(表1,圖3~4)。

表1 左、右側TLE組灰質體積、eADC、CBF值統計結果圖中邊緣系統腦區異常改變
注:表格中每個類別所在列左(右)側為左(右)側TLE組,每個類別所在行中1~3亞行為病側,4~6亞行為對側。(FDR校正,P≤0.001,K>100)
討 論
顳葉癲癇中已有報道出現邊緣系統的異常[7],除了海馬,還影響邊緣系統其他結構[8]。邊緣系統損傷往往是TLE患者合并存在精神癥狀[9]、認知下降等臨床表現的重要因素。在雙重病理這一類型的顳葉癲癇患者中,致癇病理灶更多,病變范圍更廣泛,對邊緣系統損害情況尚未有單獨詳細報道。邊緣系統目前大致分為三個部分:顳葉內側邊緣系統結構,包括海馬結構、杏仁體、扣帶回和嗅周皮質;丘腦內側核團;額葉的腹內側部分,包括眶額皮質、前額葉內側[10][11]。
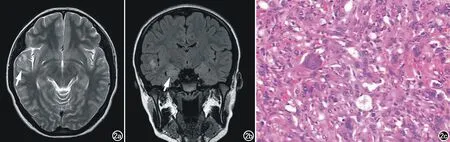
圖2 右側顳葉FCD(Ⅲb型,皮質層狀結構異常毗鄰膠質瘤或神經節細胞瘤)及右側HS。女,17歲。a) 右側顳葉(顳上回)T2WI示小片狀等、高混雜信號,腦組織輕度腫脹,局部腦灰白質分界模糊(箭); b) T2WI FLAIR示右側海馬信號異常增高(箭); c) 鏡下見右側顳葉瘤細胞大小不一,可見單核和多核瘤巨細胞、梭形雙極瘤細胞,核分裂可見(×200,HE)。
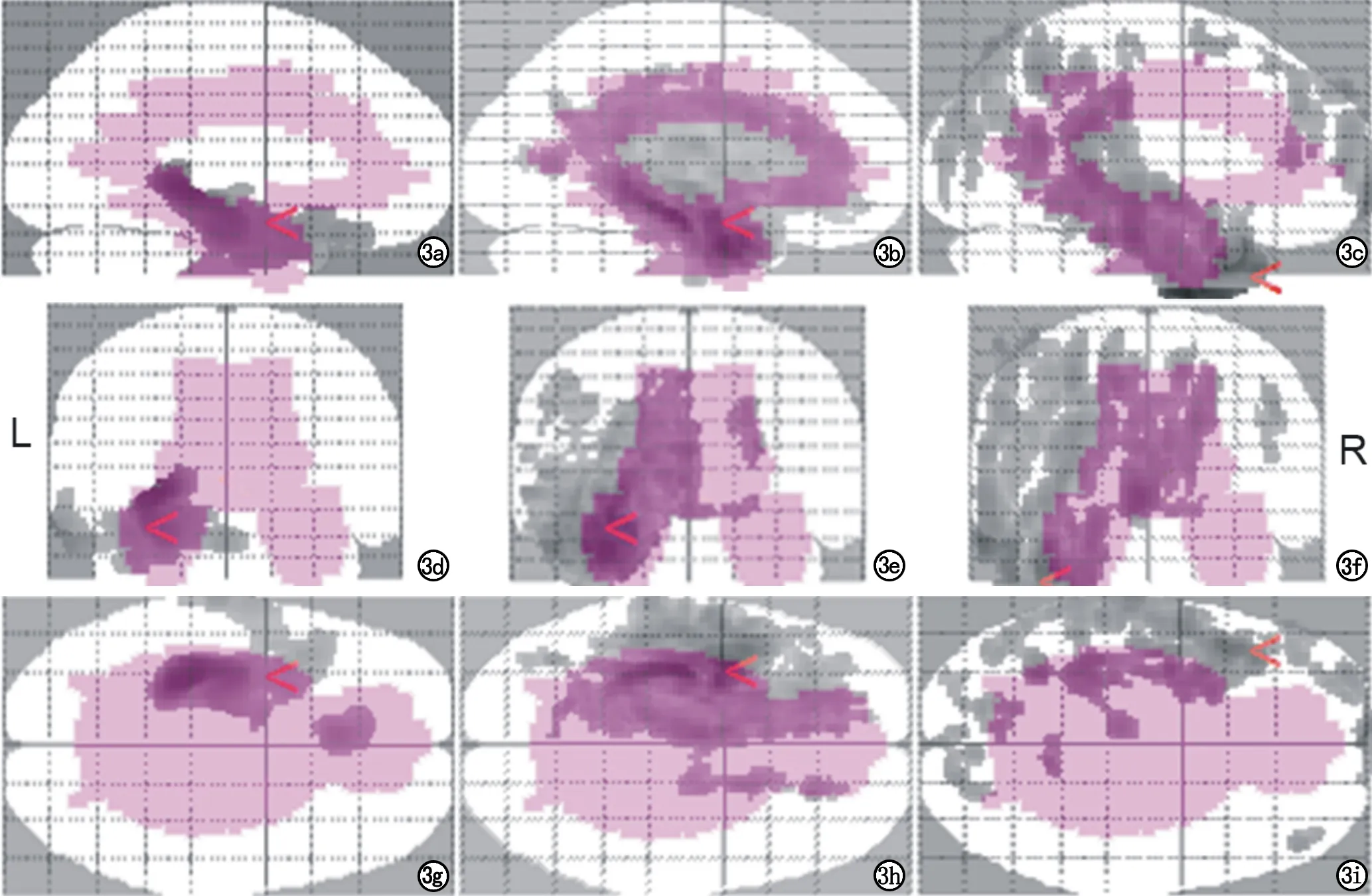
圖3 左側TLE組邊緣系統腦區異常分布圖。灰色區域分別代表異常腦區,其中與邊緣系統紫色模板中重疊的范圍為存在異常的邊緣系統腦區的分布,功能像檢出異常范圍大于結構像,統計結果顯示左側組未出現對側邊緣系統腦區異常。a、d、g) T1WI灰質體積異常示意圖; b、e、h) eADC值異常示意圖; c、f、i) CBF值異常示意圖。
在右側顳葉癲癇組中,非病側邊緣系統亦發生異常,這種邊緣系統鏡像損傷現象在其他基礎研究中同樣有發現[12],如在癲癇的海馬、顳葉組織結構MRS及FLAIR檢查中對側海馬、顳葉有異常[13-14]。Concha等[15]也發現在單側顳葉癲癇中邊緣系統雙側存在DTI異常,但并沒有進一步分析左、右側顳葉癲癇的差異。另外通過圖論方法提示左、右側顳葉癲癇邊緣系統功能連接都明顯減弱,而右側顳葉癲癇更明顯[16],也反映出左、右側顳葉癲癇在邊緣系統改變是存在區別的。本研究通過灰質體積、eADC、CBF的發現與上述研究類似,并且支持認為DP情況下邊緣系統鏡像損傷更集中表現在右側顳葉癲癇組。

圖4 右側TLE組邊緣系統腦區異常分布圖。灰色區域分別代表異常腦區,其中與邊緣系統紫色模板中重疊的范圍為存在異常的邊緣系統腦區的分布,功能像檢出異常范圍大于結構像,統計結果顯示右側組出現對側邊緣系統腦區異常。a、d、g) T1WI灰質體積異常示意圖; b、e、h) eADC值異常示意圖; c、f、i) CBF值異常示意圖。
除功能成像較結構像更敏感發現異常之外,CBF值與eADC值異常變化的腦區進一步對比,邊緣系統中原eADC異常的腦區如杏仁核、丘腦在CBF圖中未有異常發現,彌散反映的相關結構變化和其灌注的不匹配可能的原因為損傷主要不是因灌注減低引起,而是異常放電、結構異常等其他因素。另外杏仁核、丘腦等結構在既往顳葉內側癲癇的CBF研究中認為具有異常[17-19],本組CBF研究則不顯著,一定程度提示此研究中DP類型具有相關獨有特征。
綜上所述,邊緣系統損傷存在于DP所致顳葉癲癇中,且右側顳葉癲癇組更容易合并損傷病變對側。多模態MRI檢查可為臨床分析評估DP所致TLE患者邊緣系統損傷起源神經功能障礙提供客觀的影像學依據。

