納米TiO2對土壤中硝態氮質量比及硝酸還原酶活性的影響
封保根, 郭 平, 李琳慧, 孫 影, 陳薇薇
(吉林大學 新能源與環境學院, 地下水資源與環境教育部重點實驗室, 長春 130012)
納米TiO2具有較高的化學穩定性、 熱穩定性、 光學性質以及殺菌和自清潔功能, 在材料、 生物和電子等領域應用廣泛[1]. 在生產和使用過程中, 納米TiO2可通過各種途徑進入土壤生態系統中, 從而對土壤生態系統環境和功能產生影響.
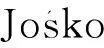
目前, 關于納米TiO2對土壤中反硝化作用的影響尚未明確. 反硝化作用作為土壤氮素循環中的一個重要過程, 也是導致土壤中氮流失的主要途徑之一, 其在硝態氮質量比和硝酸還原酶(nitrate reductase, NR)活性方面[11-12]具有重要作用. NR是反硝化作用第一個環節所用酶, 在一定條件下限制反硝化作用速率, 硝態氮作為NR反應的底物, 直接影響反硝化作用的強度[13-14]. 本文采用盆栽實驗方法考察納米TiO2添加量、 土壤類型和植物對土壤硝態氮質量比和NR活性的影響, 為納米TiO2對土壤生態系統環境和功能風險評估提供科學的理論依據.
1 材料與方法
1.1 實驗材料

表1 供試土壤的基本理化性質Table 1 Basic physicochemical properties of tested soils
供試植物選擇紫花苜蓿中苜一號(購于北京市畜牧研究所). 納米TiO2(d=25 nm)購于廣州門德納米科技有限公司. 聚乙烯花盆規格為高10 cm、 上口直徑11 cm、 下口直徑7.5 cm.
1.2 實驗設計
采用盆栽實驗方法, 共設計14個處理, 每個處理重復3次, 實驗設計列于表2. 在每個花盆中先加入0.3 kg風干土壤樣品, 再加入納米TiO2并混勻. 常規施肥量為w(N)=0.2 g/kg,w(P)=0.06 g/kg,w(K)=0.11 g/kg. 氮肥、 磷肥、 鉀肥分別為尿素、 磷酸二氫鉀、 硫酸鉀. 實驗期間保持土壤含水量為田間持水量的60%. 無論是否種植紫花苜蓿, 均在第0,15,30,45,60 d取樣測量土壤中硝態氮質量比和NR活性. 土壤硝態氮素質量比測定方法同1.1; 采用酚二磺酸比色法測定土壤NR活性[16].
1.3 數據處理與分析
由于TiO2對硝態氮質量比和NR活性具有降低作用, 因此采用降低程度表示TiO2對硝態氮質量比和NR活性的影響:

繪圖工具使用Origin 8.0軟件(美國OriginLab公司), 統計分析采用SPSS 21軟件(美國IBM公司)進行.
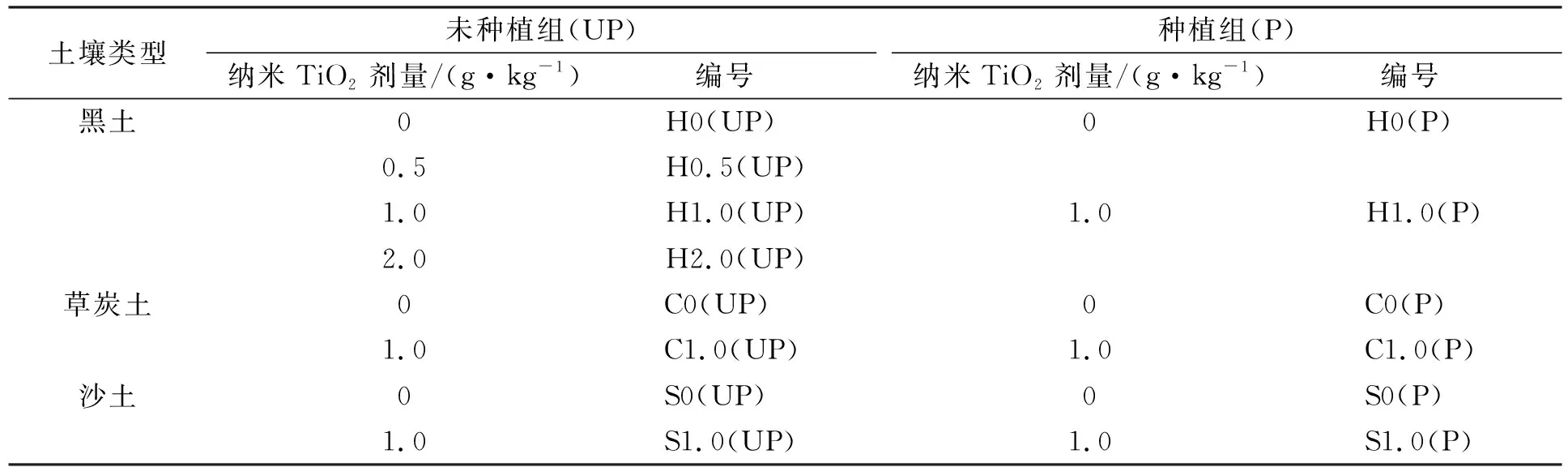
表2 實驗設計Table 2 Experimental design
2 結果與分析
2.1 納米TiO2添加量對黑土中硝態氮質量比和NR活性的影響


圖1 納米TiO2添加量對黑土中硝態氮質量比(A)和NR活性(B)降低程度的影響Fig.1 Effects of nano-TiO2 addition on degree of reduction of mass ratio of nitrate nitrogen (A) and NR activity (B) in black soil
在土壤微生物和酶的作用下, 尿素水解為銨態氮, 銨態氮氧化為硝態氮, 土壤中硝態氮主要來源于土壤的硝化作用[17]. 納米TiO2對黑土中硝態氮質量比的影響可能與納米材料對土壤微生物和酶的生態毒性有關[3-4]. 因此, 納米材料通過抑制土壤脲酶的活性, 抑制土壤中銨態氮的轉化, 減少硝化作用的反應底物, 從而降低土壤中硝態氮的質量比. 此外, 納米材料對土壤中硝化細菌活性具有一定的抑制作用[7,9,18]. 納米TiO2通過抑制土壤的銨態氮轉化速率和硝化作用, 抑制土壤中硝態氮的產生, 從而降低土壤中硝態氮的質量比. 隨著培養時間的增加, 土壤性質對納米TiO2生物活性的抑制作用加強, 對土壤微生物的脅迫作用減弱, 因此實驗中土壤硝態氮質量比降低程度呈先增加后降低的趨勢. 隨著納米TiO2添加量的增加, 納米TiO2對硝態氮質量比的降低程度增加.
硝態氮作為土壤反硝化作用的底物, 其質量比還受NR活性的影響. NR是反硝化作用中的第一個酶, 可能受底物硝態氮質量比降低的影響而降低了NR的酶活性, 也可能受納米TiO2的影響而降低其酶活性. 納米TiO2可以吸附相關酶, 導致一系列酶學性質(如最適pH值、 穩定性、 活性及動力學)發生顯著變化[19]. 大量納米TiO2進入土壤能為NR提供大面積的反應位點[20], 從而增強納米TiO2對NR的毒害作用, 降低NR活性. 此外, 大量納米材料進入土壤后會對土壤的理化性質(如pH值和離子強度)產生影響[19], 進而影響NR活性. 由于納米TiO2可穿過細胞膜進入細胞內, 破壞細胞膜并擾亂細胞內的生理活性, 因此降低了NR酶活性[21-22]. 隨著培養時間的增加, 土壤性質對納米TiO2生物活性的抑制作用加強, 對土壤微生物的脅迫作用減弱, 使納米TiO2對NR活性的降低程度呈先增加后降低的趨勢; 隨著投加量的增加, 納米TiO2對NR的脅迫作用增大, 其對NR活性的降低程度也增加. 土壤中NR受納米TiO2的影響和誘導底物硝態氮質量比的減少而使其活性降低. 在培養初期, 隨培養時間的增加, NR活性抑制效果增加, 在第15天降低程度達到最高. NR活性增強, 促進了硝態氮的還原, 從而降低了硝態氮的質量比. 硝態氮質量比受納米TiO2對銨態氮轉化以及硝化作用的抑制和NR活性增加的影響, 在第30天降低程度達到最高. 隨著培養時間的增加, 納米TiO2的降低作用減弱, 其對土壤中硝態氮質量比和NR活性的降低程度逐漸降低. 因此, 納米TiO2對NR活性的降低作用大于對硝態氮質量比的降低作用, 進一步說明納米TiO2對土壤反硝化作用具有抑制作用.
2.2 TiO2對不同土壤中硝態氮質量比和NR活性的影響
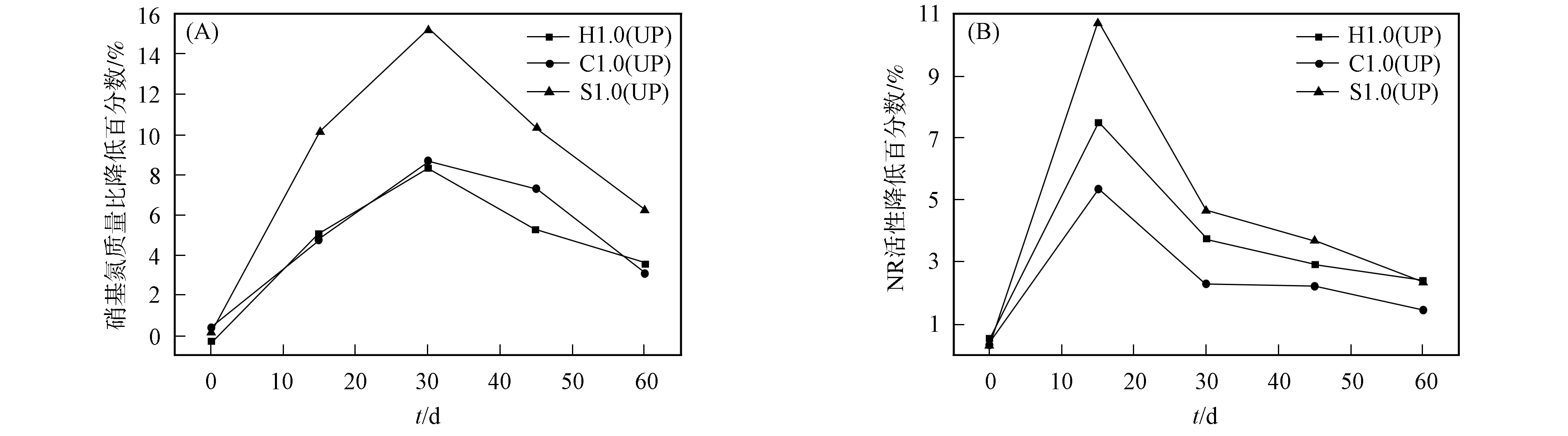
圖2 1.0 g/kg的納米TiO2對不同土壤中硝態氮質量比(A)和NR活性(B)降低程度的影響Fig.2 Effects of nano-TiO2 (1.0 g/kg) on degree of reduction of mass ratio of nitrate nitrogen (A) and NR activity (B) in different soils
納米TiO2(1.0 g/kg)對3種土壤中硝態氮質量比和NR活性有不同的抑制效果, 可能是由于土壤理化性質對納米TiO2的生物活性具有一定影響所致. 實驗所用的3種土壤在pH值、 有機質和CEC等指標上有顯著不同. 土壤中的有機質、 表面電荷、 土壤黏性物質、 pH值和離子強度等是影響金屬納米顆粒毒性的主要因素. 納米粒子在土壤中會發生團聚作用, 降低其活性, 較高的有機物質量比和離子強度可增強納米TiO2在土壤中的團聚作用[23-24]. 土壤的pH值和有機質可改變納米TiO2的電動性質與聚集狀態, 從而影響納米TiO2的穩定性和遷移性[25], 土壤有機質質量比與納米材料吸附量成正比[26]. 在實驗中, 沙土中硝態氮質量比和NR活性受納米TiO2影響的降低程度最大, 可能是由于供試土壤中沙土的pH值和有機質質量比較低, 進入沙土中的納米TiO2易發生團聚, 使得遷移性和穩定性均比進入黑土和草炭土中的TiO2弱, 導致納米TiO2的生物毒性作用比黑土和草炭土中的強. 由于黑土與草炭土的pH值相近, 草炭土中有機質質量比較黑土中的高, 因此納米TiO2在草炭土中對硝態氮質量比和NR活性的降低效果略低于黑土.
土壤的pH值會影響硝化作用和反硝化作用, 中性或弱堿性土壤有利于硝化作用和反硝化作用的持續進行[27]. 沙土的pH呈酸性, 抑制土壤的硝化作用和反硝化作用, 進而降低土壤中硝態氮質量比和NR活性. 黑土和草炭土的pH為弱堿性, 對土壤中硝態氮質量比和NR活性的降低作用較弱. 土壤酶與有機質在納米材料上均有較強的吸附能力, 產生位點競爭[28]. 因此, 有機質質量比增加可降低納米TiO2的生物活性, 但有機質能促進納米材料對土壤中酶的吸附作用, 即促進納米材料在土壤中的擴散, 從而使其表面的吸附位點增加[29].
2.3 紫花苜蓿存在下納米TiO2對土壤中硝態氮質量比和NR活性的影響
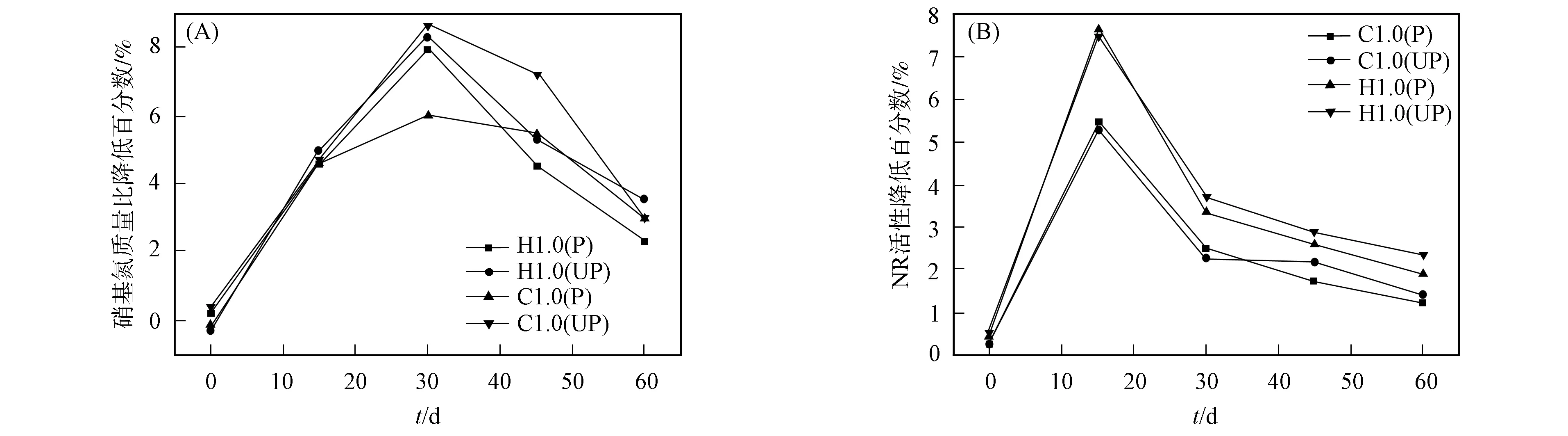
圖3 紫花苜蓿存在下納米TiO2對土壤中硝態氮質量比(A)和NR活性(B)降低程度的影響Fig.3 Effects of nano-TiO2 on degree of reduction of mass ratio of nitrate nitrogen (A) and NR activity (B) in soil in presence of alfalfa
種植紫花苜蓿能降低納米TiO2對土壤中硝態氮質量比和NR活性的降低程度, 可能與紫花苜蓿的生物效應有關. 納米材料可通過水分子通道或離子通道、 內吞作用、 穿透作用及結合環境介質中的有機物質等進入植物根系細胞[30], 從而降低了土壤中納米TiO2的質量比及其生物活性. 植物在生長過程中會向土壤分泌根系分泌物, 如碳水化合物、 有機酸和酶等. 植物根系分泌物會對納米材料的生物活性產生一定影響, 降低其毒性效應[31]. 因此, 種植紫花苜蓿可降低納米TiO2在土壤中的生物毒性.
綜上所述, 本文可得如下結論: 納米TiO2對土壤中硝態氮質量比和NR活性均具有降低作用, 該作用受納米TiO2添加量、 土壤類型和植物的影響, 降低程度隨時間呈先增加后降低的趨勢; 在相同采樣時間下, 納米TiO2添加量越高, 其對土壤中的硝態氮質量比和NR活性降低程度越明顯; 納米TiO2對不同土壤中硝態氮質量比和NR活性降低程度不同, 降低程度順序為沙土>黑土>草炭土; 紫花苜蓿存在下, 納米TiO2對土壤中硝態氮質量比和NR活性的降低程度減弱, 即種植紫花苜蓿可降低納米TiO2在土壤中的生物毒性; 納米TiO2對NR活性的降低程度大于對硝態氮質量比的降低程度.

