牙釉質基因巢式PCR鑒定豬ICSI胚胎性別
孫俊麗,廖海洪,張 冰,孫如玉,盧克煥,盧晟盛
(1.廣西大學 動物科技學院,廣西 南寧 530004; 2. 廣西畜牧研究所 家畜遺傳改良重點實驗室,廣西 南寧 530001)
【研究意義】家畜性別鑒定和控制技術可實現受性別限制(泌乳、產蛋)或者影響(毛皮、肉質、生長速度)生產性狀后代的選擇,增加選種強度,加速遺傳改良進程,提高產品質量,實現畜牧業生產經濟效益最大化[1],與超數排卵、活體采卵、體外受精、胚胎體外培養及胚胎分割等技術聯合使用,必將對畜牧業發展做出更大貢獻。在野生動物保護和利用方面,可通過鑒定野生動物的殘留物(糞便、毛發等)中的DNA,了解野生動物的種群數量和性別比例,為野生動物的保護和利用提供科學依據。【前人研究進展】性別鑒定技術是實現后代性別控制的主要途徑之一。基于因性別而異的DNA序列的PCR擴增法以其特異性強、靈敏、快速、便捷、重復性好等優點,被廣泛應用到各個性別鑒定領域,特別是對腐爛、降解的考古和法醫樣品[2-4]、微量的胚胎樣[5-6]和游離DNA樣[7-9]等鑒定中,展現出其較高的應用價值。以PCR擴增為基礎的性別鑒定,目的基因的選擇是關鍵,最初多選擇Y染色體上特有基因,如雄性性別決定基因(SRY)、Y染色體上的重復序列等,根據擴增產物的有無判定,一旦基因擴增失敗,出現假陰性結果[10-13]。因此,需另外設計1對常染色體基因引物作為內參,提高判定的準確率,但多對引物同時擴增易產生引物二聚體,給PCR反應條件優化帶來一定的困難。隨后,X、Y染色體上的同源基因—鋅指蛋白基因(ZFx/ZFy)[14]和牙釉質基因(AMELx/AMELy)序列差異的發現,一對引物即可實現性別的準確鑒定,現已被廣泛應用于部分動物的性別鑒定[15-20]。但是,常規PCR擴增對模板濃度有一定要求,微量樣品(如胚胎活檢、游離DNA)的鑒定則存在一定的難度,而巢式PCR擴增的出現解決了這一困境。【本研究切入點】近幾十年來,因新的生殖技術的發展和應用,養豬業的生產力顯著提升。而針對豬胚胎性別鑒定的文獻卻很少,大部分則集中在Y染色體特異基因[21-22],僅有少數針對AMEL基因的報道,且均采用的是常規PCR[23-24]。【擬解決的關鍵問題】根據豬AMELx和AMELy序列的比對,設計了2對引物經巢式PCR擴增鑒定豬ICSI早期囊胚的性別,為豬胚胎活檢或者微量DNA樣品的性別鑒定提供一種準確、可靠的PCR方法,并研究ICSI操作對胚胎性別發育的影響。
1 材料與方法
1.1 主要試劑和儀器
供試試劑藥品除特別說明外,均購自美國Sigma公司;2×PCR mix、蛋白酶K、組織樣基因組提取試劑盒: 北京康為世紀生物科技有限公司;DL2000 DNA Marker: 南京生興生物技術有限公司;TCM-199:Gibco,美國;FSH、LH:中國科學院動物研究所;胎牛血清(Fetal bovine serum, FBS):美國Hyclone公司。
梯度PCR儀(德國Biometra公司),凝膠成像系統AlphaImager HP(美國Naturegene公司),可調式微量移液器、臺式高速離心機Centrifuge 5415 D (德國eppendorf公司),電泳儀DDY-2C型(北京六一生物科技有限公司),顯微操作儀、體視顯微鏡(日本Nikon公司),CO2培養箱(美國ThermoFisher Scientific公司)等等。
1.2 試驗材料
10頭豬耳組織樣品采自廣西畜牧研究所試驗豬場。豬卵巢采自廣西南寧市石埠屠宰場,置于30~37 ℃含雙抗的生理鹽水中,3 h內保溫送回實驗室。
1.3 引物設計和合成
根據豬AMEL基因內含子3區域序列(AMELx,GenBank accession No.:AB091791 ;AMELy,GenBank accession No.:AB091792),采用BLAST和Clustal W程序設計巢式引物。
外引物:
AMEL-Fo: 5'-AAGCTACCACCTCATCCTG -3'
AMEL-Ro: 5'-GCCATCTCATACTTTCCCTTG -3'
內引物:
AMEL-Fi: 5'-GGTGGATTCTTCATTCAGGATG -3'
AMEL-Ri: 5'-AAAGACCAGCGAGGGAGA -3'
兩對引物均由金斯瑞生物科技有限公司合成。
雌雄PCR產物僅9~10 bp的缺失,在瓊脂糖凝膠中不能被明顯區分,但可用聚丙烯酰胺凝膠進行分型。而本實驗則是在其內引物F5'端添加6-FAM熒光,用于PCR產物片段掃描分型。
引物合成后,根據每管OD值加ddH2O調節濃度10 pm,漩渦混勻,4 ℃冰箱放置2 h以上,使引物充分溶解。
1.4 試驗方法
1.4.1 豬耳組織的采集和基因組提取 從廣西畜牧研究所試驗豬場采集了5頭公豬和5頭母豬的耳組織樣,75 %酒精保存帶回實驗室。按照組織樣基因組提取試劑盒的使用說明,提取基因組DNA,瓊脂糖凝膠電泳檢測,并參照電泳條帶的亮度將樣品DNA濃度調整至相似水平。
1.4.2 豬精液前處理 商用17 ℃保存豬鮮精液,取200 μl 液加入2 mL DPBS溶液,1000 r/min,5 min離心洗滌2~3次,再加入1 mL DPBS溶液,置于JT92-2D超聲波細胞粉碎機進行精子斷尾處理,1000 r/min,2 min離心,棄上清,最后將離心好的精子稀釋到106個/mL 備用[25]。
1.4.3 豬ICSI胚胎生產和培養 按照本課題組長期使用的豬ICSI胚胎生產流程操作。經化學激活(離子霉素3.5 min和6-DAMP 3.5 h)后,將胚胎移入已平衡4 h時以上的PZM-3溶液中清洗,再放入PZM-3滴,每滴15~20枚胚胎,置于38.5 ℃,5 % CO2和100 %濕度培養箱培養。
1.4.4 常規PCR擴增 以豬基因組DNA樣品為模板,對巢式內、外引物的特異性進行驗證,并優化擴增條件,反應體系(表1)。
PCR 反應條件為:95 ℃ 5 min;95 ℃ 30 s,X ℃ 30 s, 72 ℃ 30 s,32個循環;72 ℃ 8 min。其中外引物的退火溫度為60 ℃,內引物的退火溫度為62 ℃,擴增的特異性較好。
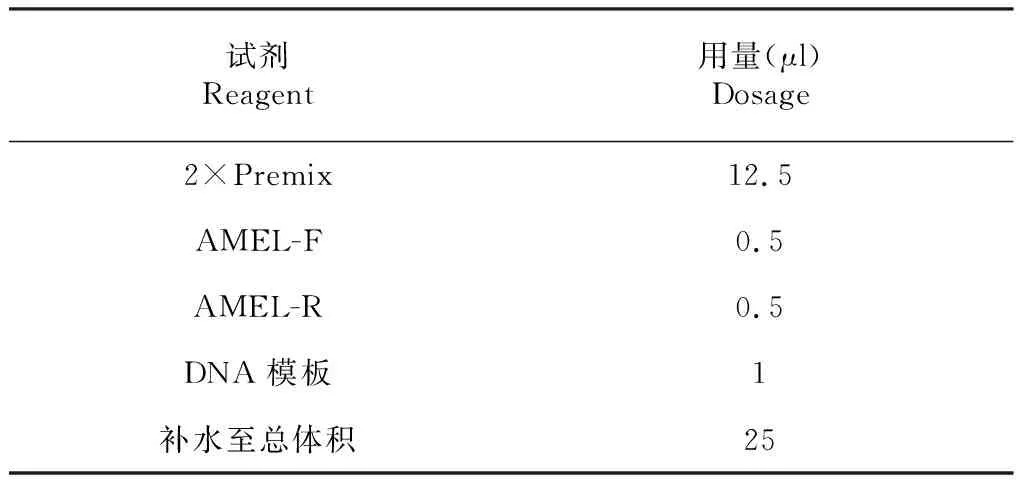
表1 PCR擴增反應體系
1.4.5 瓊脂糖凝膠電泳分析 取 3 μl PCR 擴增產物于1.5 %的瓊脂糖凝膠(含 0.05 μg/mL gelred),電壓 110 V,電泳時間 50 min,紫外透射儀觀察擴增結果,在全自動數碼成像及分析系統上拍照。
1.4.6 豬囊胚的獲得和細胞裂解 在體視顯微鏡下,吸取單個囊胚,置于預先準備好的ddH2O中清洗2次。體視顯微鏡下將胚胎置于0.2 mL的EP管中,盡量少帶液體,控制在2 μl之內。-20 ℃保存備用。
利用廢棄的豬孤雌囊胚優化小鼠胚胎裂解方法,使其更有利于豬囊胚裂解。
解凍的胚胎,10 000 r/min離心30 s,加入配置好的裂解液(3 μl天根蛋白酶K+ 2 μl 1 % tween 20 + 2 μl 1 % triton 100 + 3 μl ddH2O,漩渦混勻)1.5 μl,再10 000 r/min離心30 s,室溫放置10 min。然后將裂解胚胎的PCR管放入PCR儀,56 ℃ 15 min ,95 ℃ 5 min,4 ℃ 30 s,完成細胞DNA徹底釋放。
1.4.7 豬囊胚的巢式PCR擴增及電泳檢測 囊胚裂解后,開始巢式第1次PCR擴增,反應體系為Primix (天根) 12.5 μl,外引物各0.5 μl,裂解所得DNA 3 μl,ddH2O 8.5 μl,共計25 μl。反應條件為:95 ℃ 3 min,95 ℃ 20 s,60 ℃ 20 s,72 ℃ 50 s,25個循環,72 ℃ 5 min,4 ℃無窮。繼續進行第2次PCR擴增,反應體系為Primix(天根)12.5 μl,內引物F、R各0.5 μl,外側PCR反應產物 0.5 μl,補 ddH2O 至25 μl。反應條件為95 ℃ 3 min,95 ℃ 20 s,62 ℃ 20 s,72 ℃ 50 s,30個循環,72 ℃ 5 min,4 ℃ 終止。2.0 %瓊脂糖凝膠電泳檢測結果。
1.4.8 PCR擴增產物片段掃描 巢式PCR擴增結果經瓊脂糖電泳檢測后,送往Thermofisher Scientific(中國)有限公司進行片段大小掃描。
2 結果與分析
2.1 基因組擴增
利用豬耳組織基因組DNA驗證本實驗設計的AMEL 基因的巢式內、外引物,經過摸索確定兩對引物的最優退火溫度,獲得特異性較好的擴增結果(圖1), 其中,擴增片段大小與預期大小一致,外引物擴增大小約為530 bp,內引物擴增大小約為170 bp。
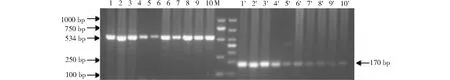
1~10 外引物擴增條帶;1′~10′為內引物擴增條帶;M:DL20001-10:Amplified bands on external primers; 1′-10′: Amplified bands on inner primers; M: DL2000圖1 豬基因組AMEL基因內、外引物的PCR 擴增Fig.1 Porcine genemic DNA sex identification by external primer and inner primer of AMEL gene PCR
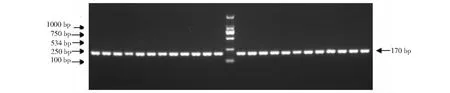
圖2 豬胚胎巢式PCR的擴增結果Fig.2 Sex determination based on the amplification of porcine AMEL gene by nested PCR

圖3 AMEL基因巢式擴增產物的掃描Fig.3 Electropherogram traces obtained on an automatic sequencer
2.2 豬囊胚巢式PCR擴增
本試驗分多批次共收集了205個豬ICSI早期囊胚,按照上述的方法對囊胚進行了裂解和巢式PCR擴增。結果特異性擴增了199個ICSI樣品,6個擴增失敗(圖2)。
2.3 巢式PCR片段的掃描
PCR擴增產物經瓊脂糖檢測后,做好標記。送至Thermofisher Scientific公司進行熒光標記—半自動基因組掃描。根據目的片段區域掃描主峰的多少判定胚胎性別,標準如下(圖3),因雌性胚胎只存在AMELx等位基因,在178~179 bp處出現1個主峰,而雄性胚胎包含有AMELx和AMELy2個等位基因,在169~171和178~179 bp處出現了2個主峰。本試驗通過分析共判定雄性胚胎71個,雌性胚胎128個,公母比例1∶1.8,偏離了1∶1。
2.4 雄性胚胎PCR產物的直接測序
為驗證PCR產物掃描結果的可靠性,挑選了2個雄性胚胎的PCR產物進行直接測序,測序結果如圖 4。上部分是AMELx和AMELy基因序列的比對圖,下半部分是豬雄性PCR擴增產物直接測序結果圖,并在圖中標識出缺失起始位點和缺失序列,從缺失第1個位點開始,DNA測序峰圖大部分單堿基位點出現2個峰。
3 討 論
相對于其它畜禽物種,豬精液冷凍、胚胎冷凍和體外受精技術都不是很成熟,特別是體外受精時,多精受精現象很顯著。加上其手術法的胚胎移植,限制了豬胚胎體外生產的應用,也使得豬胚胎性別鑒定研究較少。以前的研究多是基于SRY基因、AMEL基因和Y染色體上的重復序列SUSYb的常規PCR擴增,因胚胎細胞數較少,循環數一般都在40次以上[23]。隨著循環數的增加,DNA聚合酶的活性和擴增效率明顯降低,非特異性擴增產物增加[22, 24, 26]。而巢式PCR則是利用2對引物經2次PCR擴增目的片段的方法,第2次擴增是以第1次PCR擴增產物為模板,其引物結合到第1次PCR產物序列的內部,再加入Taq酶進行再次PCR反應,該方法既增加了模板量又保證了Taq酶的活性,如果第1次擴增發生了錯誤片段,則第2次能在錯誤片段上形成引物配對并擴增的概率很低,基本上不會出現非特異性片段。因此巢式PCR的特異性、靈敏度,準確度都很高。最具有代表性的例子是Colley等[27]對牛單個精子進行巢式PCR擴增,可以獲得清晰理想的鑒定結果。
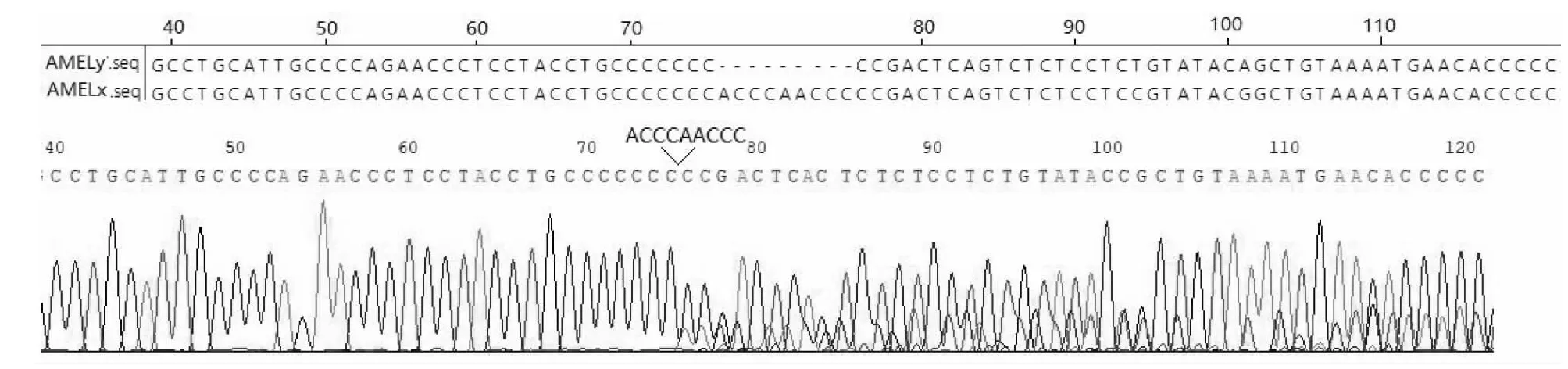
圖4 豬雄性胚胎AMEL基因的PCR產物直接測序Fig.4 Sequence of the production of PCR on AMEL gene of porcine male embryo
牙釉質基因(AMEL)是負責牙釉質發育的一類細胞外基質蛋白家族基因,在大部分哺乳動物中,該基因位于X染色體(AMELx)和Y染色體(AMELy)上,屬于X、Y同源基因。人、豬、牛、馬、羊、黑熊、狗、鹿等動物的AMEL編碼基因在X、Y染色體均有定位,并存在不同程度的堿基缺失,可作為哺乳動物性別鑒定的目標基因。而在鼠類,AMEL基因僅存在于X染色體[31],單孔類、有袋類動物的AMEL基因則位于常染色體上[32],因此,AMEL基因不能用來開展這幾類動物的性別鑒定。雖然已成功利用AMEL基因開展了部分動物的性別鑒定,但基于AMEL基因的豬性別鑒定,因相差9 bp的缺失,瓊脂糖凝膠不能分型,必須用聚丙烯酰胺凝膠檢測,增加了工作量和成本。本實驗利用巢式PCR擴增并結合熒光標記的半自動基因組掃描技術對相差9 bp缺失的豬AMELX/Y基因進行分型,分型的過程簡便、快捷、靈敏度高。該方法不失為一種有效的豬微量基因性別鑒定的方法。
卵胞漿內單精子顯微注射技術(ICSI)是借助顯微操作系統將單一精子注射入卵子細胞質內并使其受精的一種輔助生殖技術。從第一例倉鼠ICSI后代成功報道以來,該技術已先后被用于兔子、貓、牛、小鼠、羊、馬、豬、猴子和人等動物。特別是人類,該技術已成為男性不育的救星被廣泛應用。有關研究證實,不同哺乳動物的卵母細胞對ICSI操作的應答不同[33]。人、小鼠和兔子的ICSI操作足以激活其卵母細胞,促成精子的去凝聚和雄性原核的形成,而豬和牛的ICSI操作則不能有效地激活卵母細胞,造成精子去凝聚失敗,需在ICSI之后執行額外的激活操作激活卵母細胞,促進雄性原核的形成,這一激活操作不可避免地促成了部分卵母細胞的孤雌激活。本試驗205枚豬ICSI胚胎中,雌性胚胎128枚,雄性胚胎71枚,公母比例1∶1.8,偏離1∶1。說明在雌性胚胎中存在部分孤雌胚胎。究其原因有二,一是在保證ICSI胚胎中均被注射單個精子的情況下,存在部分精子未被有效去凝聚,雄性原核未形成,額外的激活操作造成孤雌胚胎的形成,而PCR性別鑒定方法將孤雌胚胎歸為ICSI雌性胚胎;二是ICSI所用精子注射前處理可能造成精子基因組的損傷,研究證實,小鼠的卵母細胞啟動發育后,具有修復精子DNA損傷的能力[28-30],但卵母細胞可以基于自己的X染色體序列修復精子X染色體上基因的損傷,卻無法修復Y精子染色體上的基因損傷,有可能造成Y ICSI胚胎比例下降。這需要探求一些新的方法去區分雌性胚胎和孤雌胚胎,及完善精子前處理方法,確保ICSI胚胎性別鑒定的準確性和維持正常的性別比例。
4 結 論
基于豬AMELx、AMELy基因內含子3中9~10 bp的序列缺失,利用巢式PCR方法—熒光標記半自動基因掃描技術鑒定豬胚胎性別是可行的。

