PCR-芯片雜交法CYP2C9和VKORC1基因多態性檢測系統的性能驗證
劉志云,范軍秀,姚利飛,彭衛,王偉,鄧茂林
(上海市東方醫院吉安醫院檢驗科,吉安 343000)
近年來,質量控制越來越受到醫學實驗室的重視,根據醫學實驗室能力認可(ISO15189)和美國病理協會(CAP)的要求,任何一個用于常規檢測的新系統或新項目在使用前必須進行性能驗證[1,2]。隨著分子生物學和精準醫學廣泛用于臨床,藥物基因檢測是本科室開展的重要檢測項目,其檢測系統的性能驗證是保證其檢測質量的重要環節,根據 《CNAS-CL36醫學實驗室質量和能力認可準則在分子診斷領域的應用說明》[3]使用PCR-芯片雜交法對上海百傲生物科技有限公司生產的人類CYP2C9&VKORC1基因多態性檢測試劑盒準確性、特異性、最低檢測限和抗干擾能力進行驗證,驗證結果如下:
1 對象與方法
1.1 研究對象 選取上海市東方醫院吉安醫院2017年12月-2018年6月臨床擬用華法林但未使用任何溶栓藥物治療的53例患者,其中男33例,女 20 例,平均年齡(63.5±5.3)歲,臨床診斷明確。所有就診者無家族病遺傳史,無血緣關系。
1.2 主要試劑和儀器 全自動核酸提取儀 (湖南圣湘生物科技有限公司);人類CYP2C9&VKORC1基因多態性檢測試劑盒(PCR-芯片雜交法,上海百傲生物科技有限公司)。抗干擾物物質膽紅素(上海源葉生物有限公司;批號:20120322);抗干擾物物質膽固醇(上海將來實業有限限公司;批號:136036);抗干擾物物質甘油三酯 (上海將來實業有限限公司;批號:118624)。羅氏Cobas z 480 PCR擴增儀,Baio全自動雜交儀 (上海百傲生物科技有限公司),Baio BE-3.0生物芯片識讀儀 (上海百傲生物科技有限公司)。
1.3 DNA的提取和擴增 采集所有研究對象靜脈血 2ml(EDTA-K2 抗凝,4℃保存),用全自動核酸提取儀提取外周血DNA及純化,置-20℃保存備用。按照上海百傲生物科技有限公司生產的人類CYP2C9&VKORC1基因檢測試劑盒的要求對代謝基因CYP2C9(*2C430T、*3A1075C)及受體基因VKORC1(G1639A)進行檢測,同時使用試劑盒自帶的質控品做陰陽性對照。使用羅氏Cobas z 480擴增儀進行擴增,使用百傲基因芯片雜交儀進行芯片雜交,使用百傲BE-3.0芯片識讀儀及其相應軟件對雜交好的芯片進行識讀并對數據進行分析。
2 結果
2.1 準確性 隨機選取20例擬用華法林藥物的患者臨床樣本,按照人類CYP2C9&VKORC1基因多態性檢測試劑說明書的要求進行PCR-芯片雜交檢測,判斷其人類CYP2C9&VKORC1基因型,并將提取好的核酸樣本送至華大基因生物公司行雙向測序,兩方法學間結果比對符合率≥90%即正確度驗證通過。本實驗20例臨床標本使用PCR-芯片雜交法和雙向測序比對結果符合率為100%,即本實驗正確度驗證通過。見表1。

表1 PCR-芯片雜交法和雙向測序法準確性結果標比對表
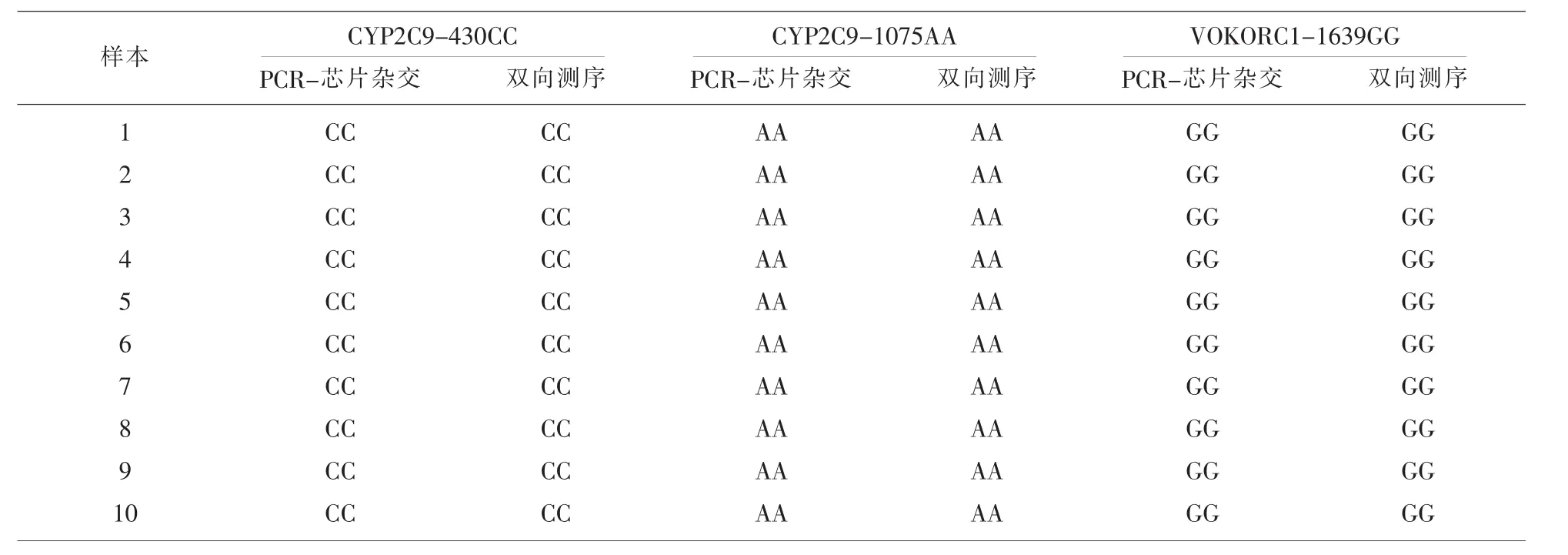
表2 PCR-芯片雜交法和雙向測序法特異性結果標比對表
2.2 特異性 按照人類CYP2C9&VKORC1基因檢測試劑盒說明書要求,分別選取10例CYP2C9-430、CYP2C9-1075及VKORC1-1639野生型的基因(準確度驗證時通過雙向測序確定)共30例進行PCR-芯片雜交,檢測其基因位點,并送至華大基因生物公司進行雙向測序,每個野生型基因在兩方法學間的比對結果符合率≥90%即特異度驗證通過。30例標本使用PCR-芯片雜交法檢測的3個野生型基因結果及其測序結果均為野生型,兩方法學結果比對符合率為100%,本實驗特異度驗證通過。見表2。
2.3 最低檢出限 選取1例核酸濃度為25ng/μl、其基因型為CYP2C9*1/*2(*2CT/*3AA)&VKORC1-1639AA的臨床基因組DNA,用BE洗脫液倍比稀釋為 12.5ng/μl、6.25ng/μl、3.125ng/μl、1.563ng/μl及 0.78ng/μl。 選 擇 3.125ng/μl、1.563ng/μl 及 0.78ng/μl 3個濃度使用PCR-芯片法重復各檢測20次,按照各濃度標本的檢測結果與稀釋前結果比對的符合率≥85%為有效濃度,該最低有濃度為該檢測體系的檢測下限。選擇的3個濃度中3.125ng/μl、1.563ng/μl兩濃度的檢測結果與稀釋前的基因型一致,符合率為100%,而濃度為0.78ng/μl標本的檢查結果與稀釋前的符合率只有30%,故該濃度應該剔除。故本實驗的檢測下限為1.563ng/μl。
2.4 抗干擾能力 取3例已知基因型的臨床標本,基因型分別為 CYP2C9*1/*1(*2CC/*3AA)&VKORC1-1639AA,CYP2C9*1/*3(*2CC/*3AC)&VKORC1-1639AA,CYP2C9*1/*2(*2CT/*3AA)&VKORC1-1639AA。每例標本分為10份,每份200μl,其中1份不添加任何干擾物,設為對照組,其余9份平均分為3組,每組分別加入甘油三酯、總膽固醇、總膽紅素,配制成濃度分別為47mmol/L、65mmol/L和34.2mmol/L的待檢標本。實驗組與對照組檢測結果之間的符合率≥90%即抗該物質干擾驗證通過。按照血液基因組DNA提取的方法提取上述樣本血液基因組DNA,然后用CYP2C9和VKORC1基因多態性檢測試劑盒按照說明書方法測定上述3個基因型,每個樣本檢測2次,結果表明加入甘油三酯、總膽固醇和總膽紅素標本的基因型與對照組完全符合,符合率為100%,本實驗抗干擾驗證通過。
3 討論
CYP2C9是細胞色素P450酶(CYP)第二亞家族中的重要成員,占肝微粒體P450蛋白總量的20%。CYP2C9參與抗凝血藥、抗驚厥藥、降糖藥、非甾體類解熱鎮痛抗炎藥、抗高血壓藥以及利尿藥等多種藥物的羥化代謝,其中華法林、甲苯磺丁脲和苯妥因那均為治療指數較窄的藥物[4-8]。CYP2C9活性變化可導致這些藥物體內濃度出現較大變化,甚至導致嚴重藥物不良反應的發生。華法林是臨床上常用的抗凝藥物,是深靜脈血栓、心房纖顫、心臟瓣膜置換術和肺栓塞等疾病的一線用藥,其臨床療效和不良反應存在很大的個體差異,血藥濃度過高或敏感性增加可導致嚴重出血事件[9-11]。心腦血管疾病已成為嚴重危害我國國民健康、特別是中老年人的一種常見病,具有高患病率、高致殘率,高死亡率的特點,其發病率位居我國首位。相關資料表明,目前,我國有超過2.9億心血管疾病的患者,每年因心血管疾病死亡的人數達300萬[12],因此,對心血管疾病患者進行合理用藥,延長患者的生存質量,越來越受到臨床重視。
近年來的,越來越多的藥物基因檢測技術用于臨床用藥指導。根據美國《臨床實驗室改進法修正案》和實驗室認可的要求,實驗室在開展常規檢測項目之前,必需對重現其試劑說明書提供性能指標[13]。本研究參照《CNAS-CL36醫學實驗室質量和能力認可準則在分子診斷領域的應用說明》和江西省臨床基因擴增實驗室質量管理的相關規定,參考試劑說明書,結合實驗的實際情況對準確度、特異性、最低檢出限和抗干擾能力分析性能進行驗證。
準確性是指試驗中真陽性結果判斷為陽性的比例。本試驗通過PCR-芯片雜交法檢測20例臨床樣本,同時將提取好的核酸送至華大基因生物公司進行雙向測序,將兩者結果進行實驗間的比對,本研究檢測的結果與華大基因的測序結果完全符合,表明準確性符合廠商宣稱的要求,驗證通過。
特異性是指試驗中真陰性結果判斷為陰性的比例。對于基因突變檢測定性項目,將PCR-芯片雜交法檢測的野生型基因組DNA進行測序,如測序結果也為野生型則判為真陰性。本次試驗中將10例CYP2C9&VKORC1野生型基因位點進行測序,結果均為野生型,與PCR-芯片雜交法檢測的結果一致,證明了本試劑盒的特異性良好,本次實驗因標本量不多,在今后的工作中隨著檢測標本量的增多,可完善對特異性性能的評估。
最低檢出限是指檢測系統和檢測試劑的確定被分析物的最低濃度或量,是定性檢測項目的一個重要的分析性能。本次性能驗證中,將提取純化好的基因組DNA稀釋倍比稀釋至1.56ng/μl,對稀釋最低陽性檢測標本重復檢測20次的結果與未稀釋前的結果完全一致,證明本次性能驗證的最低檢出限能比試劑廠家聲明的最低檢出限更低。
抗干擾能力是指檢測結果不受標本中黃疸、脂血和溶血現象影響的能力。本次研究中,分為3組,分別加入甘油三油、膽固醇、總膽紅素,配制成濃度分別為47mmol/L甘油三酯、65mmol/L膽固醇和34.2mmol/L總膽紅素的待檢標本,這三個均為試劑說明書表明的最高濃度,每組檢測3次,進行驗證,驗證結果與對照結果完全符合,表明試劑的抗干擾能力良好。在實際檢測過程中,標本的還可能存在其它的干擾物質如嗜異性抗體的干擾,有條件的實驗室可進行更多的抗干擾能力的驗證。
綜上所述,對一個新的檢測系統或項目進行性能驗證,是保證檢測質量的基礎。本研究參照ISO15189和 CL36文件的相關要求對CYP2C9&VKORC1基因檢測試劑盒說明書進行相關性能指標驗證,其目的在保證項目驗收的基礎上,保證檢測結果的準確性,從而為臨床提供可靠的檢測結果,更好的為患者服務。

