利用紅外光譜與原子力顯微技術揭示納米級大豆肽結構及其與溶解性的關系
,, ,*,,曉婉, ,
(1.哈爾濱商業大學食品工程學院,黑龍江省食品科學與工程重點實驗室,黑龍江哈爾濱 150076;2.東北林業大學林學院,黑龍江哈爾濱 150040;3.黑龍江正大實業有限公司,黑龍江哈爾濱 150001)
蛋白質的溶解性是蛋白質固有的性質,對其應用有著重要的影響,如果經加工處理后蛋白質的水溶性降低,則它的乳化性、起泡性等其他性質也將有不同程度的下降。天然態大豆蛋白,主要構成為球蛋白,這種蛋白質分子非極性基團朝向分子內部,形成疏水鍵;極性基團位于分子內部的,相互作用形成氫鍵和鹽鍵,朝向分子表面的,可與極性水分子相互作用[1]。大豆蛋白這種結構使其易溶于水,在pH7.0的環境下大豆蛋白溶解度可達到90%以上。但是大豆蛋白經加熱等加工處理后,因變形使其溶解度下降,嚴重影響到大豆蛋白功能特性發揮,降低大豆蛋白利用價值[2]。對蛋白質分子進行修飾改性能顯著提高大豆蛋白溶解性,改善大豆蛋白功能特性[3]。
經過研究發現限制性酶解生成大豆肽具有良好溶解性,在等電點附近都能呈現較好溶解性。Sara等[4]用菠蘿蛋白酶對大豆蛋白進行改性,溶解度顯著提高。采用中性蛋白酶改性大豆蛋白,也能提高其溶解度。Walsh等[5]對大豆蛋白采用Alcalase蛋白酶進行限制性水解,試驗結果得出其溶解度在pH3~5條件下明顯提高。孫煥[6]利用兩種酶水解大豆分離蛋白,顯著增大其溶解性。
本研究采用胃蛋白酶對大豆分離蛋白(Soybean protein isolate,SPI)進行酶法水解,利用傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FT-IR)和原子力顯微鏡(Atomic force microscope,AFM)對蛋白質的二級結構含量變進行分析,從而揭示SP二級結構含量及形態結構與溶解度的關系。為制備高溶解性氨基酸飲品的應用提供方法和理論指導。
1 材料與方法
1.1 材料與儀器
SPI 遼寧阜新市維遠蛋白科技有限公司;胃蛋白酶(3000 U/g) 上海紫一試劑廠;NaOH、HCl 分析純,天津市大陸化學試劑有限公司。
Nicolet 6700型傅里葉紅外光譜儀 天津港東科技發展有限公司;F-7000型原子力顯微鏡 HITACHI公司;G1-21M型高速離心機 上海安亭科技儀器廠;LGJ-10型真空冷凍干燥機 北京松源華興科技發展有限公司。
1.2 實驗方法
1.2.1 SP的制備 稱取SPI加入蒸餾水配制成濃度5%(w∶v)的懸濁液,再置于90 ℃水浴熱處理15 min,冷卻至室溫后,用0.1 mol/L HCl將溶液pH調至2.0,按照加酶量120 U/g加入胃蛋白酶,攪拌均勻后置于35 ℃恒溫水浴鍋中保持24 h,再升溫至90 ℃保溫15 min滅酶,冷卻后,用0.1 mol/L HCl或NaOH調節pH至4.5,將酶解液經4000 r/min離心15 min后取上清液,進行噴霧干燥,得到大豆肽粉末。
1.2.2 紅外光譜定量分析 將SP和SPI置于干燥器內充分干燥,準確稱取0.1 g,將SP和SPI放在樣品臺的衰減全反射技術(Attenuated total reflection,ATR)附件上,調節壓力塔至合適位置,進行測試。吸收光譜的波數范圍選擇450~4000 cm-1,分辨率4 cm-1,波數精度0.01 cm-1,經32次掃描,環境溫度設為25 ℃[7]。
1.2.3 原子力顯微鏡分析 將SP和SPI樣品分別溶于去離子水中,配制濃度為100 μg/L的溶液,取一滴蛋白溶液分散于新剝離干凈的云母片上,室溫下自然晾干,原子力顯微鏡測量條件如下:采用敲擊式AFM進行測量,使用Nanoscope軟件對AFM圖像對SP和SPI的表面的形貌圖和相位圖進行分析和處理[8]。
1.2.4 溶解性測定 參照Qi的方法[9],略有改動。先配制2%(w∶v)的SP或SPI溶液,再進行磁力攪拌1 h,然后在4500 r/min離心10 min,采用凱氏定氮法,測定上清液中的氮含量,根據公式(1)測定計算樣品的溶解性。

式(1)
1.3 數據處理
采用Microsft Office Excel 2003軟件對數據進行處理和繪圖,結果表示為平均值±標準偏差(n=3)形式,采用SPSS軟件中單因素ANOVA對數據進行顯著性分析,顯著性水平設定為p<0.05。本文利用Peak Fit 4.12軟件對酰胺I帶1700~1600 cm-1波段的圖譜進行分析。
2 結果與討論
2.1 紅外光譜定量分析
通過紅外定量分析,討論SPI和SP的二級結構中α-螺旋、β-折疊、β-轉角和無規則卷曲結構含量的差異,由紅外光譜定量處理所得到的數據擬合結果如圖1所示。

圖1 SPI及SP的定量分析FT-IR光譜圖Fig.1 Qualitative analysis of SPIand SP by FT-IR SPectra
本文主要分析在450~4000 cm-1的波數范圍的透光率,其中包含蛋白質構象變化最重要的兩個區域,即酰胺I和酰胺III區域。在蛋白質的二級結構分析中酰胺I帶相對來說更具有價值[10],為準確得到SPI和SP的二級結構各組分含量的變化,得到結果如圖2所示。
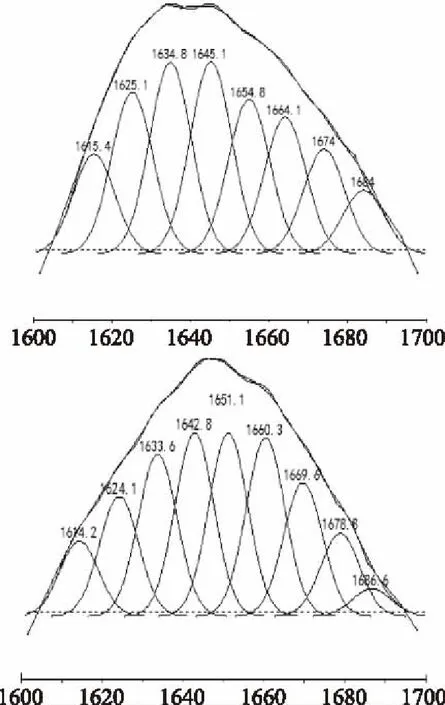
圖2 SPI和SP酰胺I帶擬合結果Fig.2 Result of SPI and SP fitting use of the amide I
酰胺I帶各子峰與二級結構對應關系為:1640~1618 cm-1和1690~1670 cm-1為β-折疊;1660~1650 cm-1為α-螺旋;1650~1640 cm-1,為無規則卷曲;1700~1660 cm-1為β-轉角[11]。根據圖2確定各子峰與不同二級結構對應關系,由其積分面積計算各二級結構的相對百分含量,酰胺I帶二級結構擬合結果如表1所示。
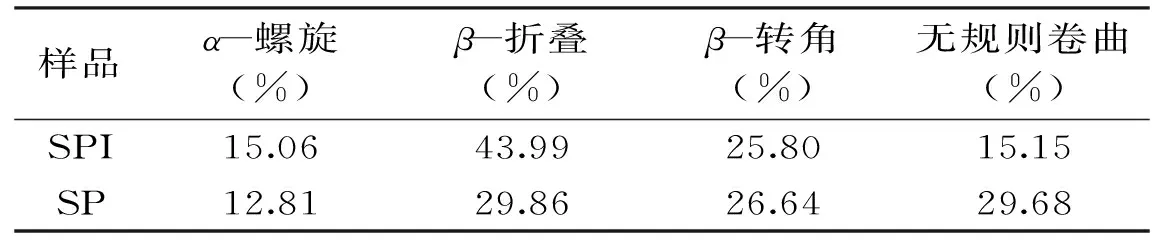
表1 SPI及SP的酰胺I帶擬合二級結構結果Table 1 Result of the secondary structure of SPI and SP with a fitting use of the amide I
由表1可知,與SPI相比,SP的有序結構α-螺旋和β-折疊結構含量分別降低了2.25%和14.13%,而無序結構的β-轉角和無規則卷曲含量分別提高了0.84%和14.53%,證明胃蛋白酶水解SPI得到SP的過程為有序結構向無序結構轉化過程。已有研究得到類似結論,如Zhao等[12]利用Alcalase酶水解SPI得到SP,發現SP比SPI的有序結構含量低5.00%,無序結構含量高6.00%。由表1發現,SPI二級結構主要是以β-折疊結構為主,其含量為43.99%,而SP的β-折疊結構含量比SPI低14.13%。有研究發現蛋白質中β-折疊是由肽鏈上連續存在許多疏水性殘基形成的肽鏈間平行的氫鍵締合結構,所以β-折疊在結構中存在大量的氫鍵使肽鏈之間緊緊地聚集在一起[13],同時疏水鍵也增加,導致β-折疊結構所占蛋白結構含量高的蛋白質溶解度低[14]。SP比SPI中β-折疊結構在整體二級結構中占的比例小,氫鍵含量低,疏水性殘基含量低,導致SP的溶解性越高。SP的β-轉角結構含量比SPI含量高0.84%,有研究發現親水性氨基酸增加會導致β-轉角結構增加[15],因此SP側鏈的親水氨基酸殘基暴露比SPI的高,其溶解性較優于SPI。
雖然SPI的主要結構為β-折疊結構,并不能證明SPI為全β-蛋白折疊結構,由于SPI的β-折疊含量大于40.00%,α-螺旋含量也大于5.00%,所以不屬于全β-蛋白結構,SPI的α-螺旋含量大于15.00%,且β-折疊含量大于15.00%,所以SPI為α,β-蛋白結構,而SP是以無規則卷曲和β-折疊的含量為主的蛋白結構,其中無規則卷曲結構氫鍵比有序結構的少,使蛋白質分子展開,空間結構松散[16],埋在蛋白質分子內的極性氨基酸基團暴露在蛋白質分子的表面,與水分子通過氫鍵和靜電力相互作用,導致蛋白質溶解度增加[17]。
2.2 原子力掃描電鏡分析
原子力掃描電鏡是一種能在空氣環境中觀察蛋白形貌的有效手段,是間接觀察到蛋白是分散和聚集形式的儀器[18]。用Nanoscope軟件分析得到SPI和SP高度圖和相位圖,如圖3所示。
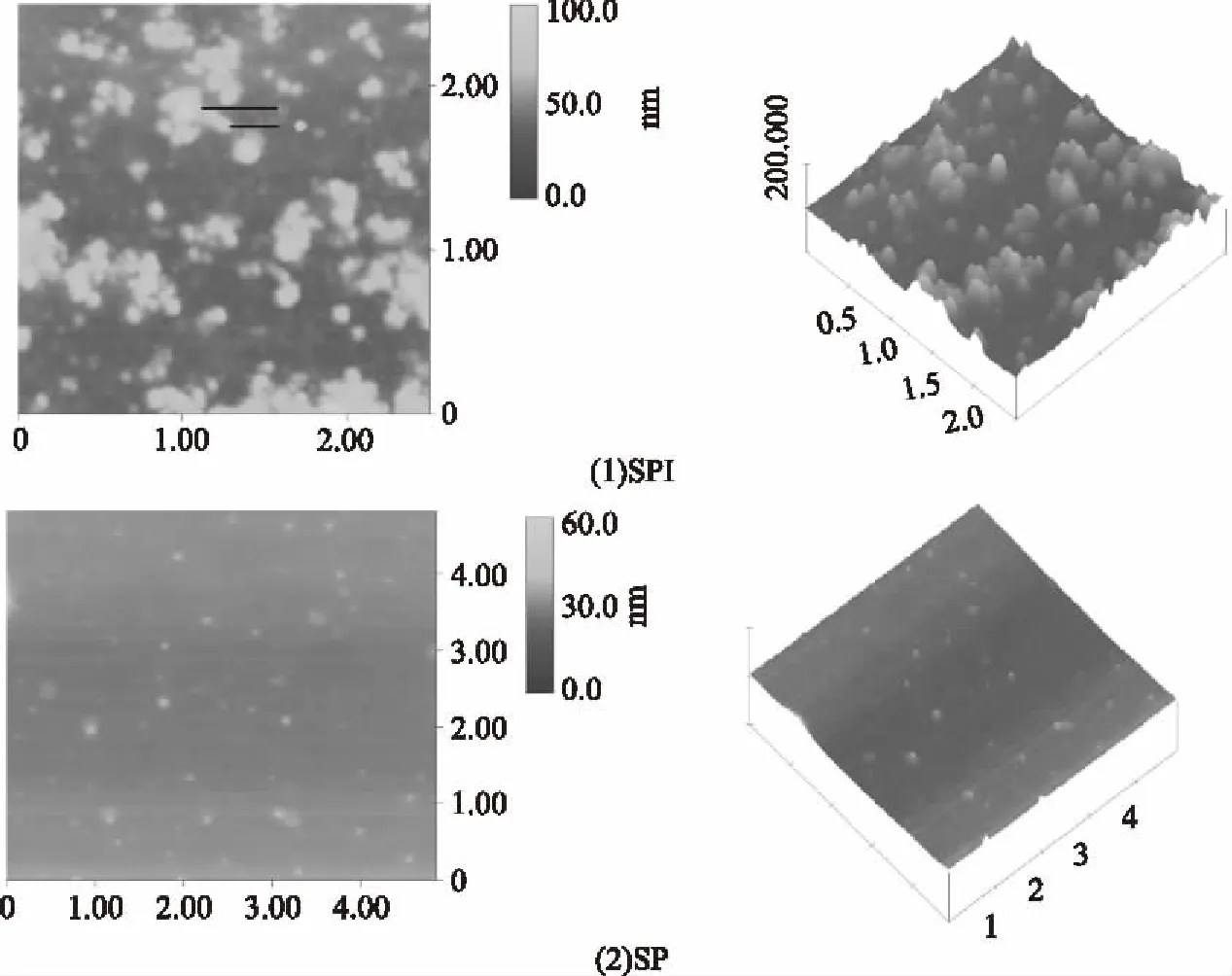
圖3 SPI和SP的原子力顯微鏡圖Fig.3 AFM Spectra of SPI and SP
由圖3可知,SPI顆粒明顯,表面不平滑,出現分子聚集現象,并呈現α亞基結構的花骨形和α′亞基或β亞基結構的蟲形[19]。而SP表面較平滑顆粒較分散,以單個分子狀態存在,未出現7S的亞基的聚集體。
利用Nanoscope軟件Section分析,SP的粒徑范圍為35.82~11.09 nm,峰和峰之間有377.1 nm,而SPI粒徑范圍為71.64~10.69 nmn,峰和峰之間有0.275 nm。SP最大粒徑僅為SPI的50%,這是因為SP比SPI內部和分子間的電荷斥力作用增加,蛋白質-蛋白質相互作用減少,由于排斥力防止聚集體的形成[20]。除了電荷斥力,研究人員還發現蛋白的分子量也是導致其粒徑變化的另一原因,通過實驗發現大豆蛋白分子量越小,其粒徑越小,如Tang等得出大豆11S球蛋白亞基分子量小于7S球蛋白亞基,導致大豆11S球蛋白亞基直徑比大豆7S球蛋白亞基小10.6 nm[21]。
2.3 溶解性的分析
蛋白的溶解性對自身其它的功能特性有直接影響,同時受條件因素的影響較大[22],SP和SPI的溶解性的不同,如圖4所示。
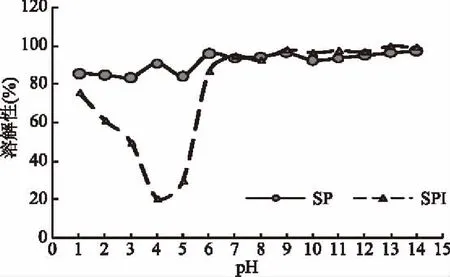
圖4 SP和SPI的溶解性Fig.4 The solubility of SP and SPI
由圖4可知,在堿性條件下SPI和SP都呈現較好的溶解性,但是在酸性條件下SPI溶解性下降。尤其是pH4.0時,SPI的溶解性僅為20.46%,而SP溶解度為90.64%,這是因為在蛋白質等電點附近,SPI解離成陽離子和陰離子的趨勢或程度相等,成為兼性離子,呈電中性,此時蛋白分子顆粒在溶液中因沒有相同電荷的相互排斥,分子相互之間的吸引作用力占主導,其顆粒極易碰撞、凝聚而產生沉淀[23]。而SP比SPI的無序結構高,氫鍵含量低,結構松散暴露導致陰陽離子多,其表面的親水基團數量遠大于疏水基團[22],且SP為酸堿兩性電解質,也因為其體積變小,離子性增強,其側鏈極性基團增加[24-25],因此不會發生沉淀。有些研究也發現SP的溶解性要優于SPI[26],如Ortiz等[27]發現SP溶解性較SPI好,SP比SPI內部和分子間的電荷斥力作用增加,蛋白質-蛋白質相互作用減少,蛋白質-水相互作用增加,排斥力增加,防止了聚集體的形成,降低蛋白質的粒徑,從而增加溶解性。郭麗[28]利用Alcalase蛋白酶水解大豆β-伴球蛋白獲得SP,發現在pH2.0~8.0范圍內,SP具有良好的溶解性,SP比SPI溶解性高,可能是因為含有較小的分子和新暴露的氨基和羧基基團,能與水形成較強的氫鍵,從而更易溶于水溶液[29]。SP溶解性較高可能是因為SP的無規則卷曲含量比SPI高,SP的氫鍵含量低于SPI,同時有較強靜電斥力作用導致分子間距離增加[30],導致SP分子未出現聚集。
3 結論
本實驗主要研究SPI在胃蛋白酶水解過程中二級結構和溶解性的變化,相較于SPI,SPα-螺旋和β-折疊結構遭到破壞,向β-轉角和無規則卷曲轉化。同時SP具有較好的功能性質,在pH為蛋白質等電點時,SPI溶解性為20.46%,而SP溶解度高為90.64%。原子力顯微鏡觀察時也證實了SP的粒徑小于SPI,導致溶解度越高。

