熱激活延遲熒光分子探針在生物成像中的研究進展
季宇彬,張娜,王亞麗,張青揚,胡海宇
?
熱激活延遲熒光分子探針在生物成像中的研究進展
季宇彬,張娜,王亞麗,張青揚,胡海宇
150076 哈爾濱商業大學生命科學與環境科學研究發展中心(季宇彬、張娜、王亞麗);100050 中國醫學科學院北京協和醫學院藥物研究所天然藥物活性物質與功能國家重點實驗室/活性物質發現與適藥化研究北京重點實驗室(張青揚、胡海宇)
近年來快速發展的生物熒光成像技術將熒光顯像技術與分子探針結合,對特定分子靶點和通路在組織水平、細胞和亞細胞水平進行非侵襲性顯影,實現在活體狀態下可視、無損分析和監測不同階段疾病發展,為疾病的診斷和治療開啟了一片嶄新的天地。熒光信號高特異性、高信噪比是生物熒光成像質量關鍵,然而由激發光源產生的雜散光及生物體內幾乎涵蓋整個紫外-可見光區的大量內源性熒光物質產生的熒光背景噪音干擾,嚴重影響了目標熒光信號的靈敏度及精準性,降低了成像信噪比。為提高生物成像信噪比,除了需要先進的熒光成像設備外,還需要開發新型高效的熒光探針。近年來出現的激活型智能熒光分子探針[1]、近紅外熒光探針[2]及雙光子熒光探針[3]均能在一定程度上降低背景噪音,提高信噪比,使得熒光成像更加清晰。由于生物環境的復雜性和多樣性,已有熒光探針很難避免來自生物環境自身的干擾。來自生物內源性物質自身熒光及光源雜散光的熒光信號均為短壽命熒光(納秒級),利用具有長熒光壽命性質的分子探針(微秒-毫秒級)對生物體進行時間分辨成像,在激發光和檢測窗口之間引入適當的延遲時間,可高效避免短壽命熒光背景干擾,極大地提高信噪比和成像質量[4]。由于熒光壽命是分子的固有性質,不易受外界因素干擾,開發新型長熒光壽命探針,避免背景噪音信號干擾,提高成像信噪比,成為未來熒光影像技術研究發展的重點需求。
目前應用于生物成像領域的長壽命分子探針如磷光探針,往往含有稀土金屬等貴金屬,其經濟成本居高不下,生物毒性較大[5-6]。近年來,熱激活延遲熒光(thermally activated delayed fluorescence,TADF)材料由于其最低激發單重態(S1)和最低激發三重態(T1)之間的能級差 ΔEST較小,T1態激子可以通過反向系間竄越過程(reverse intersystem crossing,RISC)上轉換到 S1態,實現了 T1態激子參與的熒光發射,大大提高了發光效率,其熒光壽命可達微秒至毫秒級(圖1A)。與磷光探針相比,此類探針為有機小分子,一般只需要 < 300 K 的溫度就能激活,不需要貴金屬及有機配體的參與,合成成本低,已在有機發光材料領域(organic light emitting diodes,OLED)得到廣泛的研究[7-8]。而此類探針熒光效率高、熒光壽命長,具有非常好的生物成像領域應用潛力。目前構建一類具有良好長熒光壽命性質的新型 TADF 熒光探針,改善其生物相容性,將為生物靶點與信號通路研究及疾病的診斷與治療提供新穎的熒光成像研究方法。
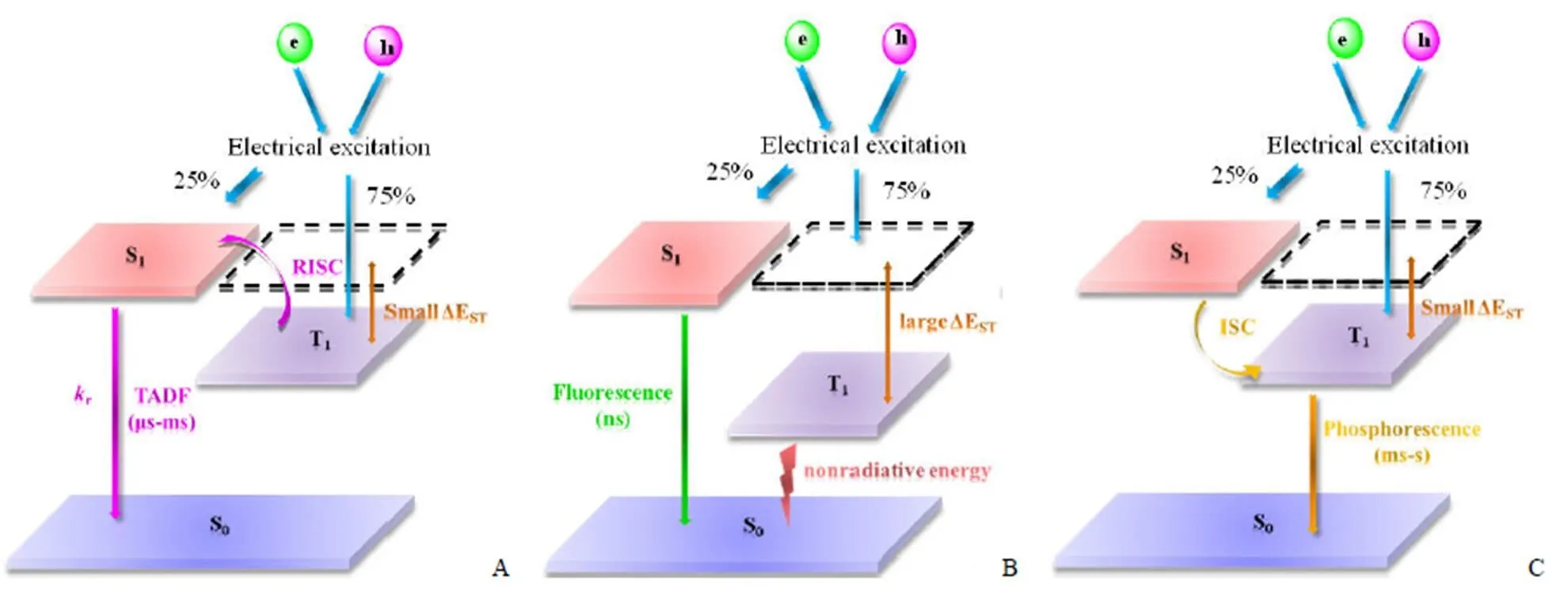
圖 1 TADF(A)、傳統熒光(B)和磷光(C)發光機制圖
1 熱激活延遲熒光的機制及分子設計策略
一般來說,傳統熒光分子是激子從 S1態輻射回到基態(S0)而產生的,此過程非常快速(納秒級),為瞬時熒光(圖1B)。1998 年,Baldo 等[9]首次報道了貴金屬及其配合物通過系間竄越(intersystem crossing,ISC),實現了在室溫下 S1態和 T1態共同參與的磷光發射,由于激子最終是由 T1態返回 S0態,其發射波長比傳統熒光更長,此過程需耗費較長時間(毫秒-秒級),為長壽命發光(圖1C)。另一方面,根據自旋統計定理,在電致激發的情況下,激子按 1:3 的比例分配到 S1態和 T1態。傳統熒光僅僅利用 25% 的 S1態激子發光,75% 的 T1態激子以非輻射形式回到 S0態,導致熱散失。因此,傳統熒光分子的內量子效率(internal quantum efficiency,IQE)僅有 25%,只有磷光分子的內量子效率理論上可以達到 100%。但磷光材料大部分包含貴金屬及有機配體,其經濟成本較高,不利于大規模生產。
1961 年,人們發現了一個具有 TADF 性質的有機小分子曙紅(Eosin)(圖2A),并將這種熒光現象命名為‘E-type’延遲熒光[10]。不同于磷光,此種延遲發光表現出與傳統熒光一致的發射波長,人們推斷這種延遲熒光也來自 S1態輻射回到 S0態。2011 年,Endo 等[11]實現了 TADF 分子研究的突破,第一次報道了純有機小分子 TADF 材料PIC-TRZ(圖2B)用于有機發光二極管(OLED)并對 TADF 有機小分子的機制作出初步闡釋。他們發現減少分子最高占據軌道(the highest occupied molecular orbital,HOMO)和最低未占據軌道(the lowest unoccupied molecular orbital,LUMO)的軌道重疊,可以減少 ΔEST。當 ΔEST足夠小(< 0.3 eV)時,分子內部發生 RISC,75% T1態激子通過吸收熱量轉換到 S1態后輻射失活產生微秒級甚至毫秒級壽命的延遲熒光[12-14],從而高效地實現 TADF 發光(圖3A)。根據此機制,人們總結出當分子呈現出一個扭曲的電子供體-受體結構(twisted electron donor-acceptor,D-A)時,分子容易具有高效的 TADF 性質(圖3B)。2012 年,Uoyama 等[15]報道了一系列基于咔唑二氰基苯(CDCB)的 TADF 材料,這一系列分子涵蓋了從藍色到橙色的多個發射波段,具有高效的發光效率。其綠色發光分子(4CzIPN,圖 2C)的外量子效率(external quantum efficiency,EQE)達到 19.3%,橙色和天藍色發光分子的 EQEs 也分別達到了 11.2% 和 8.0%。
除了相對較小的 S1態和 T1態能級差 ΔEST外,相對較大的 S1態到 S0態的輻射衰減常數r也是獲得高效 TADF 性質的必要條件。但這就要求分子的 HOMO 和 LUMO 軌道要有一定程度的重疊,顯然,較大r和較小 ΔEST之間理論上是相互矛盾的。這就要求在設計 TADF 分子時要平衡考慮r和 ΔEST,以獲得最好的結構[16-17]。具體可以通過下列方式獲得較小的 ΔEST:①位阻基團的引入,通過電子給體與電子受體部分的選擇及引入修飾基團使整個分子具有較大的空間位阻;②構建 X 型分子可以有效減少 ΔEST;③通過螺連接[18]、正交連接[19]等方式實現電子給體和電子受體的空間分離;④通過引入具有相反共振效應的原子并構建剛性平面以獲得多重共振效應的方式減小 ΔEST[20]。另一方面,可以通過以下方式獲得較大的r:①通過電子給體和電子受體部分的緊密連接,加強分子結構剛性,可以減少非輻射衰變,獲得較高的r;②增加分子 S0態的電子波函數重疊密度分布,可以提高r[21];③有效分離 HOMO 和 LUMO 能級可以使分子前線軌道產生離域,抑制輻射衰減速率的降低[22]。
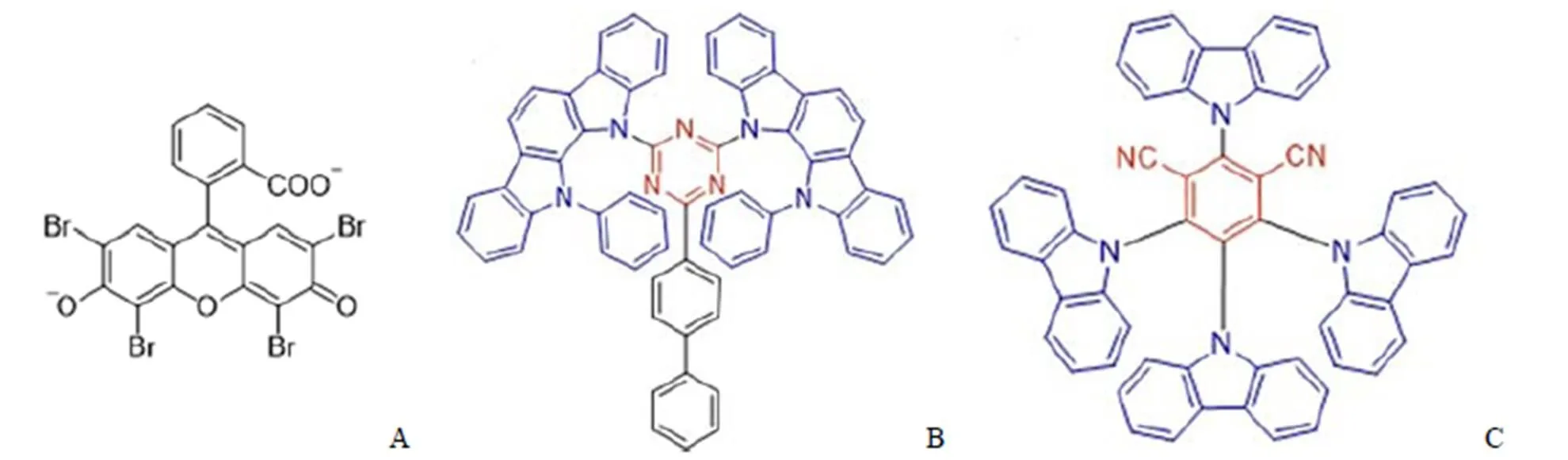
圖 2 Eosin(A)、PIC-TRZ(B)及 4CzIPN(C)的結構式(藍色部分為電子給體,紅色部分為電子受體)
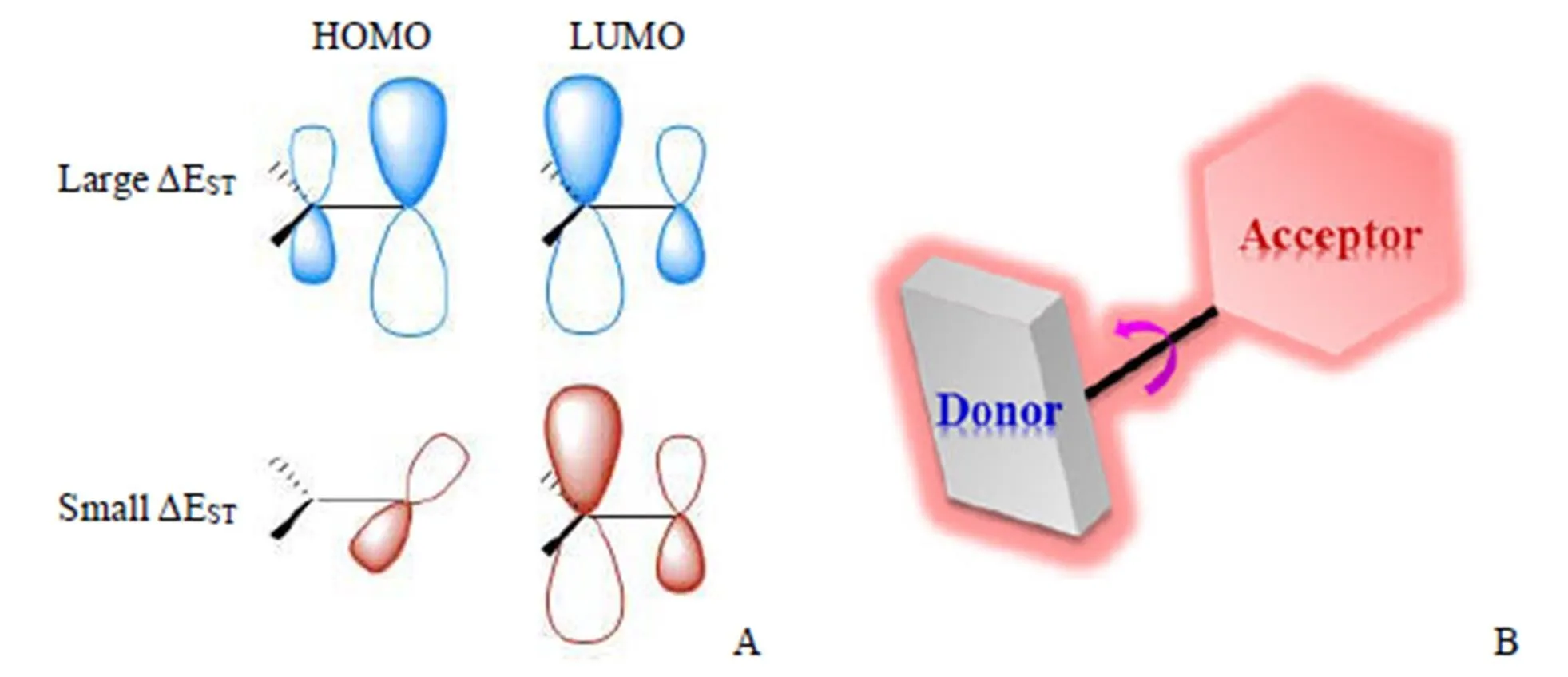
圖 3 TADF 分子中減小ΔEST的策略(A)和扭曲的電子供體-受體結構(B)
隨著越來越多的具有 TADF 性質的材料被開發并用于 OLED 材料研究中,目前已研究報道的 D-A型 TADF 材料的電子給體(donor,D)主要是具有較強的給電子能力、較高的 T1態能級、較好的穩定性等特點的芳胺結構單元,如咔唑[23]、吖啶[24]、叔丁基咔唑[25]、三苯胺[26]、吩噁嗪[27]及二氫吩嗪[28]等;而電子受體(acceptor,A)主要為含氮雜環,如 1,3,5-三嗪[29]、氰基苯[30]、二苯砜[31]、二苯并噁硼酸鹽[32]、苯并內酰亞胺[33]及萘酰亞胺[34]等(圖 4)。這些 TADF 材料具有良好的熒光量子效率,較長的熒光壽命,并因為其合成簡便,極大地降低了經濟成本。但目前的 TADF 分子 T1態激子對氧氣敏感,延遲熒光容易被單線態氧淬滅。此外,這些分子不論是電子供體部分還是電子受體部分,大部分是由親脂性基團組成的剛性分子,整個分子水溶性差,使其生物相容性較差。同時也不具有生物功能基團連接位點,因此很難應用于生物成像領域。
2 熱激活延遲熒光分子在生物成像中的應用
為了使 TADF 材料能夠應用于生物成像領域,首先需要考慮的是 TADF 分子不能被單線態氧淬滅。目前已報道了三種方式:①通過在與細胞孵育過程中加入牛血清白蛋白(bovine serum albumin,BSA),TADF分子可以進入 BSA 的疏水腔,與外界單線態氧隔絕。此外,BSA 中含有的色氨酸,可以與單線態氧反應,使其得到明顯消耗。從而在細胞成像過程中保留 TADF 分子的延遲熒光性質。此外 BSA 還可幫助分子探針滲入細胞,改善分子探針的生物相容性。②將具有 TADF 性質的分子與納米材料相結合,將其做成納米顆粒,通過外層納米材料隔絕單線態氧。而且通過這種方式改善分子的生物相容性,增大其水溶性、透膜能力及減少生物毒性。③通過分子探針自身的疏水聚集作用,保護分子本身免受氧氣的淬滅。除通過納米材料改善生物相容性外,還可以在不影響延遲熒光性質的前提下,在 TADF 分子中引入柔性鏈以改善化合物的溶解性及生物相容性,從而使 TADF 分子能夠應用于生物成像領域。
2014 年,Xiong 等[35]首次報道了有機小分子 TADF 探針 DCF-MPYM 直接應用于 MCF-7 乳腺癌細胞時間分辨成像(圖 5)。DCF-MPYM 是一種基于熒光素衍生物構建的具有長熒光壽命的、不含貴金屬的純有機熒光團化合物,其熒光壽命在去氧乙醇中可達 22.11 微秒,經過性質測定,此分子具有明顯的 TADF 特征。其具有較高熒光量子產率、較大的斯托克斯位移、較低的細胞毒性和較長的熒光壽命,在室溫狀態下就具有延遲熒光特性。但其延遲熒光性質對氧敏感,DCF-MPYM 在無氧的環境中平均壽命 22.11 微秒,在空氣中熒光壽命從 22.11 微秒降低到 4.30 微秒。體外試驗中,在分子探針中加入了 BSA,利用 BSA 的疏水腔及含有的色氨酸,隔絕及淬滅單線態氧,增強分子探針的延遲熒光性質,并利用 DCF-MPYM可以進入 BSA 的疏水腔,而對細胞中的 BSA 進行選擇性的時間分辨成像檢測,表明 DCF-MPYM 可以用作時間分辨生物成像的熒光標簽。在 MCF-7 細胞成像試驗中,BSA 不僅可以淬滅活細胞中的單線態氧,增強延遲熒光信號,還可以幫助分子探針滲入細胞,使更多的分子穿透細胞膜,改善分子探針的生物相容性。DCF-MPYM 具有明顯的 TADF 特性,實驗表明它可以作為一種新的長熒光壽命小分子探針用于活細胞成像中,以取代含有貴金屬的磷光探針。
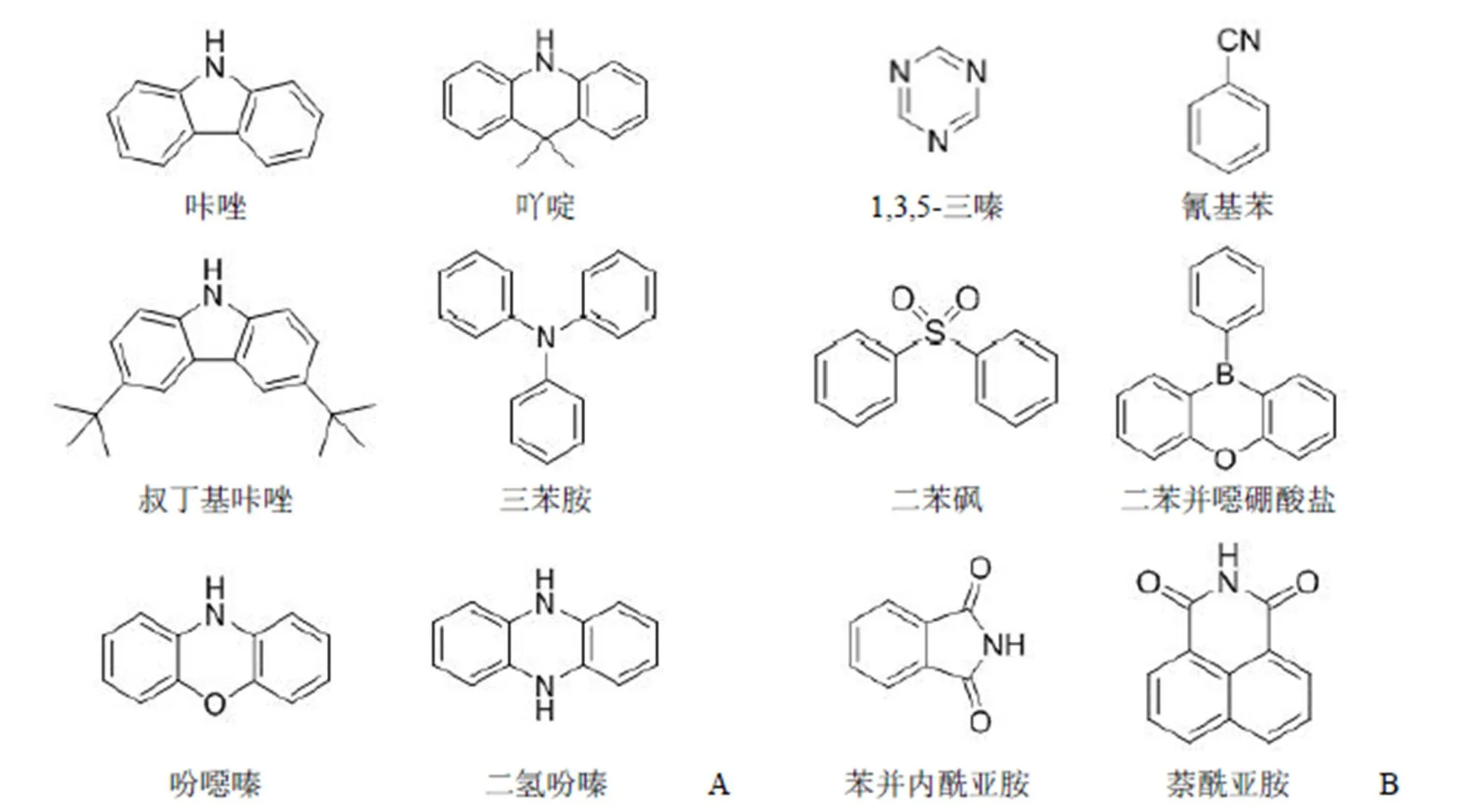
圖 4 電子給體(A)及電子受體(B)
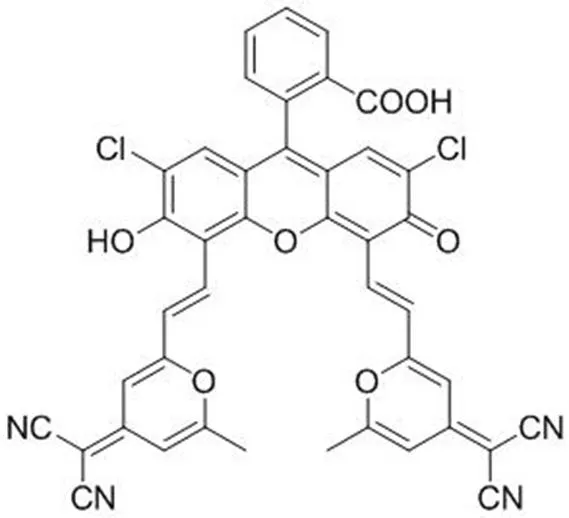
圖 5 DCF-MPYM 的分子結構
2015 年,在 DCF-MPYM 探針的基礎上又引入了兩個a,b-不飽和羰基基團,構建了用于巰基檢測的智能探針 DCF-MPYM-thiol[36](圖 6)。此探針起初由于兩個a,b-不飽和羰基基團的熒光淬滅作用并不發光,當加入半胱氨酸(Cys)后,可以脫除兩個a,b-不飽和羰基基團,暴露出 DCF-MPYM,熒光強度得到了明顯的增強。利用此探針檢測了溶液狀態下的巰基化合物,并成功用于 MCF-7 細胞時間分辨成像研究。
納米材料在水中有良好的分散性,可以改善分子的細胞吸收,提高目標分子的生物相容性。近年來,結合納米材料的探針分子在生物成像領域得到越來越廣泛的研究,2016 年,Zhang 等[37]首次利用基于具有 TADF 性質的小分子,制備了有機納米顆粒用于光動力療法(photodynamic therapy,PDT)。PDT 是一種很有前途的癌癥治療方法,具有非侵入性、高選擇性、無耐藥性等優點,且幾乎沒有副作用。在 PDT 中,光激發分子探針產生單線態氧(1O2)來殺死癌細胞。利用已有的 TADF 光學材料 2CzPN、4CzIPN及 4CzIPN-Ph(圖 7)制備了用于生成1O2的光敏劑,首次將 TADF 的概念引入 PDT 領域(圖 8)。這三個分子可以自組裝成不同的納米材料,包括納米棒(NRs)和納米顆粒(NPs),并可用于雙光子成像。這些納米材料具有良好的水中分散性、較低的細胞毒性及較強的抗光降解和光漂白能力。在1O2檢測實驗中,用對1O2敏感的 SOSG 作為傳感器,當產生1O2時,SOSG 的綠色熒光會增加。首先將 SOSG 加入到不同 TADF 納米材料的分散物中,在連續輻射光照下,熒光光譜顯示在 2CzPN、4CzIPN 及 4CzIPN-Ph NPs 分散體系中 SOSG 的熒光強度隨著輻照時間的增加而顯著增強。這些結果表明,這三種以 TADF 分子為基礎的有機納米材料具有潛在的 PDT 應用前景。
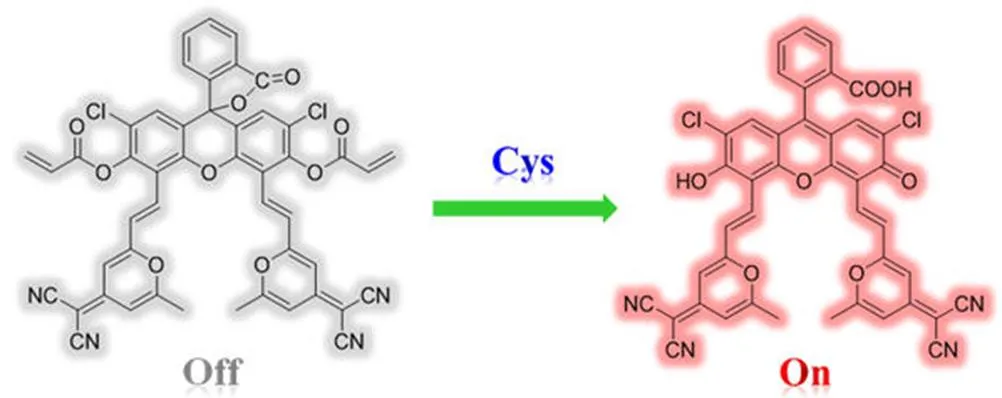
圖 6 巰基激活型 TADF 探針 DCF-MPYM-thiol
2017 年,Li 等[38]將具有 TADF 性質和聚集誘導發射增強作用(aggregation induced emission enhancement,AIEE)的有機小分子 CPy 與 DSPE-PEG2000相結合,制備了一個具有長熒光壽命的量子點探針CPy-Odots(圖 9)。其中聚乙二醇衍生物 DSPE-PEG2000作為包封基質,其具有良好的包封性能和生物相容性。有機小分子 CPy 被封裝在 DSPE-PEG2000中,由于 DSPE-PEG2000具有兩親性,CPy被疏水性 DSPE 片段包裹形成 CPy-Odots 的核,而親水性 PEG2000片段則延伸到水相中使其具有相當的水溶性。此量子點探針表現出了水溶性佳、熒光強度高(熒光量子效率可達 38.3%)、穩定性好、細胞毒性低等優點,極大改善了原有 TADF 分子 CPy 的生物相容性。重要的是 CPy-Odots 量子點探針在大氣環境中具有 9.3 微秒的長熒光壽命,這表明由于 DSPE-PEG2000的包裹作用,使 Cpy 的延遲熒光不易被單線態氧淬滅。而 HeLa 細胞熒光壽命成像結果顯示了 CPy-Odots 主要在細胞膜上有明顯的聚集,發出較強的熒光信號,其熒光壽命平均為 165 納秒。進一步,此量子點探針被用于斑馬魚活體激光共聚焦及時間分辨成像實驗中,顯示了良好的成像效果,其在斑馬魚中的熒光壽命也達到百納秒級,可以和背景信號有明顯的區分,表明了 CPy-Odot 量子點探針在活體熒光壽命成像中的應用潛力。
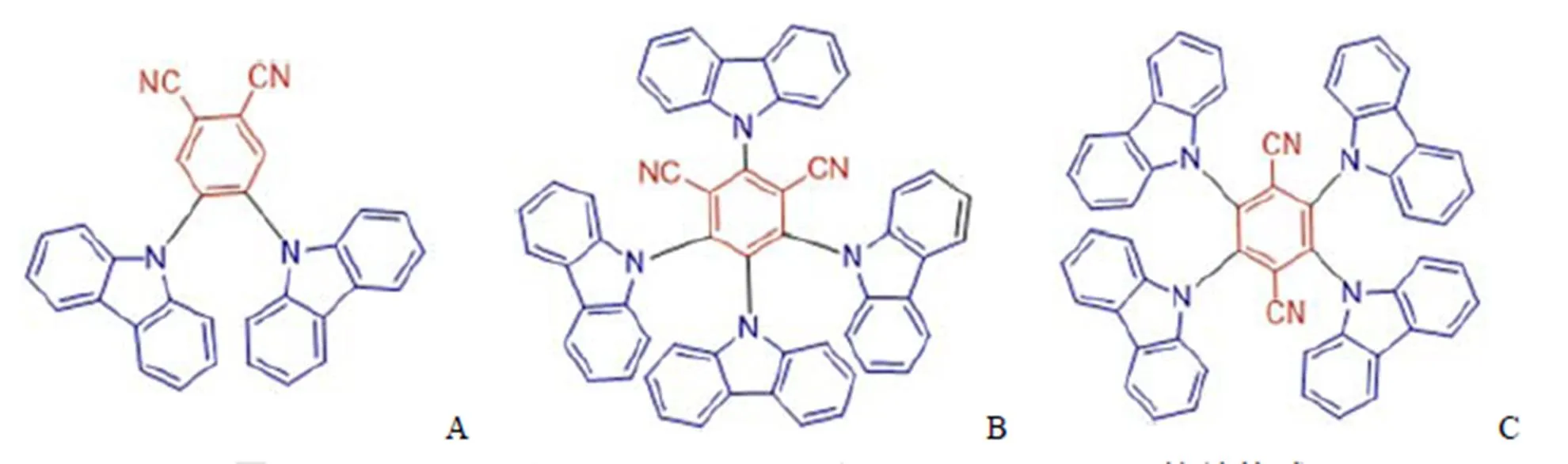
圖 7 2CzPN(A)、4CzIPN(B)及 4CzIPN-Ph(C)的結構式
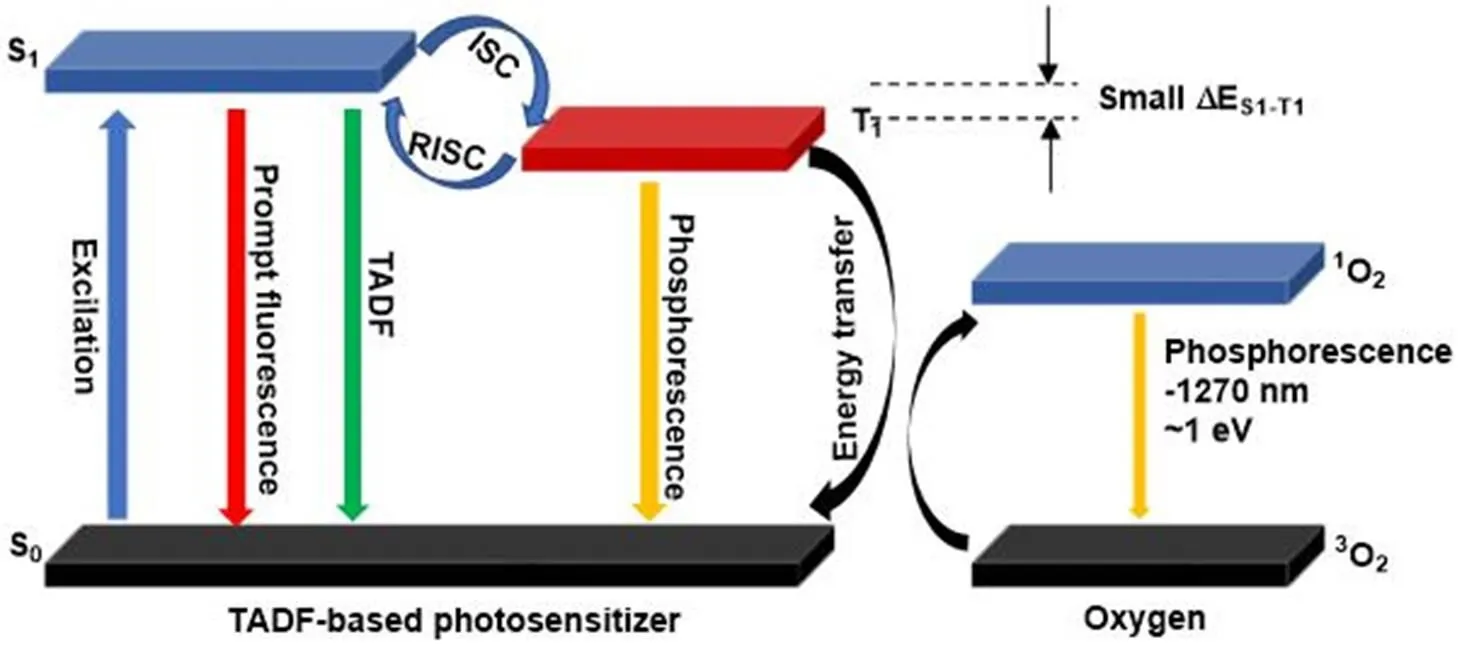
圖 8 TADF 分子1O2生成機制
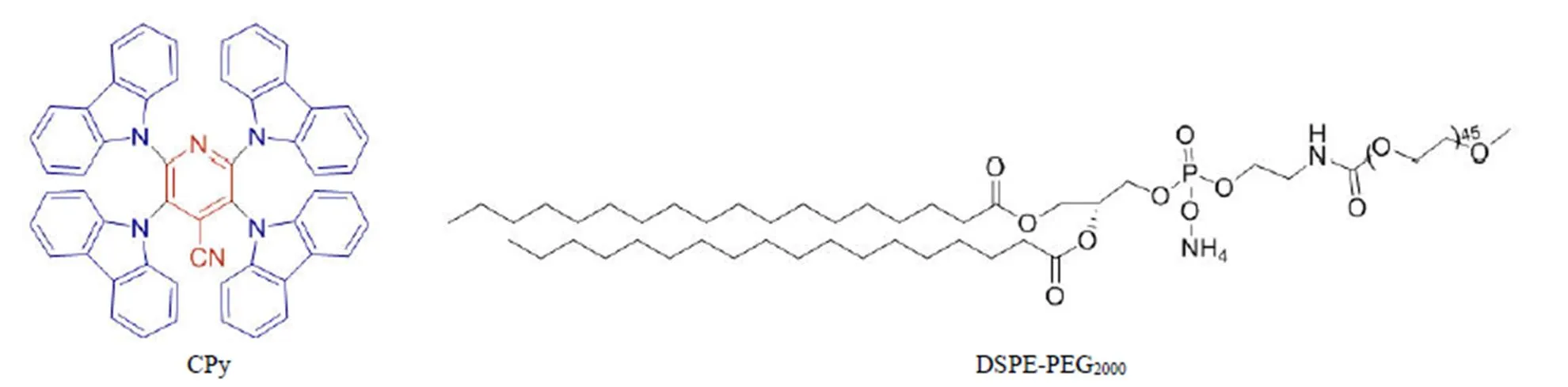
圖 9 CPy 和 DSPE-PEG2000的化學結構式
2018 年,Hu 等[39]通過納米沉淀法,將具有 TADF 性質的有機小分子 TXO 穩定封裝在 PEG--PPG--PEG 中,從而獲得了長熒光壽命的 TXO 納米粒子 TXO NPs(圖 10)。一般情況下,大部分的 TADF 分子具有水溶性差、聚集誘導淬滅等缺點,其在生物體系內熒光壽命有明顯下降。TXO 小分子不僅具有 TADF 性質,其還擁有聚集誘導發光特征(aggregation induced emission,AIE)。在乙腈/水混合溶液測定 TXO 聚集誘導發光作用實驗中,當水的比例很低時,TXO 幾乎不發熒光,而只有當水的比例達到 60% 時,才會有明顯的熒光增強。這表明 TXO 具有明顯的 AIE 效應。而隨著水占比的增加,發現 TXO 的熒光壽命也從 0.4 納秒增加到 6.3 納秒,顯示 TXO 的聚集作用不僅能夠使熒光增強,熒光壽命也進一步延長。隨后,TXO 被緊密地封裝在 PEG--PPG--PEG 中,得到納米粒子 TXO NPs。TXO NPs 是一種水溶性有機半導體納米粒子,其熒光壽命達到 4.2 微秒,幾乎是現有熒光探針的 1000 倍。其次,其具有高效的雙光子吸收,可以用于體內雙光子熒光壽命成像(TP-FLIM)。通過研究比較 TXO NPs 水溶液與空氣、氮氣或氧氣飽和度的延遲熒光壽命,得出即使持續吹入 10 min 氧氣后,其熒光壽命也幾乎保持不變。這表明 TXO NPs 具有對氧惰性特征,特別是在富氧生物體系中,這種氧惰性光學特性表明了 TXO NPs 的巨大應用潛力。TXO NPs 具有良好的光學穩定性和生物相容性,其在 HepG2 細胞的 TP-FLIM 實驗結果顯示 TXO NPs 可以很容易進入細胞并顯示明顯的紅色熒光。此外,TXO NPs 在斑馬魚體內的熒光壽命成像結果與 HepG2 細胞中的非常吻合。TXO NPs 的相對長的熒光壽命足以消除短壽命自身熒光的干擾,使其具有作為體內 TP-FLIM 造影劑的潛力。
2018 年,Ni 等[40]以三聯吡啶為電子受體,吩噁嗪(PXZ)為電子供體,通過一個苯環連接,設計合成了一種新型的 TADF 熒光團 PXZT。PXZT 不僅表現出了典型的熱激活延遲熒光性質,還具有聚集誘導延遲發光和結晶誘導室溫磷光(room temperature phosphorimetry,RTP)的特性。其中 PXZT 可以通過自身的疏水聚集作用來消除氧氣的淬滅作用,從而使其在空氣中仍然能保持 TADF 性質。PXZT 的三聯吡啶部分可以和鋅離子相互作用而形成配合物 ZnPXZT1,此配合物大大增強了整個分子的分子內電荷轉移,導致 PXZT 的熒光完全淬滅,從而降低了成像中 PXZT 本身熒光信號的干擾(圖 11)。此外,所得到的鋅配合物也增大了其在水中的溶解度。由于鋅是真核生物和許多含鋅蛋白的重要微量元素,參與多種細胞活動,推測出 ZnPXZT1 可能在細胞活動過程中重新釋放出 PXZT,從而使 PXZT 的 TADF 性質得以恢復。隨后這種鋅配位的 ZnPXZT1 探針成功地用于 HeLa 和 3T3 細胞的時間分辨成像,發現這是一種有效的消除背景信號的方法。
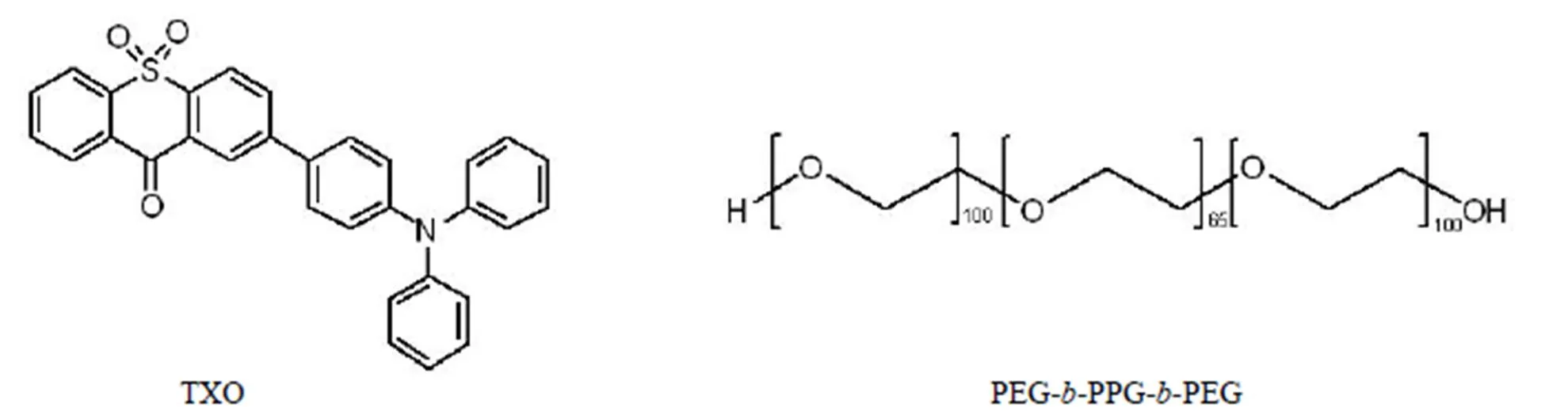
圖 10 TXO 和 PEG-b-PPG-b-PEG 的化學結構式
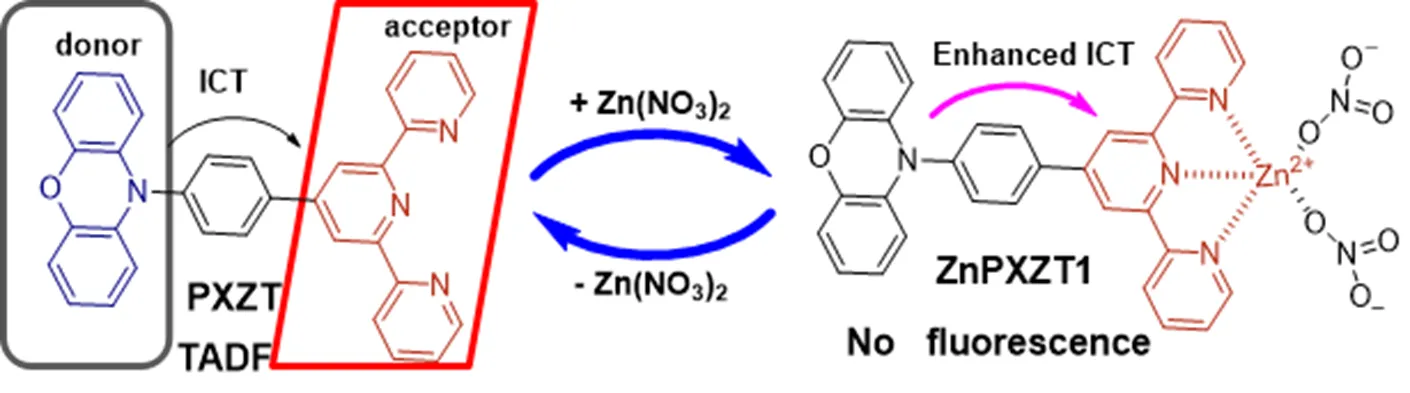
圖 11 鋅離子輔助調節的熱激活延遲熒光機制
3 結語
隨著生物成像技術的發展,熒光信號的高信噪比是生物熒光成像質量關鍵,然而由于生物環境的復雜性和多樣性,已有熒光探針很難避免來自生物環境自身及激發光源產生的雜散光的干擾,嚴重影響了目標熒光信號的靈敏度及精準性,降低了成像信噪比。熱激活延遲熒光(TADF)材料由于具有很小的 S1態和T1態能級差(ΔEst< 0.3 eV),T1態激子可以通過 RISC 過程,上轉換到 S1態,實現了 T1態激子參與的熒光發射,其理論內量子效率達到 100%。在 OLED 材料領域,解決了以往傳統熒光及磷光 OLED 低效率、高成本以及性能不穩定的難題,被譽為繼熒光和磷光材料后的“第三代 OLED 器件”。TADF 材料的熒光壽命可達微秒至毫秒級,具有避免背景信號干擾(大部分背景信號熒光壽命為納秒級),進行熒光壽命成像的潛力。但其生物相容性差、易被單線態氧淬滅的缺點嚴重限制了其在生物領域的應用。
目前基于 TADF 分子的研究還是一個新興的領域,為生物成像帶來了很大的突破,為細胞過程、信號通路研究及疾病的診斷治療提供了更好的平臺技術。本文總結 TADF 的發光機制及分子設計原則,并歸納了已有的避免單線態氧淬滅及改善探針分子生物相容性的方法。但整體技術還不成熟,TADF 探針的選擇性、靶向性不高,TADF 探針在生物領域的研究仍面臨著巨大的挑戰。構建具有良好生物相容性的新型 TADF 熒光探針,改善分子探針水溶性,增強靶向性,并開發避免單線態氧淬滅的新方法,是使 TADF 分子探針應用于生物成像領域的關鍵和需解決的瓶頸問題。
[1] Li Y, Sun Y, Li J, et al. Ultrasensitive near-infrared fluorescence-enhanced probe for in vivo nitroreductase imaging. J Am Chem Soc, 2015, 137(19):6407-6416.
[2] Verwilst P, Kim HR, Seo J, et al. Rational design of in vivo tau tangle-selective near infrared fluorophores: expanding the BODIPY universe. J Am Chem Soc, 2017, 139(38):13393-13403.
[3] Lozano-Torres B, Galiana I, Rovira M, et al. An off-on two-photon fluorescent probe for tracking cell senescence in vivo. J Am Chem Soc, 2017, 139(26):8808-8811.
[4] Zhang KY, Qi Y, Wei H, et al. Long-lived emissive probes for time-resolved photoluminescence bioimaging and biosensing. Chem Rev, 2018, 118(4):1770-1839.
[5] Hanaoka K, Kikuchi K, Kobayashi S, et al. Time-resolved long-lived luminescence imaging method employing luminescent lanthanide probes with a new microscopy system. J Am Chem Soc, 2007, 129(44):13502-13509.
[6] Gorman A, Killoran J, O'Shea C, et al. In vitro demonstration of the heavy-atom effect for photodynamic therapy. J Am Chem Soc, 2004, 126(34):10619-10631.
[7] Cao X, Zhang D, Zhang S, et al. CN-containing donor–acceptor-type small-molecule materials for thermally activated delayed fluorescence OLEDs. J Mater Chem C, 2017, 5(31):7699-7714.
[8] Im Y, Byun SY, Kim JH, et al. Recent progress in high-efficiency blue-light-emitting materials for organic light-emitting diodes. Adv Functional Mater, 2017, 27(13):1603007.
[9] Baldo MA, O'Brien DF, You Y, et al. Highly efficient phosphorescent emission from organic electroluminescent devices. Nature, 1998, 395(6698):151-154.
[10] Parker CA, Hatchard CG. Triplet-singlet emission in fluid solutions. Phosphorescence of eosin. Trans Faraday Soc, 1961, 57(3):132-136.
[11] Endo A, Sato K, Yoshimura K, et al. Efficient up-conversion of triplet excitons into a singlet state and its application for organic light emitting diodes. Appl Phys Lett, 2011, 98(8):083302.
[12] Zhang Q, Li B, Huang S, et al. Efficient blue organic light-emitting diodes employing thermally activated delayed fluorescence. Nat Photonics, 2014, 8(4):326-332.
[13] Sato K, Shizu K, Yoshimura K, et al. Organic luminescent molecule with energetically equivalent singlet and triplet excited states for organic light-emitting diodes. Phys Rev Lett, 2013, 110(24):247401.
[14] Baleiz?o C, Nagl S, Borisov SM, et al. An optical thermometer based on the delayed fluorescence of C70. Chemistry, 2010, 13(13):3643- 3651.
[15] Uoyama H, Goushi K, Shizu K, et al. Highly efficient organic light-emitting diodes from delayed fluorescence. Nature, 2012, 492(7428):234-238.
[16] Tan JH, Huo YP, Cai N, et al. Progress on donor-acceptor type thermally activated delayed fluorescence based blue emitters. ChinJ Org Chem, 2017, 37(10):2457-2480. (in Chinese)
譚繼華, 霍延平, 蔡寧, 等. 電子給體-受體型熱活化延遲熒光藍光材料研究進展. 有機化學, 2017, 37(10):2457-2480.
[17] Yang Z, Mao Z, Xie Z, et al. Recent advances in organic thermally activated delayed fluorescence materials. Chem Soc Rev, 2017, 46(3): 915-1016.
[18] Méhes G, Nomura H, Zhang Q, et al. Enhanced electroluminescence efficiency in a spiro-acridine derivative through thermally activated delayed fluorescence. Angew Chem Int Ed Engl, 2012, 51(45):11311- 11315.
[19] Kawasumi K, Wu T, Zhu T, et al. Thermally activated delayed fluorescence materials based on homoconjugation effect of donor-acceptor triptycenes. J Am Chem Soc, 2015, 137(37):11908- 11911.
[20] Zhang Q, Li J, Shizu K, et al. Design of efficient thermally activated delayed fluorescence materials for pure blue organic light emitting diodes. J Am Chem Soc, 2012, 134(36):14706-14709.
[21] Shizu K, Noda H, Tanaka H, et al. Highly efficient blue electroluminescence using delayed-fluorescence emitters with large overlap density between luminescent and ground states. J Phys Chem C, 2015, 119(47):26283-26289.
[22] Hirata S, Sakai Y, Masui K, et al. Highly efficient blue electroluminescence based on thermally activated delayed fluorescence. Nat Mater, 2015, 14(3):330-336.
[23] Cho YJ, Jeon SK, Lee JY. Molecular engineering of high efficiency and long lifetime blue thermally activated delayed fluorescent emitters for vacuum and solution processed organic light-emitting diodes. Adv Opt Mater, 2016, 4(5):688-693.
[24] Tsai WL, Huang MH, Lee WK, et al. A versatile thermally activated delayed fluorescence emitter for both highly efficient doped and non-doped organic light emitting devices. Chem Commun (Camb), 2015, 51(71):13662-13665.
[25] Zhang D, Cai M, Zhang Y, et al. Sterically shielded blue thermally activated delayed fluorescence emitters with improved efficiency and stability. Mater Horizons, 2016, 3(2):145-151.
[26] Huang B, Yin Z, Ban X, et al. Thermally activated delayed fluorescence of N-phenylcarbazole and triphenylamine functionalised tris(aryl)triazines. Dyes Pigments, 2015, 117:141-148.
[27] Chang CH, Kuo MC, Lin WC, et al. A dicarbazole-triazine hybrid bipolar host material for highly efficient green phosphorescent OLEDs. J Mater Chem, 2012, 22(9):3832-3838.
[28] Lee J, Shizu K, Tanaka H, et al. Controlled emission colors and singlet-triplet energy gaps of dihydrophenazine-based thermally activated delayed fluorescence emitters. J Mater Chem C, 2015, 3(10): 2175-2181.
[29] Inomata H, Goushi K, Masuko T, et al. High-efficiency organic electrophosphorescent diodes using 1,3,5-triazine electron transport materials. Chem Mater, 2004, 16(7):1285-1291.
[30] Zhang Y, Zhang D, Cai M, et al. Towards highly efficient red thermally activated delayed fluorescence materials by the control of intra-molecular π-π stacking interactions. Nanotechnology, 2016, 27(9):094001.
[31] Liu M, Seino Y, Chen D, et al. Blue thermally activated delayed fluorescence materials based on bis(phenylsulfonyl)benzene derivatives. Chem Commun (Camb), 2015, 51(91):16353-16356.
[32] Kobayashi J, Kato K, Agou T, et al. Synthesis of dibenzochalcogenaborins and systematic comparisons of their optical properties by changing a bridging chalcogen atom. Chem Asian J, 2009, 4(1):42-49.
[33] Li M, Liu Y, Duan R, et al. Aromatic-imide-based thermally activated delayed fluorescence materials for highly efficient organic light-emitting diodes. Angew Chem Int Ed Engl, 2017, 56(30):8818- 8822.
[34] Zeng W, Lai HY, Lee WK, et al. Achieving nearly 30% external quantum efficiency for orange-red organic light emitting diodes by employing thermally activated delayed fluorescence emitters composed of 1,8-naphthalimide-acridine hybrids. Adv Mater, 2017, 30(5):1704961.
[35] Xiong X, Song F, Wang J, et al. Thermally activated delayed fluorescence of fluorescein derivative for time-resolved and confocal fluorescence imaging. J Am Chem Soc, 2014, 136(27):9590-9597.
[36] Xiong X, Zheng L, Yan J, et al. A turn-on and colorimetric metal-free long lifetime fluorescent probe and its application for time-resolved luminescent detection and bioimaging of cysteine. Rsc Adv, 2015, 66(5):53660-53664.
[37] Zhang J, Chen W, Chen R, et al. Organic nanostructures of thermally activated delayed fluorescent emitters with enhanced intersystem crossing as novel metal-free photosensitizers. Chem Commun (Camb), 2016, 52(79):11744-11747.
[38] Li T, Yang D, Zhai L, et al. Thermally activated delayed fluorescence organic dots (TADF odots) for time-resolved and confocal fluorescence imaging in living cells and in vivo. Adv Sci (Weinh), 2017, 4(4):1600166.
[39] Hu W, Guo L, Bai L, et al. Maximizing aggregation of organic fluorophores to prolong fluorescence lifetime for two-photon fluorescence lifetime imaging. Adv Healthc Mater, 2018, 7(15): e1800299.
[40] Ni F, Zhu Z, Tong X, et al. Organic emitter integrating aggregation-induced delayed fluorescence and room-temperature phosphorescence characteristics, and its application in time-resolved luminescence imaging. Chem Sci, 2018, 9(28):6150-6155.
國家自然科學基金(21807116);中國醫學科學院醫學與健康科技創新工程(2017-I2M-2-004)
張青揚,Email:zhangqingyang@imm.ac.cn;胡海宇,Email:haiyu.hu@imm.ac.cn
2018-10-11
10.3969/j.issn.1673-713X.2018.06.009

