一株高產蛋白酶的米曲霉在醬油釀造中的發酵性能對比研究
黃艷,王靜,高庭,童星,2*
(1.佛山市海天(高明)調味食品有限公司,廣東 佛山 528000;2.佛山市海天調味食品股份有限公司,廣東 佛山 528000)
醬油是一種傳統的發酵調味品,主要是以大豆、豆粕、面粉、小麥等為原料,利用微生物的發酵作用,生成多種氨基酸、肽、有機酸及糖類,再經過復雜的變化,形成具有特殊色澤、香氣、滋味和狀態的調味液[1]。米曲霉是釀造醬油的主要菌種,能分泌肽酶、蛋白酶、α-淀粉酶、谷氨酰胺酶、果膠酶等[2,3]。蛋白酶是原料降解過程中的重要酶類,決定著生成氨基酸、短肽、多肽的多寡,關系到原料的充分利用[4]。隨著人們生活水平的提升,對純釀醬油鮮味的要求也越來越高。有研究 報道,醬油制曲過程中酶活的分泌能力與醬油鮮味有一定的相關性[5-7]。因此,應用微生物提升釀造醬油的鮮味是行業中備受關注的方法。本企業在米曲霉菌種選育過程中,獲得了1株性能突出的米曲霉誘變菌株ZA131。本研究通過對ZA131的酶系應用研究、分析釀造醬油理化和感官指標的差異性與出發菌株的性狀差異性,為進一步選育優良菌種提供了依據,著重介紹ZA131酶系提升在釀造醬油鮮味中的應用情況。
1 材料與方法
1.1 菌種材料
米曲霉(出發菌株)A019菌株,誘變后選育 ZA131米曲霉菌株,均為佛山市海天(高明)調味食品有限公司菌種保藏中心保藏。
培養基:麥芽汁瓊脂培養基(MEA)。
1.2 試驗方法
采用菌落形態對比、電鏡顯微特征對比(電鏡圖片為廣東省微生物研究所拍攝)、產孢結構對比分析(采用奧林巴斯普通光學顯微鏡BX53),將選育菌株和出發菌株進行制曲發酵醬油,對比相應指標的變化情況。
1.2.1 制曲工藝流程[8]
原料蒸煮→降溫接種→前期通風→第1次松曲→中期培養→第2次松曲→后期培養→成曲→出曲,試驗的外界環境條件:白天溫度28~35 ℃,夜間溫度22~28 ℃。
發酵工藝采用我國傳統高鹽稀態發酵法[9]。將 4 kg 曲料與8 kg鹽水(18%)均勻混合后,于 30 ℃下恒溫發酵120 天。
1.2.2 檢測方法
發酵醬油指標檢測:全氮的測定參照GB/T 5009.5-2003;氨基酸態氮和總酸的測定采用電位滴定儀;L-谷氨酸的測定采用L-谷氨酸快速檢測試劑盒(德國R-Biopharm公司)。
1.2.3 酶活指標檢測
中性蛋白酶活力的測定:參照國標SB/T 10317-1999《蛋白酶活力測定》,采用福林法測定中性條件下pH 7.2的蛋白酶活力。
谷氨酰胺酶活力檢測方法:定義為40 ℃下,每1 min催化1 μmol谷氨酰胺轉化為谷氨酸所需要的酶活力,單位定義為1 U。
α-淀粉酶活力的檢測方法:參照輕工業標準QB/T 1803-1993《工業酶制劑通用試驗方法》。
孢子數測定方法:參照SB/T 10315-1999。
2 試驗結果
2.1 選育菌株與出發菌株的對比分析
2.1.1 選育菌株與出發菌株的菌落形態、分生孢子數對比
研究探討ARTP處理對米曲霉原生質體的誘變效應,通過比較初始菌株與目標突變菌株的菌落形態、顯微特征、產孢結構等變化分析其誘變機制,為菌種選育提供借鑒依據。

圖1 出發菌株A019(左)與誘變菌株ZA131(右)菌落形態對比圖Fig.1 Comparison of colony morphology of the original strain A019(left) and the mutation strain ZA131(right)

圖2 出發菌株A019(左)與誘變菌株ZA131(右)電鏡顯微特征對比圖Fig.2 Comparison of electron microscopic characteristics between the original strain A019(left) and the mutation strain ZA131(right)
注:掃描電鏡比例尺SE WD16.4 mm 20.0 kV×500 100 μm。
圖1左為初始A019菌株的菌落形態圖,圖2左為電鏡圖;圖1右為突變株的菌落形態圖,圖2右為電鏡圖。菌落形態方面,初始菌A019在麥芽汁瓊脂培養基(MEA)上生長快,25 ℃黑暗條件下培養7天,菌落直徑為35~37 mm;產孢結構大量形成,分生孢子頭由白色漸變為黃綠色,初期球形,后期短柱狀;菌落背面淺褐色,無水溶性色素。突變株在麥芽汁瓊脂培養基上生長快,25 ℃黑暗條件下培養7天,菌落直徑為41~42 mm;產孢結構較出發菌株略少形成,分生孢子頭由白色漸變為黃綠色,初期球形,后期短柱狀;菌落背面淺褐色,無水溶性色素。由電鏡圖對比可見,初始菌A019分生孢子數量多,誘變后突變株的分生孢子數量明顯下降、菌絲生長較出發菌株更加旺盛。
2.1.2 選育菌株與出發菌株的顯微形態變化
從顯微特征來看,初始菌A019的菌絲纖細,鏡檢孢子多。誘變菌株ZA13菌絲略為粗壯,鏡檢孢子略少,聚集,見圖3。初始菌A019分生孢子梗高大,壁明顯粗糙;頂囊近球形,產孢結構單層,分生孢子橢圓形、近球形,淺黃綠色,壁光滑或略粗糙。誘變菌株ZA131(右)的分生孢子梗高大,壁明顯粗糙;頂囊球形;產孢結構單層,分生孢子橢圓形、近球形,淺黃綠色,壁光滑或略粗糙。顯微特征圖片見圖4。

圖3 出發菌株A019(左)與誘變菌株ZA131(右)顯微特征對比圖(奧林巴斯BX51顯微鏡,20×鏡檢)Fig.3 Comparison of microscopic characteristics of the original strain A019(left) and the mutation strain ZA131(right) (microscopic examination of Olympus BX51 microscope 20×)

圖4 出發菌株A019(左1,2)與誘變菌株ZA131(右3,4)產孢結構顯微特征對比圖(奧林巴斯BX51顯微鏡,100×油鏡鏡檢)Fig.4 Spore production micrographs of the original strain A019 (left) and the mutation strain ZA131(right)(Olympus BX51 microscope 100× oil microscopic examination)
2.2 釀造醬油過程指標分析
2.2.1 制曲質量分析
分析了新菌株在醬油產業化應用中的圓盤制曲質量分析,結果見表1和表2。

表1 ZA131菌株不同批次制曲質量分析Table 1 Quality analysis of different batches of ZA131 strain
由表1可知,相對原生產菌株,新菌株的種曲孢子數平均降低14.6%,圓盤制曲成曲孢子數平均降低46.29%,同時中性蛋白酶提升38.46%,谷氨酰胺酶提升18.25%,淀粉酶方面表現出了明顯的優勢,與篩選時的結果一致,論證了該菌株在制曲質量方面的突出優勢。
2.2.2 大罐發酵理化指標分析
分析了新菌株的發酵醬油主要理化指標,結果見表2。
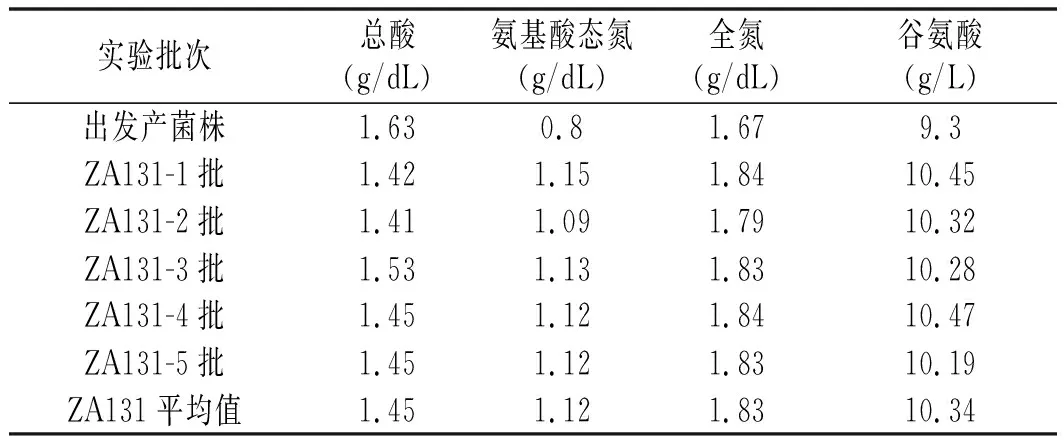
表2 ZA131菌株不同批次發酵醬油質量分析Table 2 Analysis of soy sauce quality in different batches of ZA131 strains
由表2可知,新菌株在氨基酸態氮、全氮、谷氨酸方面具有突出優勢,達到了蛋白酶、谷氨酰胺酶酶活高的效果。谷氨酸的生成量提升了11.18%。
2.2.3 發酵原油呈味分析
研究了發酵原油的氨基酸組成,根據不同氨基酸的呈味特性和呈味強度對新菌株進行了氨基酸呈味方面的對比分析,結果見下表;對發酵原油進行了感官鑒評,結果見圖5。

圖5 發酵醬油感官鑒評結果Fig.5 Sensory evaluation results of fermented soy sauce
3 結論
通過對比分析,選育菌株ZA131,產孢結構減少,菌絲更加粗壯,產酶能力增強,對釀造醬油發酵原油品質提升有一定作用,尤其對鮮味提升顯著。后續菌種選育過程中,結合米曲霉分泌酶系與發酵性能研究,應用相應的選育手段后,可在菌株形態學方面關注誘變菌絲長且粗壯的菌落,對選育高產酶系的菌株具有一定幫助,這項研究也與曾曉波等[10]在菌落形態選育方面的研究建議有一定相似性。米曲霉的菌種選育方面有很多研究,多集中在對于誘變方法的改進、特定酶活下的篩選方法研究或者米曲霉的分泌酶系研究等方面[11-15],對選育后各方面表現優良的米曲霉形態進行研究與匯總,并對選育做出進一步指導的文獻較少報道。結合優良米曲霉的形態選育經驗輔助菌種選育可能是今后米曲霉菌種選育的方向之一。

