殼聚糖酶的研究進展
魯晶娣,韋盤秋,張興猛,黃錦祥,黎婭,伍時華,易弋*
(1.廣西科技大學 生物與化學工程學院,廣西 柳州 545006;2.廣西科技大學 廣西糖資源綠色加工重點實驗室,廣西 柳州 545006;3.廣西科技大學 廣西高校糖資源加工重點實驗室,廣西 柳州 545006)
1 概述
殼聚糖是一種具有獨特功能特性的天然陽離子聚合物,是由自然界中廣泛存在的甲殼素經過脫乙酰作用得到的,主要由D-氨基葡萄糖通過β-1,4-糖苷鍵連接而成。大量研究表明殼聚糖在食品、化工、醫藥及農業領域都有廣泛的應用,但由于殼聚糖的分子量較大,只能溶于某些酸性溶液中,阻礙了殼聚糖的有效利用。殼寡糖又名殼聚寡糖,是殼聚糖經殼聚糖酶降解后的產物,具有分子量低,溶解性高,更容易被生物體吸收等特點,殼聚糖某些特殊功能只有將其降解成殼寡糖才能表現出來。
殼聚糖易受多種酶類的影響,這些酶類主要包括特異性(殼聚糖酶)和非特異性(碳水化物酶、蛋白酶、脂肪酶等)[1]。自1973年,Shimosaka等首先提取出殼聚糖酶以來,科研人員相繼從多種微生物(包括細菌、放線菌、真菌及病毒等)中分離、純化得到殼聚糖酶。2004年,酶命名委員會將殼聚糖酶(EC3.2.1.132,殼聚糖N-乙酰氨基葡萄糖水解酶)定義為能夠在部分乙酰化殼聚糖中催化水解β-1,4糖苷鍵的酶。另外,還有一些非特異性酶如常見的碳水化合物酶、蛋白酶和脂肪酶也顯示出了對殼聚糖的水解能力。
2 殼聚糖酶的來源與分布
殼聚糖酶主要是由微生物和植物產生的,該酶在這些微生物和植物的營養和防御功能上起著重要的作用,于1973年在研究土壤中的細菌和真菌時首次發現。在過去30多年時間里,已經有大量有關細菌、真菌以及植物中殼聚糖酶的結構、純化和理化特性等方面研究的論文被報道[2]。
目前,從很多細菌中已經發現胞外殼聚糖酶,包括Bacillussp.[3-5],Serratiasp.[6,7],Janthinobacteriumsp.[8],Paenibacillussp.,Acinetobactersp.[9],Streptomycessp.[10]等。在這些細菌中,Bacillussp.和Streptomycessp.的研究最為廣泛,研究范圍包括酶的結構和分子水平。真菌殼聚糖酶的研究很少,已經報道的來源于真菌的殼聚糖酶包括Aspergillussp.,Gongronellasp.以及Trichodermasp.[11-14]。
藍藻是一類具有光合作用的原核生物,它們在生理、形態和發育特征上存在可變性。近期報道中,研究人員在AnabaenafertilissimaRPAN1菌株中發現抗真菌殼聚糖酶的存在,并且可以起到抑制真菌的作用[15]。
上述殼聚糖酶大多數來源于微生物,然而也有少數來源于植物。在洋蔥和韭菜根部發現殼聚糖酶活性物質。Hsu等從冬筍中發現了2種具有熱穩定性的殼聚糖酶[16]。
3 殼聚糖酶的定義與分類
殼聚糖酶是對殼聚糖具有專一性水解的酶,而不降解甲殼素。一些特定的酶,例如普通的碳水化合物、蛋白酶和脂肪酶對殼聚糖也有水解能力。根據殼聚糖酶水解底物的不同,將殼聚糖酶分為3類:第I類殼聚糖酶水解(GlcN-GlcN)和(GlcNAc-GlcN)兩種糖苷鍵,第II類殼聚糖酶只能水解(GlcN-GlcN)一種糖苷鍵,第III類殼聚糖酶能水解(GlcN-GlcN)和(GlcN-GlcNAc)兩種糖苷鍵(見圖1)。內切水解GlcN-GlcN糖苷鍵是殼聚糖酶常見且唯一的特性,而不能催化GlcNAc-GlcNAc糖苷鍵。幾丁質酶與殼聚糖酶差別很小,都可作用于不同程度的脫乙酰化殼聚糖。兩種酶的區別在于:殼聚糖酶易降解脫乙酰化的殼聚糖,幾丁質酶更易降解乙酰化的殼聚糖。
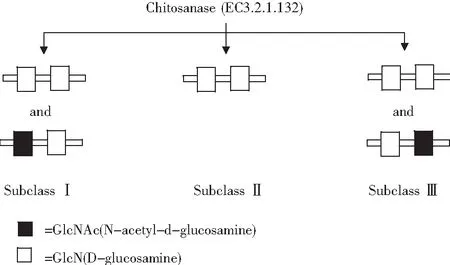
圖1 殼聚糖酶活性位點分類方式
根據氨基酸序列不同,可將殼聚糖酶分為5個糖苷水解酶家族,分別為:GH-5、GH-8、GH-46、GH-75和GH-80。在這些家族中,GH-75的成員主要來自真菌和放線菌,GH-46家族來自于Bacillus和Streptomyces的殼聚糖酶,其催化特性、酶反應機理和蛋白結構已被廣泛研究。
近年來,科研人員發現一種新型殼聚糖酶,該酶可從殼聚糖/殼寡糖的非還原末端水解GlcN,產生這種外切殼聚糖酶的微生物群已經被報道[17]。2008年,酶命名法委員會定義了一種新的酶類——殼聚糖外切(1,4)-β-D-氨基葡萄糖苷酶),這種酶也被稱為外切殼聚糖酶,該酶可以水解GlcN-GlcNAc,但不能水解GlcNAc-GlcNAc。
4 殼聚糖酶發酵生產
通過微生物液態發酵或固態發酵得到胞外殼聚糖酶的產量。迄今為止,已報道的大多數殼聚糖酶都是可誘導生產的。膠體殼聚糖的誘導作用已經被證實,在大多數的殼聚糖發酵工藝中都通過添加這一物質來誘導殼聚糖酶的產生。在液態發酵中,殼聚糖粉、蝦殼粉也被作為誘導劑、碳源和氮源添加到培養基中。
為了大量生產殼聚糖酶以滿足其商業化需求,培養基配方以及發酵工藝條件的優化非常重要。為優化發酵條件,Zhou 等對碳源、氮源、金屬離子、pH值、溫度等因素進行了經典的單因素研究。這些多重生長參數間的交互作用使我們很難控制發酵結果。響應面方法學(RSM)是一種非常有用的統計學技術,可用于優化復雜的化學、生物和食品的加工過程,在微生物酶生產的研究中也得到了廣泛關注,2012年,Zhang等人報道了利用統計學方法優化殼聚糖酶的生產,結果顯示采用Aspergillussp. QD-2發酵生產殼聚糖酶,經響應面法優化,殼聚糖酶活性從26.5 U/mL提高到了85.8 U/mL 。
固態發酵通常被定義為微生物在沒有或基本沒有游離水的固態基質上生長的發酵方式。固態發酵主要用于真菌發酵,得到的代謝物濃度較高,純化成本較低,Da 等報道了以昆蟲病原真菌Trichodermakoningi為菌種,采用固態發酵的方式生產殼聚糖酶,優化后的殼聚糖酶產量達到了4.84 U/g(以培養基干重計),其研究表明了固體發酵對微生物殼聚糖酶生產的可行性。
5 酶的純化
在制備殼寡糖的工業生產中采用粗酶液,不需要采用純化的殼聚糖酶,但是為進一步研究該酶的生化特性、功能結構需要對該酶進行純化。大多數情況下,該酶的純化采用硫酸銨或聚乙二醇進行分級鹽析,通過使用離子交換及親和技術達到純化目的,最后通過SDS-PAGE進行蛋白檢測純化。已經有大量關于來自不同細菌和真菌的上清液中殼聚糖酶純化和特性的研究被報道。Zitouni等從Paenibacillussp.的培養濾液中分離、純化了一種耐熱的殼聚糖酶,采用冷丙酮沉淀、Q-SepHarose FF離子交換的方法從Paenibacillussp.1794的發酵上清液中純化了比酶活為122 U/mg的殼聚糖酶。
6 殼聚糖酶理化性質
來源不同的殼聚糖酶,其基本生化特性也會有所不同,這些酶的生化特性已經得到深入的研究和報道。
6.1 分子量
大部分殼聚糖酶的分子量較低,目前發現分子量約在20~75 kDa之間。Wang 等從AspergillusfumigatusKH-94中獲得一個分子量大約為108 kDa的殼聚糖酶,具有很高的分子量。Zitouni等從PenicilliumchrysogenumAS51D中獲得的殼聚糖酶存在2種形式,分別為30,31 kDa。
6.2 最適溫度、PH、金屬離子
從微生物中分離的殼聚糖酶的最適pH值在4.0~8.0之間。據報道,從Gongronellasp. JG和Aspergillussp. QD-2中分離得到的殼聚糖酶的最適的pH值為5.6,偏酸,紫色桿菌屬中分離得到的殼聚糖酶最適的pH值在5.0~7.0之間。Gupta等從Anabaenafertilissima中獲到的殼聚糖酶的最適的pH在7.5左右,偏堿性的酶。
殼聚糖酶的最適溫度主要在30~60 ℃之間。Johnsen等從Janthinobacteriumsp. 4239中分離出一種冷活性殼聚糖酶在10~30 ℃條件下可以保留30%~70%的酶活性。大多數被報道的殼聚糖酶在自然界中都是嗜溫的,然而熱穩定的殼聚糖酶很少有報道。眾所周知,耐高溫的殼聚糖酶在工業生產中有很多優勢,高溫條件下,反應進程加快,液體黏度降低,微生物污染率也會降低。Chen等報道了從A.fumigates中分離的一種殼聚糖酶,80 ℃下半衰期為205 h,90 ℃下為1 h,100 ℃下為32 min,這種具有熱穩定性的酶在工業生產的應用上更具有優勢[18]。
不同金屬離子對殼聚糖酶酶活性的影響,Mg2+,Ca2+,Zn2 +,Mn2+,K+,Na+和Cu2+等離子是該酶的激活劑,Fe2+,Hg2+,Co2+和Ag+等離子對該酶有強烈的抑制作用。例如Wang等在研究SerratiamarcescensTKU011菌株中得出Mn2+,Cu2 +也可作為該酶的抑制劑。
6.3 酶的水解
以從酶產物中獲得的還原端糖的C1質子的異構體為基礎,不同家族的殼聚糖酶分為:“retaining”和“inverting”(見圖2)兩種催化類型。采用“retaining”催化的糖苷水解酶在對底物進行水解時分為兩步,發生了一個兩步雙置換反應,在這個反應中,兩個必需氨基酸殘基一個用作親核試劑,另一個作為酸/堿基團參與了反應。與此相反,采用“inverting”催化型的糖苷水解酶在對底物進行水解時發生了一個單置換反應。該反應需要酸/堿基團的輔助,堿性基團極化了一個水分子形成更強的親核基團去攻擊糖苷鍵上的碳原子,而酸性基團質子化糖苷鍵上的氧原子來加速這個反應。Fukamizo等發現Glu22是質子供體,Asp40活化水分子以攻擊底物中葡萄糖胺上的碳原子。
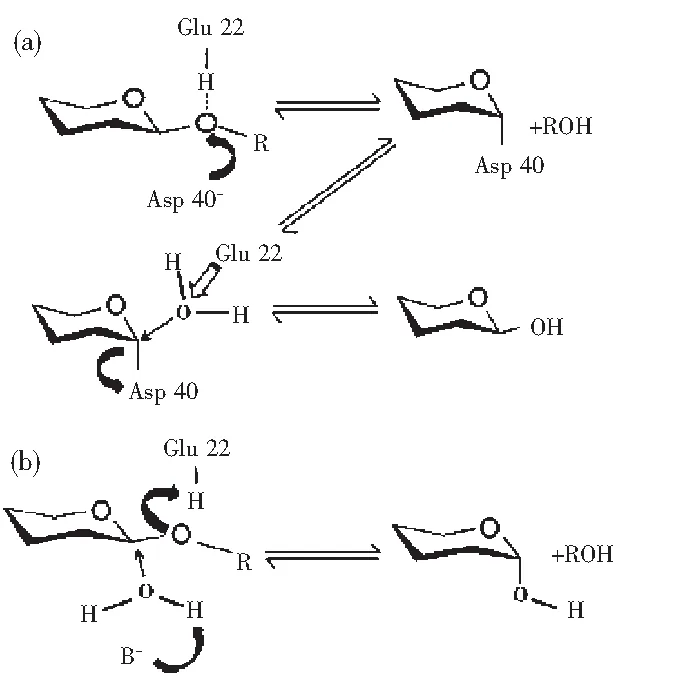
圖2 殼聚糖酶催化機制
6.4 酶的誘導劑
大多數來源于微生物的殼聚糖酶都受到膠體殼聚糖的誘導,使用膠體殼聚糖作為培養基補充成分在殼聚糖生產中是一種常見的方法。另外,殼聚糖粉末、魷魚粉末和蝦殼粉等不同底物能促使殼聚糖酶誘導產生。然而,殼聚糖黏度高,具有抗菌作用,會抑制微生物的生長,在加熱殺菌過程中也會與其他化合物發生反應,因此采用不需要殼聚糖的誘導能產生殼聚糖酶的微生物發酵生產殼聚糖酶具有一定的技術優勢,非誘導型殼聚糖酶在發酵過程中不需要在培養基中加入殼聚糖作為誘導劑具有一定的技術優勢。從Bacillussp.MET 1299中分離出的組成型殼聚糖酶也有類似的報道。
6.5 酶的結構
Marcotte等首次介紹了一種從鏈霉菌N174中提取的抗真菌殼聚糖酶的x射線結構[19],該殼聚糖酶呈啞鈴狀,長度55?,包含兩個球狀的區域,兩個球狀區域是由一段氨基酸組成的螺旋連接,形成一個10?寬、12?深的裂縫。殼聚糖酶的二級結構主要包括10α螺旋和3個β螺旋,α螺旋約占整個結構的64%。殼聚糖酶的表面電荷分析顯示結合裂縫附近主要是負電荷,有利于結合帶正電荷的殼聚糖底物,但是幾丁質酶的裂縫是中性的。殼聚糖與活性位點的結合表明,底物結合和催化機制可能類似于其他糖水解酶。在殼聚糖酶中確定了6個糖結合位點,糖苷鍵斷裂可能發生在其中兩個位點和底物之間的糖苷鍵相互作用上。x射線結構表明,Glu22和Asp40對催化功能很重要。
隨后Saito等[20]報道了從環狀芽孢桿菌MH-K1中分離得到殼聚糖酶是一種由259個氨基酸組成的分量為29 kDa的胞外酶。該酶包括14個α螺旋和5個β螺旋,有上部和下部兩個球狀的結構域,產生底物結合活性位點裂縫。該殼聚糖酶與來源于鏈霉菌N174的殼聚糖酶在氨基酸序列上僅有20%的相似,但在空間結構上非常相似。通過比對上述兩種殼聚糖酶結構,兩者有三處明顯差異,此外,該酶在Cys50和Cys124之間的二硫鍵是由β1折疊和α7螺旋連接,這樣的結構在其他殼聚糖酶中并不保守。連接兩個球狀結構域的兩條螺旋在方向上不同,這兩條螺旋也決定著兩種酶的裂縫在大小和形狀上的不同。在裂縫活性位點的結構差異是酶特異性識別不同底物并降解不同類型殼聚糖的原因。
7 克隆和遺傳改進
通過對殼聚糖酶基因的克隆,科研工作人員對殼聚糖酶的序列、特性、超表達、誘導模式以及酶工程等方面進行了大量研究。不同細菌和真菌中的殼聚糖酶基因已被克隆,主要在Escherichiacoli或Pichiapistoris中表達。近年來,來源于海洋中的Pseudomonassp.OUC1的殼聚糖酶基因被克隆,并在Yarrowialipolytica中實現了高表達,獲得的轉化株(9.0 U/mL)可以比非轉化株(4.3 U/mL)分泌更多的殼聚糖酶[21]。在EscherichiacoliBL21(DE3)[22]中表達的N-末端融合了6×His標簽的來源于芽孢桿菌的GH-8家族殼聚糖酶以可溶性形式存在,其表達水平高達500 mg/L,酶活性可達到140 U/mL。該酶可以有效地將殼聚糖轉化為游離的殼寡糖:1 g酶可以水解約100 kg殼聚糖。
據報道,耐熱的抗真菌B.subtilis殼聚糖酶(csnv26)已在Escherichiacoli中實現異源分泌表達[23],對編碼殼聚糖酶的基因csnv26進行擴增并克隆到載體pBAD中,并在Escherichiacolitop10中表達。通過對重組蛋白的SDS-PAGE和酶譜分析,結果顯示重組蛋白分子量大小約為27 kDa。重組菌所分泌的蛋白產量高達6.2 g/L。
由于真核基因不易改造,所以有關真菌殼聚糖酶的基因改良方面的報道少于細菌。Liu等人報道了來自Fusariumsolani0114的殼聚糖酶基因在Saccharomycescerevisiae工業菌株中表達并實現大規模生產。Chen等人將煙曲霉菌內切殼聚糖酶基因在PichiapastorisGS115表達,酶活結果顯示該酶在80 ℃下半衰期為205 h,在90 ℃下為1 h,在100 ℃下為32 min,是一種熱穩定性極強的殼聚糖酶。
Zhu等[24]通過反向pcr克隆了從Penicilliumsp.D-1的殼聚糖酶編碼,對其進行cDNA序列分析,在基因中并未發現內含子,因此推斷酶由250個氨基酸組成,其中包括由20個氨基酸所組成的信號肽,并且該蛋白序列與TalaromycesstipitatusB8M2R4中的GH75家族的殼聚糖酶相似度達到了83.6%,且這種酶已在Escherichiacoli中實現了大量表達。
8 殼聚糖酶生物學功能及應用
微生物產生的殼聚糖酶具有多種生物學活性,殼聚糖降解微生物廣泛分布于自然界中,微生物通過分泌殼聚糖酶降解殼聚糖以達到需求。殼聚糖酶常常和幾丁質酶、幾丁質脫乙酰酶和氨基葡萄糖酶等酶的共同使用,來降解回收甲殼類動物的貝殼。殼聚糖是接合真菌細胞壁中主要的結構成分,殼聚糖酶在其細胞壁降解和形態中起著重要作用。
殼聚糖酶應用廣泛[25],最為重要的用途是生產殼寡糖。殼聚糖酶水解產生的殼寡糖分子量更易控制且條件溫和,殼聚糖酶水解獲得的殼寡糖分子量一般低于10 kDa,且更易溶于水,優于天然的殼寡糖。殼寡糖比殼聚糖有更好的生物功能,例如在生物醫學領域對人體的免疫調節、抗腫瘤、降血脂、調節血糖、改善肝臟和心肺功能等。此外,殼寡糖在食品行業還具有重要的應用價值,有助于改善腸道,從而促進人體吸收營養物質;可用于生產調味品,代替市場上一些如苯甲酸鈉等化學添加劑;可用于生產飲料,具有減肥、美容養顏、調節免疫功能等作用;可用于蔬菜、水果的保鮮,且具有抗菌防腐的功效。
大量的海產品工業發展產生的甲殼類廢棄物,處理這些廢棄物會引發一系列環境問題[26]。近年來,產殼聚糖酶的微生物在甲殼類廢料處理中得到廣泛的應用,如酶和抗氧化劑的生產。
殼聚糖是真菌細胞壁中主要的結構成分,其中一種應用是利用殼聚糖酶降解細胞壁中的殼聚糖制備原生質體[27]。殼聚糖酶也是殼聚糖介導的基因傳遞,提高細胞轉化效率。
利用微生物或其組分抑制植物病害的生物防治可代替化學殺真菌劑,也是一種生態的、有效的農業病原菌防治方法。幾個研究小組報道了殼聚糖酶的體外抗真菌活性,它們可用于提高植物對不同植物病原真菌的抗性[28-30]。Kouzai等人報道了殼聚糖酶活性在植物抗病性中的分子機制。植物病原真菌在感染過程中改變細胞壁成分,避免宿主裂解酶降解,細胞壁幾丁質向殼聚糖的轉化可能是病原體的感染原因之一。
9 展望
殼聚糖酶不僅是用于制備具有生物活性物質殼寡糖的關鍵酶,與此同時殼聚糖酶在植物病原體的生物防治方面也發揮著重要作用。殼聚糖酶得到廣泛應用依賴于以合理的成本生產高活性酶。近年來,殼聚糖酶相關的研究熱點也集中在嗜熱殼聚糖酶的開發。其來源主要是通過對嗜熱微生物的直接提取或在其基因水平進行修飾而獲得具有熱穩定性的殼聚糖酶。利用微生物產生的殼聚糖酶處理甲殼質廢棄物不僅能消除其對環境的污染,還能增加經濟效益。在不久的將來,逐漸深入地對殼聚糖酶的分子機制及生化性質的研究,將促使殼聚糖酶在各行業中得到更加廣泛的應用。

