ω-3多不飽和脂肪酸對不穩定型心絞痛患者脂蛋白相關性磷脂酶A2的影響
藍先旗,麥惠強,鄭偉華,李明星,譚娉嬋
中山市人民醫院1急診科;2心血管內科,廣東 中山 528400;3開平市中心醫院內一科,廣東 開平 529300
目前,我國冠心病發病率逐漸增加,為個人和社會帶來了沉重的負擔[1]。多不飽和脂肪酸(PUFA)是指長度為18~22個碳原子且含有兩個或以上雙鍵的長鏈脂肪酸,分為ω-3和ω-6兩種,ω-3 PUFA包括二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等,大量存在于深海魚類魚油和內臟中[2,3]。目前,ω-3 PFUA的攝入可有效降低冠心病的發病風險[4]。脂蛋白相關性磷脂酶A2(Lp-PLA2)與心血管疾病發生發展密切相關,是心血管疾病預防治療的潛在靶點之一[5-7]。體外及動物實驗發現PUFA可顯著降低Lp-PLA2表達,這可能是PUFA降低冠心病發病風險的重要潛在機制,但目前缺乏相關體內研究進行驗證[8]。本研究探討ω-3 PFUA對不穩定型心絞痛患者Lp-PLA2和氧化低密度脂蛋白(LDL)的影響,以期為ω-3 PFUA降低心血管疾病發生風險的機制提供理論依據。
1 對象與方法
1.1 研究對象
本試驗已獲得醫院倫理委員會批準。選取兩家醫院60例經皮冠狀動脈介入治療(PCI)成功的不穩定型心絞痛患者,所有患者均簽署相關知情同意書。用隨機數字法將所有患者隨機分成對照組和試驗組,每組30例。兩組患者在服用ω-3 PFUA前性別、年齡、BMI、腰圍、冠心病病史、高血壓病史、2型糖尿病病史、高血脂病史和吸煙史等臨床資料差異無統計學意義(P>0.05,表1)。
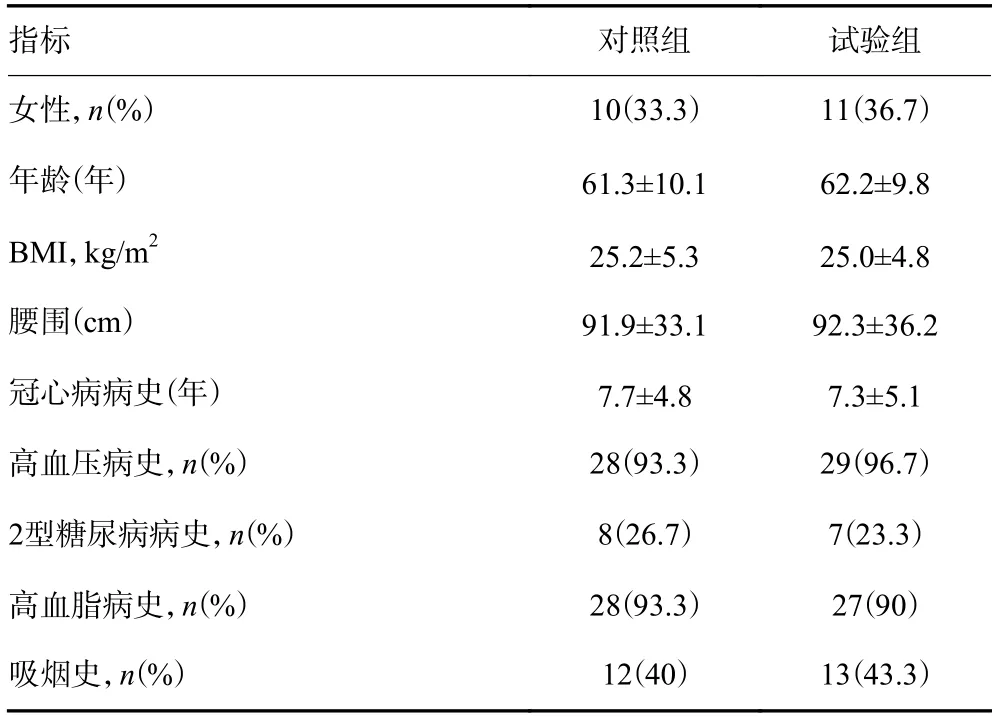
表1 兩組患者臨床資料比較
1.2 研究方法
對照組患者術后接受常規的阿司匹林及氯吡格雷治療,試驗組除了接受上述藥物治療外,每日添加服用ω-3 PFUA 1000 mg。分別在服用ω-3 PFUA前,服用后2周和服用后4周清晨對所有空腹研究對象抽取外周靜脈血液,1 h內送至實驗室進行相關指標檢測。
1.3 觀察指標
記錄兩組患者性別、年齡、體質量指數(BMI)、腰圍、冠心病病史、高血壓病史、2型糖尿病病史、高血脂病史和吸煙史等臨床資料。采用酶聯免疫吸附測定法檢測氧化-LDL和Lp-PLA2等指標。
1.4 統計學方法
統計學資料采用SPSS 21.0統計軟件進行分析,計量資料以±s表示,組間比較采用t檢驗,計數資料使用率(%)表示,組間比較采用χ2檢驗,兩連續變量相關性分析采用Pearson相關分析,多變量線性關系采用多重線性回歸分析,P<0.05認為差異具有統計學意義。
2 結果
2.1 兩組患者服用ω-3 PFUA前后Lp-PLA2水平變化及比較
兩組患者服用ω-3 PFUA前Lp-PLA2水平差異無統計學意義(P>0.05),對照組患者服用ω-3 PFUA 2周及4周后Lp-PLA2水平與服用前比較差異無統計學意義(P>0.05),試驗組服用ω-3 PFUA 2周及4周后患者Lp-PLA2水平顯著低于服用前及對照組患者(P<0.05,表2)。

表2 兩組患者不同時間點Lp-PLA2水平比較(Mean±SD,ng/mL)
2.2 兩組患者服用ω-3 PFUA前后氧化LDL水平變化及比較
兩組患者服用ω-3 PFUA前氧化LDL水平差異無統計學意義(P>0.05),對照組患者服用ω-3 PFUA 2周及4周后氧化LDL水平差異無統計學意義(P>0.05),試驗組服用ω-3 PFUA 2周及4周后患者氧化LDL水平顯著低于服用前及對照組患者(P<0.05,表3)。
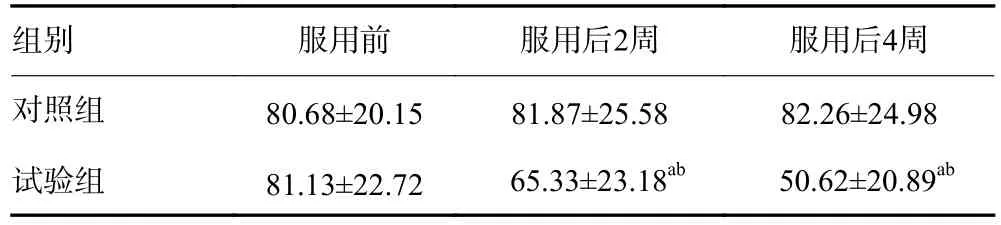
表3 兩組患者不同時間點氧化LDL水平比較(Mean±SD,μg/L)
2.3 患者Lp-PLA2水平與其它指標的Pearson相關分析
Lp-PLA2水平與患者BMI呈正相關(r=0.32,P<0.05,圖1),與患者年齡、腰圍、冠心病病史和氧化LDL水平無相關性(P>0.05)。
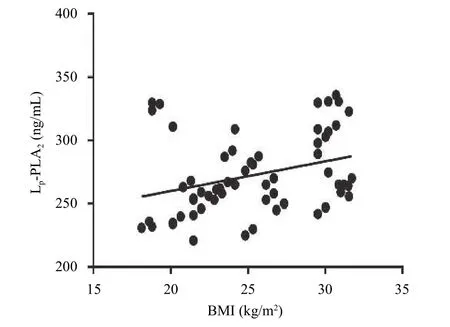
圖1 患者Lp-PLA2水平與患者BMI的Pearson相關性分析
2.4 患者Lp-PLA2水平與其它臨床資料的多重線性回歸分析
以Lp-PLA2水平為因變量,以性別、年齡、BMI、腰圍、冠心病病史、高血壓病史、2型糖尿病病史、高血脂病史、吸煙史和是否服用ω-3 PFUA為自變量進行多重線性回歸分析,結果顯示是否服用ω-3 PFUA(R2=20.1%,P<0.05)和BMI(R2=10.3%,P<0.05)為Lp-PLA2水平變化的獨立預測因素。
3 討論
Lp-PLA2是由單核巨噬細胞等炎性細胞分泌,表達于動脈粥樣硬化斑塊中的血小板激活因子乙酰水解酶[9-10]。Lp-PLA2與氧化LDL密切相關,可水解氧化LDL成促炎及促凋亡的產物,損傷血管內皮,引起血小板炎癥[11-12]。Lp-PLA2與冠心病的發生發展密切相關,一篇納入32項心血管疾病一級和二級預防研究的薈萃分析發現,Lp-PLA2與非高密度脂蛋白、膽固醇和收縮壓相似,與主要心血管疾病發生密切相關[11-13]。目前,相關研究已證實ω-3 PFUA可降低冠心病的發病風險,其機制可能與提高血小板對氯吡格雷的敏感性[14-15],減少血栓形成和體內氧化應激水平[16-17],減少心律失常、缺血再灌注損傷和血清甘油三酯[4],提高內皮細胞功能[18]等有關。然而,目前ω-3 PFUA與Lp-PLA2的關系尚無定論。部分研究發現,ω-3 PFUA對正常人Lp-PLA2和氧化LDL水平沒有影響[19-20],但上述研究中研究對象為正常人群,Lp-PLA2和氧化LDL基線水平較低,而且研究樣本量較小,研究結論尚需樣本量更大的研究行進一步驗證。本研究中研究對象為PCI術后不穩定型心絞痛患者,Lp-PLA2水平較Pedersen等[18]觀察到的正常人群Lp-PLA2水平高35%,氧化LDL水平較Nelson等[19]觀察到的正常人群氧化LDL水平高45%,我們發現試驗組患者服用ω-3 PFUA2周及4周后,血漿Lp-PLA2和氧化LDL水平顯著低于服藥前以及對照組患者,說明ω-3 PFUA可有效降低冠心病患者血漿Lp-PLA2和氧化LDL水平,這可能是ω-3 PFUA降低冠心病發病率的重要機制之一。Schmidt等[21]對301例行冠狀動脈造影的患者行回顧分析發現,患者Lp-PLA2水平與脂肪組織EPA含量成負相關,認為ω-3 PFUA可能通過降低體內Lp-PLA2水平從而降低心血管疾病的發生,與本研究結論基本相符合。
目前,ω-3 PFUA對Lp-PLA2的具體調控機制也尚未完全明確。Bouwens等[22]發現EPA和DHA的攝入可以使血單核細胞基因表達譜中抗炎及抗動脈粥樣硬化相關基因表達水平更高。由于ω-3 PFUA可直接影響炎性細胞脂肪酸成分,而Lp-PLA2由巨噬細胞等炎性細胞分泌產生,ω-3 PFUA可能通過作用于炎性細胞從而直接影響Lp-PLA2的分泌產生。Kris-Etherton等[23]認為,ω-3 PFUA可能通過影響LDL氧化過程從而減少Lp-PLA2的作用底物氧化LDL,進而影響Lp-PLA2水平。本研究發現ω-3 PFUA不僅可顯著降低Lp-PLA2水平,也可顯著降低氧化LDL水平,可能與該機制有關。Mitsios等[24]認為,由于Lp-PLA2是在血小板聚合過程中產生的,ω-3 PFUA可能通過抗血小板和抗動脈粥樣硬化作用從而調節Lp-PLA2的分泌。Constantina等[25]發現,魚類極性脂質可下調血小板活化因子(PAF)表達,促進PAF分解,這也可能是ω-3 PFUA調控Lp-PLA2的潛在機制之一。
本研究尚存在以下不足。本研究納入的樣本量及樣本類型不足,沒有對其它類型冠心病患者行進一步研究。同時,本研究ω-3 PFUA劑量是根據心血管疾病二級預防的推薦來制定的,其它劑量對Lp-PLA2的影響未行進一步討論。本研究觀察時間為4周,缺乏對患者長期隨訪結果。下一步我們將采用不同劑量ω-3 PFUA進行研究探討,并延長隨訪時間,以觀察不同劑量的ω-3 PFUA對冠心病患者Lp-PLA2水平的長期調控效果。
綜上所述,ω-3 PFUA可顯著降低不穩定型心絞痛PCI術后患者的Lp-PLA2水平,這可能是ω-3 PFUA降低心血管疾病發生發展的潛在機制之一。

