羧基化多壁碳納米管分散固相萃取/氣相色譜-質譜法測定茶青中18種多氯聯苯
劉騰飛,楊代鳳*,章雪明,范 君,梁鳳玲,錢 輝
(1.江蘇太湖地區農業科學研究所,江蘇 蘇州 215155;2.蘇州市農產品質量安全監測中心,江蘇 蘇州 215128)
多氯聯苯(Polychlorinated biphenyls,PCBs)是一類人工合成的氯代聯苯類芳烴化合物,曾作為優質工業添加劑(熱載體、阻燃劑、增塑劑、絕緣材料等)大量應用于印刷、化工、電力、塑料、油漆等領域[1]。大量的研究已證明,PCBs具有很強的生物毒性,能夠導致生物體內分泌紊亂、免疫和生殖系統破壞,誘發癌癥和神經性疾病[2-3],20世紀70年代開始已在全球范圍內停止使用,但由于其高穩定、半揮發等特性,使之在空氣[4]、土壤[5]、水體[6]、沉積物[7]、農產品[8]、水產品[9]等多種介質中被廣泛檢出,已成為一類普遍存在的持久性有機污染物,被列入斯德哥爾摩公約首批控制污染物名單[10]。鑒于PCBs的生物毒性和環境風險,研究并建立快速、準確、靈敏、高效的PCBs分析方法尤為重要。
目前,PCBs的檢測方法主要有氣相色譜法(GC/ECD)[5]、氣相色譜-質譜法(GC-MS)[4,7-8]、氣相色譜-串聯質譜法(GC-MS/MS)[6,9]等。其中,GC/ECD法操作簡單、快速,但定性能力不足;GC-MS/MS法快速、靈敏、定性可靠,但儀器昂貴且操作要求較高,應用不廣泛;GC-MS法不僅定性定量準確,而且儀器價格相對低廉,是目前測定PCBs最常用的方法,也是國家或行業標準推薦方法[11-12]。由于PCBs的殘留濃度低,且樣品基質中干擾物較多,因此需對樣品進行分離富集和凈化。分散固相萃取是近年來快速發展的一種高效前處理技術,具有操作簡單、快速、靈活、成本低等優點[13],已被廣泛用于環境、食品等檢測領域。吸附劑是影響該技術萃取效果的關鍵因素,常見的吸附劑填料,如N-丙基乙二胺(PSA)、石墨化碳黑(GCB)、C18等對復雜基質的凈化效果不理想,而且價格相對較高。多壁碳納米管(MWCNTs)是一種具有較強吸附性能的納米碳材料,其與PSA、C18、GCB相比具有更大的比表面積,因此吸附能力更強,且價格相對低廉,同時具有特殊的π-π共軛作用,選擇性較高,是一種理想的分散固相萃取吸附劑,已成功應用于水體、土壤、食品及農產品等基體中農藥[14]、獸藥[15]、重金屬[16]、微生物及毒素[17-18]、食品非法添加物[19]等污染物的分離與檢測。然而,將MWCNTs作為分散固相萃取吸附劑用于茶青中PCBs的檢測尚未見報道。
作為加工各類成品茶的原料,茶青的安全性直接影響茶葉的食用安全以及茶產業的可持續健康發展。目前,有關茶青中有害物質的檢測已有相關報道,但主要集中在農藥殘留[20]、重金屬[21]等方面,對茶青中PCBs的檢測研究尚屬空白。本實驗選取蘇州特色茶種碧螺春茶青為研究對象,采用吸附性能好、凈化效率高的羧基化多壁碳納米管(MWCNTs-COOH)作為主要分散固相萃取吸附劑,建立了同時分析茶青中18種PCBs的GC-MS方法,以期為茶葉生長過程中PCBs的過程監測和源頭監督檢驗提供技術支撐。
1 實驗部分
1.1 儀器與設備
7890B-5977A氣相色譜-質譜聯用儀(美國Agilent公司);KQ-500DE超聲波清洗器(昆山超聲儀器公司);TG16-WS臺式高速離心機(湖南湘儀實驗儀器公司);K600粉碎機(德國博朗公司);HSC-24B氮吹儀(天津恒奧科技公司);Direct-Q5UV型超純水機(美國Millipore公司)。
1.2 藥品與試劑
18種PCBs混合標準溶液:PCB28、PCB52、PCB101、PCB118、PCB153、PCB138、PCB180、PCB81、PCB77、PCB123、PCB114、PCB105、PCB126、PCB167、PCB156、PCB157、PCB169、PCB189(質量濃度為10mg/L,美國o2si公司)。
多壁碳納米管(MWCNTs,長度10~30μm,外徑10~20nm,內徑5~10nm,純度>95%,比表面積>200m2/g)、羥基化多壁碳納米管(MWCNTs-OH,長度10~30μm,外徑10~20nm,內徑5~10nm,純度>95%,比表面積>200m2/g)、MWCNTs-COOH(長度10~30μm,外徑10~20nm,內徑5~10nm,純度>95%,比表面積>200m2/g)、N-丙基乙二胺(PSA,粒度40~60μm)、石墨化碳黑(GCB,粒度40~120μm)、十八烷基鍵合硅膠(C18,粒度40~60μm)均購于南京先豐納米材料科技有限公司;弗羅里硅土(Florisil,60~100目,農殘級,美國ROE公司);正己烷(色譜純,瑞典歐普森公司);丙酮、乙酸乙酯、乙腈、甲苯、無水硫酸鈉(用前于450℃下灼燒4h)、無水硫酸鎂(使用前于620℃下灼燒4h)均為分析純,購于上海國藥集團公司。
碧螺春茶青樣品采自蘇州洞庭碧螺春茶園,采集一芽二、三葉茶青,粉碎后于-20℃下保存,備用。
1.3 實驗方法
1.3.1標準溶液的配制準確量取1 mL 10 mg/L的18種PCBs混合標準溶液于10 mL容量瓶中,用正己烷定容,配成1 mg/L的混合標準母液,于4 ℃冰箱冷藏保存;使用前,取出放至室溫后,用正己烷逐級稀釋成5、10、50、100、500 μg/L的混合標準溶液。
取1 g空白茶青樣品,按照優化提取凈化條件處理后,上機樣液用氮氣吹干,加入1.0 mL不同濃度的混合標準工作溶液,振蕩混勻,過0.22 μm有機濾膜,得到對應濃度的基質匹配標準溶液。
1.3.2樣品前處理稱取粉碎后的茶青樣品1 g(精確至0.01 g)于50 mL塑料離心管中,加入1 g無水硫酸鈉和15 mL正己烷-丙酮(1∶1,體積比),渦旋混勻,在500 W功率下超聲提取15 min,期間取出振搖2次,8 000 r/min離心4 min,取7.5 mL上清液至玻璃試管中,氮吹濃縮至0.5 mL,加入1 mL甲苯,氮吹至0.5 mL后,用甲苯定容至5 mL,待凈化。
將上述5 mL甲苯溶液轉移至填裝0.09 g MWCNTs-COOH、0.05 g PSA和0.1 g無水硫酸鎂的凈化管中,渦旋2 min,以9 000 r/min離心5 min,取上清液氮吹近干,加入0.5 mL正己烷,渦旋混勻,過0.22 μm有機膜,供GC-MS分析。
1.3.3儀器條件色譜條件:HP-5MS石英毛細管柱(30 m×0.25 mm×0.25 μm);進樣口溫度250 ℃;載氣為高純氮氣;恒流模式,流速1.2 mL/min;不分流進樣;進樣量1.0 μL。升溫程序:初始溫度80 ℃,保持2 min;以20 ℃/min升溫至180 ℃,保持2 min;以3 ℃/min升溫至230 ℃,保持2 min;再以10 ℃/min升溫至280 ℃,保持2 min。
質譜條件:電子轟擊(EI)離子源,電離電壓70 eV,離子源溫度280 ℃,四極桿溫度150 ℃,傳輸線溫度280 ℃,檢測方式:選擇離子掃描(SIM),溶劑延遲5 min。
2 結果與討論
2.1 檢測條件的優化
PCBs屬弱極性化合物,因此實驗選用弱極性、低流失的HP-5MS毛細管柱進行色譜分離,并根據靈敏度和分析時間,通過調整色譜升溫程序、載氣流速、進樣口溫度等參數,最終確定“1.3.3”的色譜條件。
在選定的色譜條件下,利用GC-MS全掃描方式,在m/z50~450范圍內對500 μg/L的PCBs混合標準溶液進行分析,得到總離子流色譜圖(TIC),根據TIC圖通過NIST標準譜庫檢索,確定各目標物的保留時間,并在扣除背景后的質譜圖中,選擇豐度高、m/z大且基質干擾少的特征離子,分時段分別監測。18種PCBs的保留時間、特征離子及其豐度比見表1。最優條件下的GC-MS色譜圖見圖1。
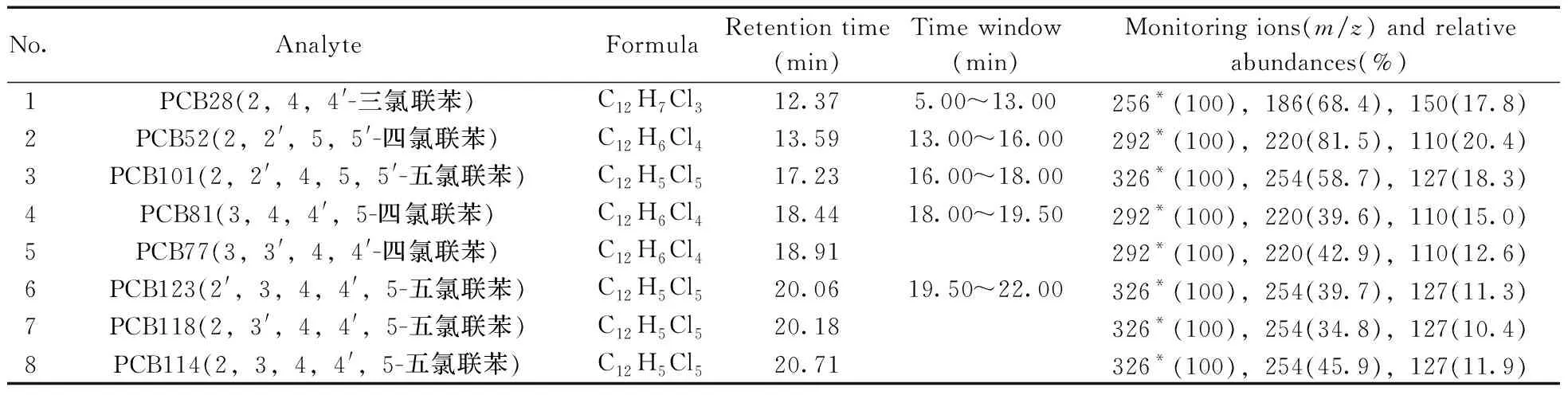
表1 18種PCBs的分子式、保留時間、特征離子及其相對豐度Table 1 Formulas,retention times,characteristic ions and relative abundances of 18 PCBs
(續表1)
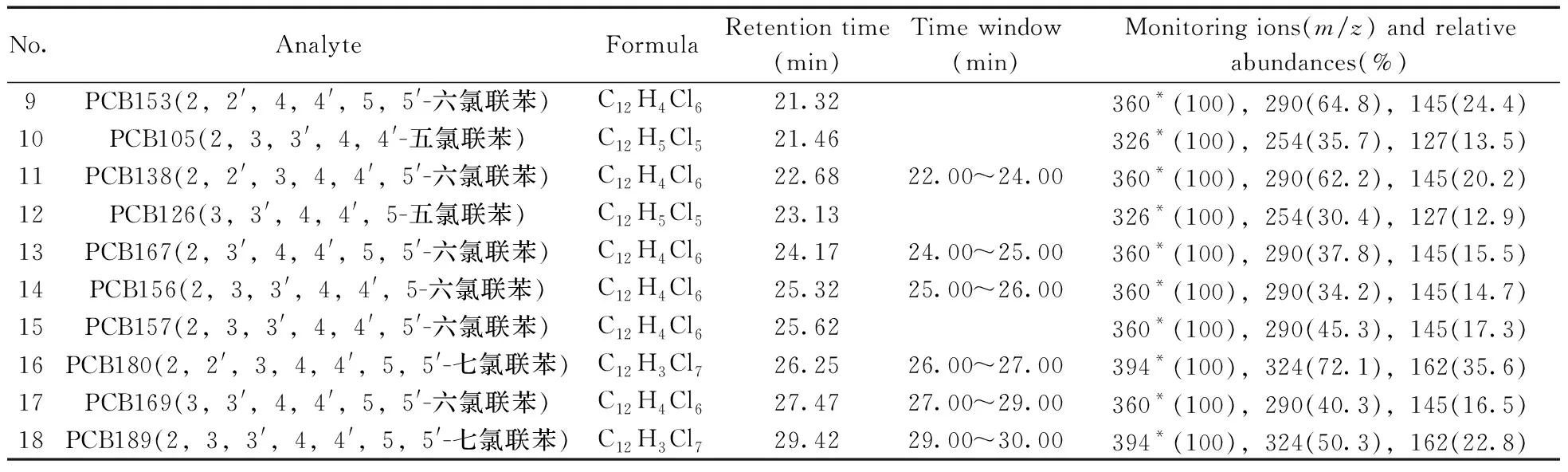
No.AnalyteFormulaRetention time(min)Time window (min)Monitoring ions(m/z) and relative abundances(%)9PCB153(2,2',4,4',5,5'-六氯聯苯)C12H4Cl621.32360*(100),290(64.8),145(24.4)10PCB105(2,3,3',4,4'-五氯聯苯)C12H5Cl521.46326*(100),254(35.7),127(13.5)11PCB138(2,2',3,4,4',5'-六氯聯苯)C12H4Cl622.6822.00~24.00360*(100),290(62.2),145(20.2)12PCB126(3,3',4,4',5-五氯聯苯)C12H5Cl523.13326*(100),254(30.4),127(12.9)13PCB167(2,3',4,4',5,5'-六氯聯苯)C12H4Cl624.1724.00~25.00360*(100),290(37.8),145(15.5)14PCB156(2,3,3',4,4',5-六氯聯苯)C12H4Cl625.3225.00~26.00360*(100),290(34.2),145(14.7)15PCB157(2,3,3',4,4',5'-六氯聯苯)C12H4Cl625.62360*(100),290(45.3),145(17.3)16PCB180(2,2',3,4,4',5,5'-七氯聯苯)C12H3Cl726.2526.00~27.00394*(100),324(72.1),162(35.6)17PCB169(3,3',4,4',5,5'-六氯聯苯)C12H4Cl627.4727.00~29.00360*(100),290(40.3),145(16.5)18PCB189(2,3,3',4,4',5,5'-七氯聯苯)C12H3Cl729.4229.00~30.00394*(100),324(50.3),162(22.8)
* quantitative ion
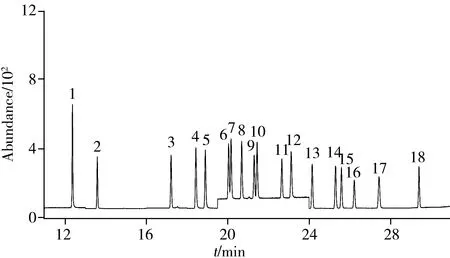
圖 1 18種PCBs標準溶液(10 μg/L)的選擇離子色譜圖Fig.1 SIM chromatogram of 18 PCBs(10 μg/L) standard solution the number denoted was the same as that in Table 1
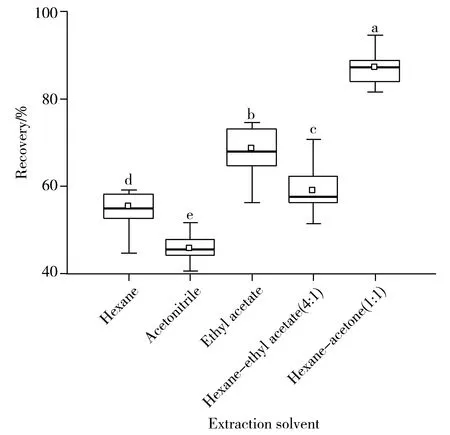
圖2 不同提取溶劑對茶青中18種PCBs加標回收率的影響Fig.2 Effects of different extraction solvents on recoveries of 18 PCBs spiked in fresh tea leaves different lowercase letters denote significant differences at p-value <0.05 among groups using one-way analysis of variance tests
2.2 提取條件的選擇
2.2.1提取溶劑的選擇以碧螺春茶青為基質,在10 μg/kg加標水平下,分別采用正己烷、乙腈、乙酸乙酯、正己烷-丙酮(1∶1)、正己烷-乙酸乙酯(4∶1)作為提取溶劑,比較了18種目標物的提取效率(圖2)。結果表明,以正己烷、乙腈或正己烷-乙酸乙酯(4∶1)為提取溶劑時,回收率為37%~76%,且大多數目標物的回收率小于60%;用乙酸乙酯提取時,除PCB138的回收率大于80%外,其余目標物均在56%~75%之間,而以正己烷-丙酮(1∶1)為提取溶劑時,目標物的整體提取效率最好,回收率為81%~95%,因此實驗選擇正己烷-丙酮(1∶1)作為最佳提取溶劑。在此基礎上,考察了提取溶劑體積(5、8、10、12、15 mL)對目標物回收率的影響。結果顯示,當提取溶劑體積為5 mL時,18 種目標物的提取效率較低,回收率大多在70%左右,隨著提取溶劑體積的增大,目標物的提取效率增加,當提取溶劑體積為15 mL時提取效率最佳,回收率為86%~104%,因此選擇15 mL為最佳提取溶劑體積。
2.2.2提取方式的選擇超聲提取法具有條件溫和、速度快、批處理能力強的特點,其獨特的空化作用和機械振動作用可達到強化提取、提高效率的效果,因此實驗采用超聲提取法進行前處理,并以加標水平10 μg/kg的碧螺春茶青為基質,考察了不同超聲提取時間(5、10、15、20 min)對目標物回收率的影響。結果表明,當超聲提取時間為5 min時,18種目標物的回收率為54%~72%,回收率隨著超聲提取時間的增加而增大,超聲提取15 min和20 min時回收率分別為94%~116%和92%~117%。綜合考慮回收率和分析時間,實驗選擇超聲提取時間為15 min。
2.3 凈化條件的選擇
2.3.1吸附劑種類與用量的選擇實驗考察了Florisil、C18、PSA、GCB、MWCNTs、MWCNTs-OH、MWCNTs-COOH 7種凈化吸附劑對茶青提取液中色素的去除效果。結果顯示,茶青經提取后,溶液呈淺綠色渾濁狀;分別經Florisil、C18、PSA吸附劑凈化后,溶液顏色變化不大;經GCB 吸附劑凈化后呈黃綠色;碳納米管對色素具有良好的吸附去除作用,提取液經3種碳納米管凈化后趨于無色,其中MWCNTs-COOH對色素的凈化效果最好,凈化后溶液無色透明。PSA對色素的去除能力較弱,但能有效去除茶多酚和兒茶素類物質[22]。因此,本實驗將MWCNTs-COOH和PSA混合使用對茶青提取液進行凈化,以有效除去提取液中的色素、茶多酚、兒茶素等雜質成分。
吸附劑用量是影響樣品凈化效果和目標物回收率的重要因素,用量小則凈化效果不明顯,用量大則回收率偏低,不能滿足分析要求。實驗發現,在加標水平10 μg/kg的茶青提取液中,當加入MWCNTs-COOH凈化處理后,僅PCB52、PCB101、PCB153、PCB138、PCB180 的回收率大于82%,其余13種目標物的回收率較差,均低于64%,其中PCB81、PCB77、PCB126、PCB169 4種目標物的回收率為0,說明MWCNTs-COOH在去除色素的同時,對部分PCB產生了強烈吸附,從而導致回收率偏低。實驗在提取后濃縮過程中,以甲苯對提取劑正己烷-丙酮(1∶1)進行溶劑置換后再凈化,發現目標物的回收率由0%~85%增至97%~104%。進一步考察了甲苯用量(2、3、4、5、6 mL)對目標物凈化回收率的影響。結果顯示,隨著甲苯用量的增加,目標物的回收率呈增大趨勢,當其用量為5 mL時回收率為90%~110%,繼續增大甲苯用量至6 mL時,部分目標物(PCB153、PCB167、PCB156、PCB157)的回收率大于115%,可能是由于雜質被溶解而引起基質效應所致。因此,選擇甲苯的最佳用量為5 mL。
以加標水平10 μg/kg的碧螺春茶青為基質,按“1.3.2”方法進行前處理,比較了不同MWCNTs-COOH用量(0.07、0.08、0.09、0.10、0.11 g)對目標物回收率的影響。結果顯示,MWCNTs-COOH對提取液色素的凈化效果顯著,隨著其用量的增大,提取液顏色逐漸變淺,目標物回收率呈下降趨勢,當用量為0.09 g時,提取液顏色趨于澄清透明,且所有目標物的回收率均在95%~102%之間。因此,選擇MWCNTs-COOH的最佳用量為0.09 g。
繼續考察了PSA用量(0.05、0.06、0.07、0.08、0.09 g)對茶青提取液的凈化效果。結果表明,茶青提取液經不同質量的PSA凈化后,溶液顏色仍較深且變化不大,且隨著PSA用量的增加,大部分目標物的回收率逐漸降低;當PSA用量為0.05 g時,所有目標物的回收率均在92%~101%之間,因此選擇PSA的最佳用量為0.05 g。
2.3.2吸附凈化時間的選擇吸附凈化時間會對目標物的回收率和凈化效果產生影響。實驗以加標水平10 μg/kg的碧螺春茶青為基質,按“1.3.2”方法,將渦旋振蕩時間分別設為1、2、3、4 min,考察了吸附凈化時間對目標物回收率的影響。結果表明,當凈化時間為2 min時,目標物的整體回收率較好,為97%~109%。繼續延長凈化時間,部分目標物易被吸附劑吸附,導致回收率下降。因此,實驗選擇最佳吸附凈化時間為2 min。
2.4 基質效應
基質效應普遍存在于痕量物質的分析中,可增強或減弱目標物的信號,影響檢測結果的準確度。本實驗以基質匹配標準曲線斜率與純溶劑標準曲線斜率的比值評價基質效應,當比值為0.9~1.1時,說明基質效應不明顯,可以忽略;當比值大于1.1或小于0.9時,表明存在基質增強或減弱效應[23]。由表2可知,PCB28和PCB52在茶青基質中的基質效應不明顯,其余目標物在茶青基質中均存在基質增強效應,標準曲線斜率的比值為1.105~1.130。因此,本方法在實際樣品的檢測中均采用基質匹配標準曲線定量,以降低基質效應的影響。
2.5 線性范圍、檢出限及定量下限
按照“1.3.1”分別配制5、10、50、100、500 μg/kg的基質標準工作溶液,按“1.3.3”分析條件進樣測定,以各目標物的峰面積(y)為縱坐標,含量(x,μg/kg)為橫坐標進行線性回歸,線性方程及相關系數(r)如表2所示。結果表明,在5~500 μg/kg范圍內,18 種目標物的峰面積與其含量呈線性關系,相關系數為0.999 8~1.000 0。在空白基質中添加不同含量的標準溶液進行樣品前處理和測定,以特征離子色譜峰的信噪比(S/N)≥3確定方法的檢出限(LOD)為0.5~1.4 μg/kg,以S/N≥10且回收率滿足要求的最小加標濃度為定量下限(LOQ),各目標物的LOQ均為5 μg/kg(表2)。
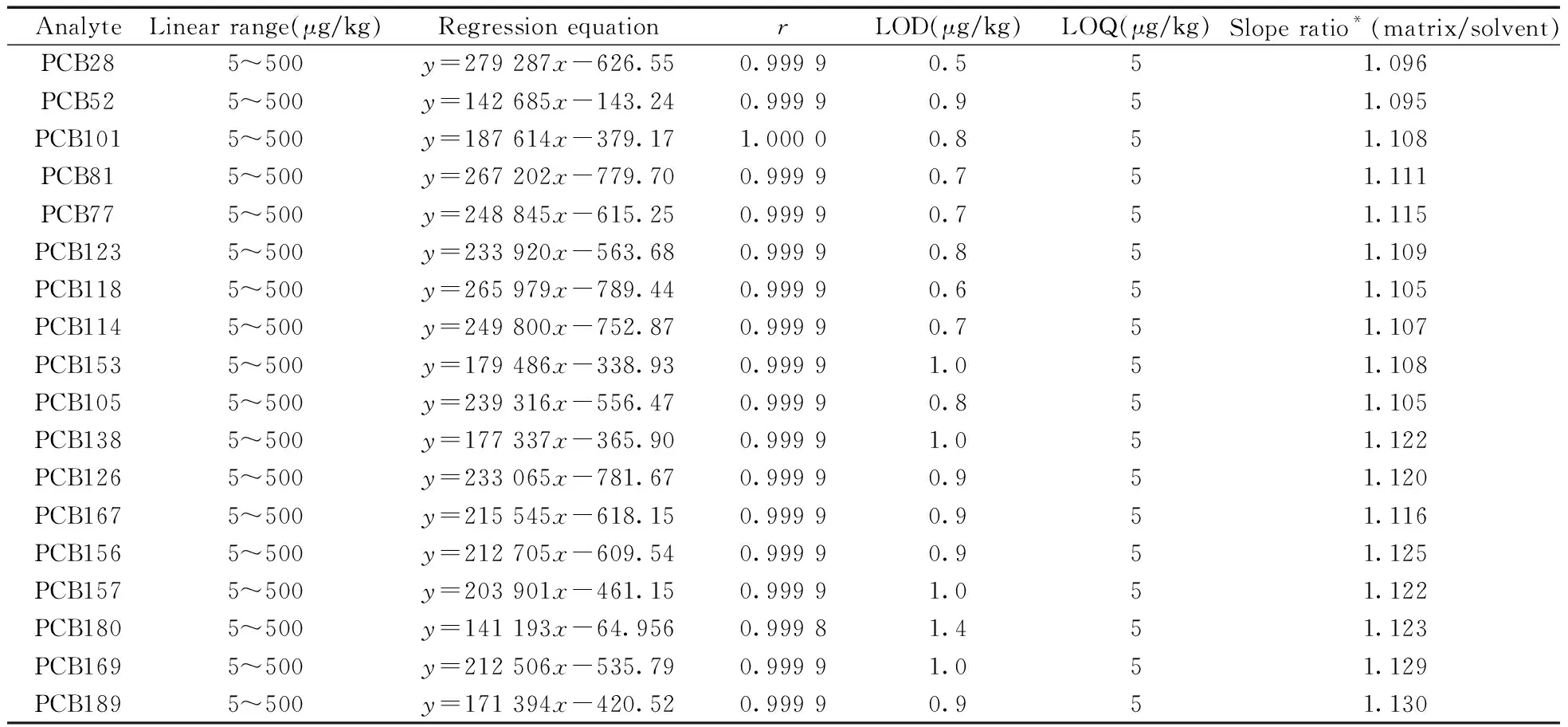
表2 18種PCBs的線性范圍、基質標準曲線、相關系數(r)、檢出限(LODs)、定量下限(LOQs)及基質效應Table 2 Linear ranges,matrix standard curves,correlation coefficients(r),LODs,LOQs and matrix effects of 18 PCBs
*slope ratio=the calibration curve slopes of matrix-matched standards/the calibration curve slopes of solvent standards
2.6 回收率與精密度
在空白茶青基質中,分別添加5、10、100 μg/kg的18種PCBs混合標準溶液,混勻后靜置得到加標樣品,按照“1.3.2”和“1.3.3”進行前處理和測定,每個濃度水平重復6次,計算回收率和相對標準偏差(RSD),結果見表3。在3個加標水平下,18種PCB的平均回收率為92.3%~111%,RSD為1.2%~7.9%,方法的準確度高、精密度好。
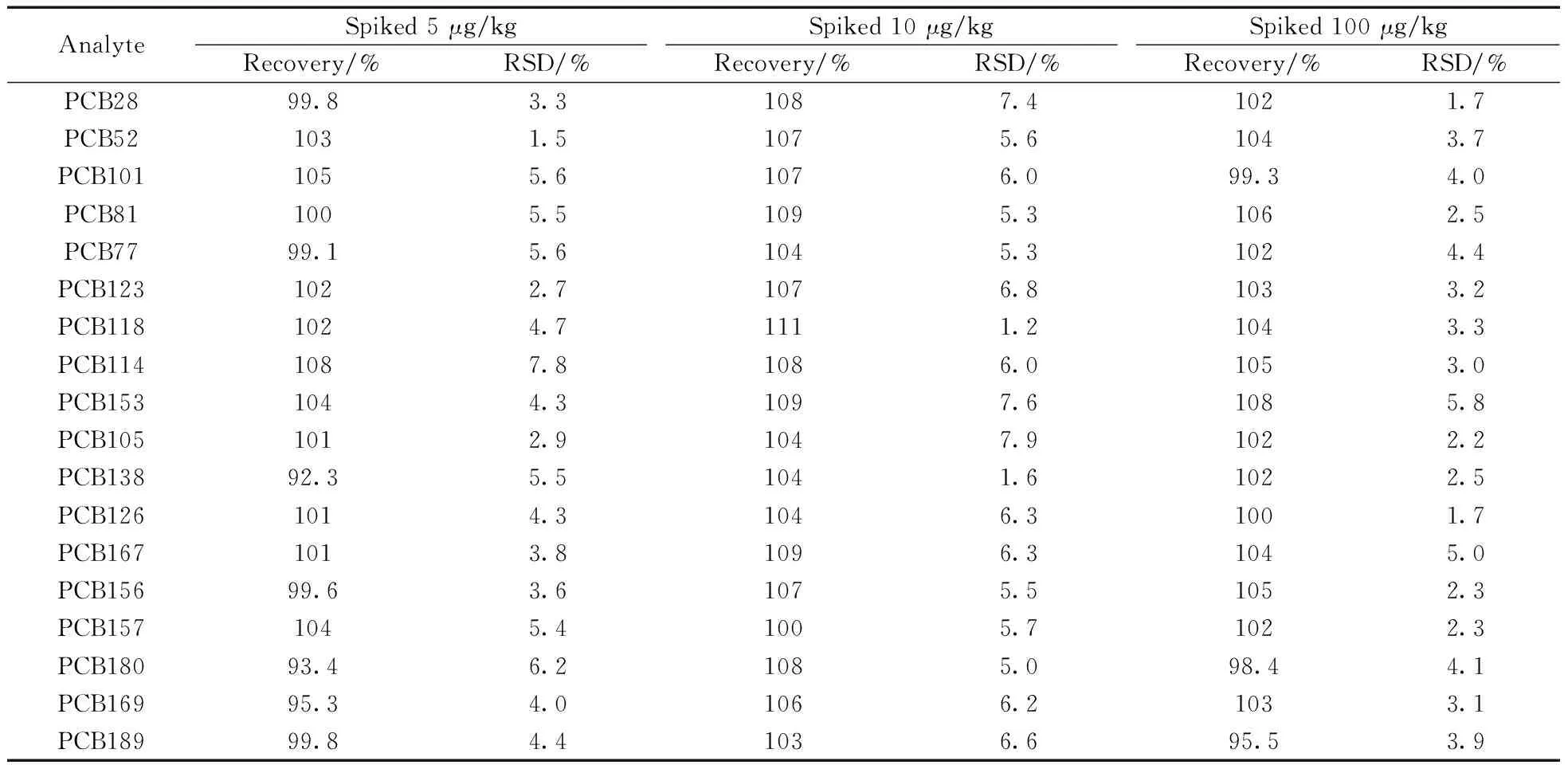
表3 18種PCBs在茶青中的平均回收率及相對標準偏差(n=6)Table 3 Average recoveries and relative standard deviations (RSD) of 18 PCBs in spiked fresh tea leaves(n=6)
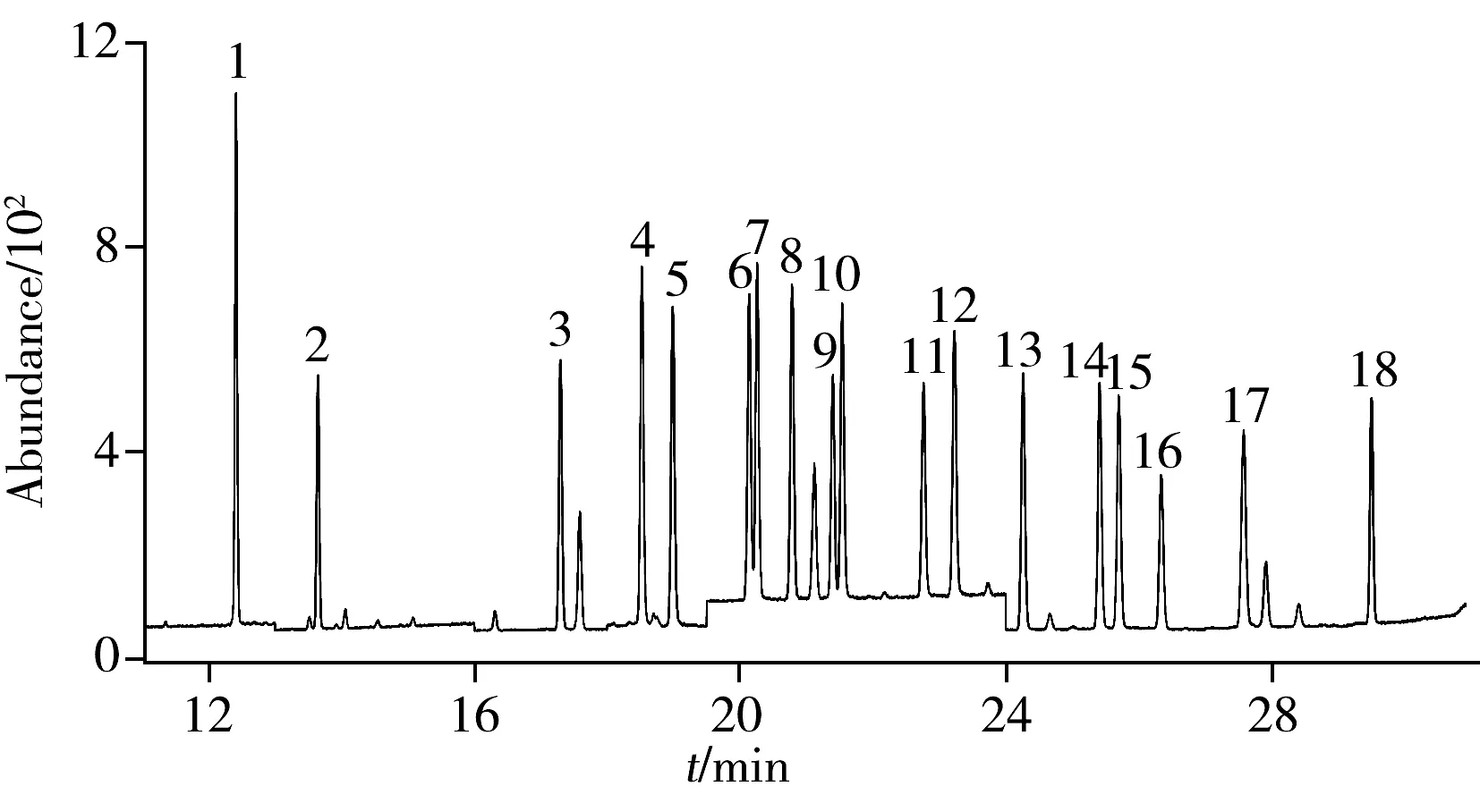
圖 3 茶青樣品添加18種PCBs的選擇離子色譜圖Fig.3 SIM chromatogram of 18 PCBs spiked in fresh tea leaves the number denoted was the same as that in Table 1
2.7 方法的應用
將建立的方法應用于蘇州洞庭東山和西山、常熟虞山等茶青樣品中18種PCBs的檢測,在所有樣品中均未檢出PCBs。圖3為加標樣品的選擇離子色譜圖,可以看出,本方法能很好地應用于茶青中18種PCBs的檢測。
3 結 論
本文建立了茶青中18種PCBs的分散固相萃取凈化及GC-MS檢測方法。茶青樣品經正己烷-丙酮(1∶1)混合溶液提取,甲苯溶劑置換后,以MWCNTs-COOH和PSA混合吸附劑凈化,有效地減少了基質中色素等雜質干擾,可獲得較好的提取效率和凈化效果,18種目標物的LOD為0.5~1.4 μg/kg,LOQ均為5 μg/kg。該方法操作簡單,凈化效果好,準確度高,穩定性好,為開展茶青中PCBs的檢測研究提供了有效方法,對于保證茶葉質量安全具有積極的意義。

