多主棒孢SdhB-H278R突變位點AS-real-time PCR定量檢測體系的建立
孫炳學,石延霞,朱發娣,謝學文,柴阿麗,李寶聚
?
多主棒孢SdhB-H278R突變位點AS-real-time PCR定量檢測體系的建立
孫炳學,石延霞,朱發娣,謝學文,柴阿麗,李寶聚
(中國農業科學院蔬菜花卉研究所,北京 100081)
【目的】建立一種快速、高效、定量檢測黃瓜多主棒孢()琥珀酸脫氫酶B亞基()H278R突變的實時熒光定量PCR(AS-real-time PCR)檢測方法,并進行效果驗證。【方法】從北京市大興區采集、分離純化病原菌,獲得24株多主棒孢的單孢菌株,采用菌絲生長速率法測定其對啶酰菌胺的EC50,隨機選取4株敏感(S)和8株抗性(R)菌株測其菌絲生長速率、產孢量和致病性。采用引物對Cc-SdhB-F/R測定多主棒孢基因序列,檢測的堿基變化。基于多主棒孢的相同核酸序列和SNP位點設計內參引物B-H278R-TY-F/R和特異性引物B-H278R-2F/2R14,建立并優化AS-real-time PCR定量檢測體系,并對引物的特異性、熔解曲線和靈敏度進行評價。利用該體系分別檢測含有H278R不同突變比例的DNA和孢子懸浮液。【結果】測定的24個菌株中,敏感菌株占66.7%,EC50值為0.057—0.563 μg·mL-1;抗性菌株占33.3%,EC50值為5.395—11.710 μg·mL-1。抗性和敏感菌株僅在菌絲生長速率方面存在顯著性差異,且菌絲生長速率與EC50之間存在顯著負相關。在產孢量和致病性方面不存在顯著性差異。測序分析發現抗性菌株均攜帶SdhB-H278R突變。本研究設計的引物B-H278R-2F和B-H278R-2F2R14特異性強,僅對多主棒孢SdhB-H278R突變菌株的DNA有擴增條帶,對其余供試菌株均無條帶擴增。普通AS-PCR檢測的靈敏度為91 pg·μL-1, 而AS-real-time PCR的靈敏度可達9.1 pg·μL-1,靈敏度為普通AS-PCR的10倍。以基因組DNA為標準品,構建的AS-real-time PCR標準曲線ΔCT值與相對模板濃度的對數有良好的線性關系,相關系數為0.9857, 擴增效率為92.59%。熔解曲線吸收峰單一,內參引物B-H278R-TY-F/R和特異性引物B-H278R-2F/2R14分別在87.81℃和91.62℃處出現單一特異性峰。用DNA和孢子懸浮液對標準曲線進行驗證,結果表明隨著相對模板濃度逐漸降低,該檢測體系的準確性逐漸升高且檢測下限為5%,同時預期值與試驗值呈線性相關(2=0.9998和2=0.9922)。【結論】建立了一種高效、定量、快速的AS-real-time PCR檢測體系用于SdhB-H278R突變位點的檢測,可為殺菌劑的抗性治理提供理論依據。
黃瓜;多主棒孢;AS-real-time PCR;抗藥性;琥珀酸脫氫酶B亞基;啶酰菌胺
0 引言
【研究意義】多主棒孢()隸屬于格孢菌目(Pleosporales)棒孢科(Corynesporascaceae)棒孢屬(),由其引起的黃瓜棒孢葉斑病發生普遍,該病害在溫室、大棚和露地中均不斷加重,已成為黃瓜栽培中主要的病害之一[1]。目前大多采用化學藥劑防治黃瓜棒孢葉斑病,由于多主棒孢繁殖速度快、遺傳變異大,加之多年連續使用單一藥劑防治,導致其對苯并咪唑類、二羧酰亞胺類、-苯氨基甲酸酯類和QoI類的大部分殺菌劑產生了抗藥性[2-3]。啶酰菌胺是德國巴斯夫公司1996年開發的新型煙酰胺類內吸性殺菌劑,該藥劑能夠阻斷電子在復合體II琥珀酸脫氫酶[3Fe-4S]結構域與泛醌之間的傳遞,從而影響病原真菌的電子傳遞,阻礙病原菌的能量代謝[3-4]。因該藥劑作用位點單一,FRAC已將其歸為中度抗性風險殺菌劑。自2008年啶酰菌胺在中國登記防治灰霉病并在黃瓜栽培中大量使用,間接導致多主棒孢對啶酰菌胺產生抗藥性,出現大量的抗性突變株,因此,建立一種快速、準確、定量的多主棒孢SdhB-H278R突變檢測方法,對監測啶酰菌胺田間的抗性頻率和病害防治具有重要意義。【前人研究進展】隨著啶酰菌胺的廣泛使用,在不同蔬菜和作物上出現了對啶酰菌胺有抗性的病原菌。2007年,首次在開心果上發現了對啶酰菌胺產生抗性的鏈格孢()[5],之后在灰葡萄孢()、小雙胞腔菌()和核盤菌()上也發現了對啶酰菌胺產生抗性的菌株[6-8]。2009年,Miyamoto等[9]在黃瓜上發現了對啶酰菌胺產生抗性的多主棒孢并在2010[10]年發現了SdhB-H278R/Y、SdhC-C73P、SdhD-S89P和SdhD-G109V等多種抗性突變類型,且SdhB-H278R基因型在田間的頻率為0.64%。傳統的抗藥性檢測方法包括離體測定和活體測定法,其中離體測定法主要有菌落生長速率法和孢子萌發法,均是通過測定藥劑對植物病原菌的EC50值以區分敏感和抗性菌株,比較費時費力。近年來,隨著分子生物學技術的發展,PCR-RFLP(restriction fragment length polymorphism PCR)、AS-PCR(allele specific PCR)、AS-real-time PCR、HRM(high resolution melting)和多重等位基因PCR等分子鑒定手段廣泛應用于植物病原菌對藥劑的抗藥性檢測。Furuya等[11]和Aoki等[12]在霜霉病菌()上分別建立了對QoI殺菌劑抗性Cytb-G143A和對CAA殺菌劑PvCesA3-G1105S突變位點PCR-RFLP的檢測體系。基于等位基因特異性核苷酸引物,AS-PCR和AS-real-time PCR抗藥性檢測技術已在核盤菌、茄鏈格孢()、大麥云紋病菌()和灰葡萄孢等病原菌上應用[13-16]。最近,新興的HRM抗藥性檢測技術因具有高通量、快速的特點并可用于SNP位點的篩選,已開始在核盤菌對甲基硫菌靈和灰葡萄孢對環酰菌胺以及啶酰菌胺的抗藥性檢測上應用[17-18],準確性高達100%,但該方法只能定性檢測。【本研究切入點】目前為止尚未建立一種檢測多主棒孢抗性突變位點的檢測體系,基于筆者課題組前期發現的一種抗啶酰菌胺的黃瓜多主棒孢SdhB-H278R抗性突變位點,使用熒光定量PCR儀,建立一種定量、高效、快速檢測該突變位點的AS-real-time PCR體系,并對此體系的特異性、可重復性和靈敏度進行評價。【擬解決的關鍵問題】建立一種定量、高效、快速檢測黃瓜多主棒孢SdhB-H278R突變位點的AS-real-time PCR體系,以期為該病原菌對啶酰菌胺的田間抗性檢測和病害防控提供更好的技術支持。
1 材料與方法
試驗于2017年3月至2018年4月在中國農業科學院蔬菜花卉研究所完成。
1.1 試驗材料
1.1.1 菌株 2017年3月從北京市大興區采集黃瓜多主棒孢葉斑病病樣,在室內進行分離培養,單孢純化后得到24株多主棒孢菌株,其他5株多主棒孢菌株采自河北和遼寧。所有菌株由中國農業科學院蔬菜花卉研究所蔬菜病害綜合防治課題組提供。
1.1.2 試劑和培養基 96%啶酰菌胺原藥(陜西美邦農藥有限公司)、植物組織DNA提取試劑盒、SuperReal PreMix Plus(天根生化科技(北京)有限公司),2×Taq MasterMix (北京博邁德生物技術有限公司)、PDA培養基、YBA培養基。
1.1.3 主要儀器設備 NanoDrop2000超微量分光光度計(Thermo Fisher Scientific Inc.,USA)、3-18K型離心機(Sigma,德國)、7500 Real time PCR system(ABI,美國)、S1000 Thermal Cycle PCR儀(BIO- RAD,美國)。
1.1.4 引物合成測序 熒光定量PCR和普通PCR所用引物及基因序列由北京博邁德基因技術有限公司合成并測定。
1.2 方法
1.2.1 多主棒孢對啶酰菌胺敏感性的測定 參照Miyamoto等[9]方法,采用菌絲生長速率法測定北京大興24株及河北、遼寧的5株多主棒孢對啶酰菌胺的敏感性。抗藥性測定設置7個濃度梯度(0、0.01、0.1、1、5、10、30 μg·mL-1),以不加藥劑為空白對照;在新鮮的菌落邊緣打取直徑5 mm的菌餅,接種于含藥培養基的平板上,在26℃黑暗培養5 d,測量菌落直徑,每個處理重復3次。比較試驗組和對照組的菌落直徑,并計算EC50值、毒力回歸方程和相關系數。根據Miyamoto等[9]的敏感基線(0.04—0.59 μg·mL-1)判定多主棒孢對啶酰菌胺的敏感性。
1.2.2 抗性和敏感菌株的生物學特性測定 菌絲生長速率的測定:從24株多主棒孢菌中隨機選取4株敏感菌株和8株抗性菌株作為測定生物學特性的菌株。在多主棒孢菌生長5 d的PDA平板上制備5 mm的菌餅,采用滅菌牙簽將菌碟菌絲面朝下貼于PDA平板中央,密封后置于26℃培養。分別于第2—11天,采用十字交叉法測量菌落生長直徑。每個菌株3次重復,試驗重復2次。
產孢能力的測定:待多主棒孢菌生長至第11天,用直徑5 mm的打孔器在菌落邊緣打取5個菌餅置于1 mL的無菌水中,加入5個直徑2 mm的研磨珠用渦旋振蕩機振蕩2 min洗脫分生孢子,用血球計數板計數計算分生孢子的濃度。每個菌株3次重復,試驗重復2次。
致病性的測定:采集離體組織測定法,采集葉齡一致,形狀、大小相似的健康黃瓜葉片,用滅菌的接種針刺破形成微傷口。將制備好直徑5 mm的菌餅分別接種于黃瓜葉片,接種后放置于保鮮盒中,置于相對濕度85%,自然光照的26℃溫室中,培養5 d后采用十字交叉法測量病斑直徑。每個菌株測6片葉片,試驗重復2次。
1.2.3 DNA提取 將多主棒孢接種到PDA平板培養5 d,刮取菌絲作為DNA提取樣本。采取植物組織DNA提取試劑盒,根據試劑盒中的說明書提取DNA,提取后用NanoDrop 2000c測定DNA濃度,用ddH2O稀釋至40 ng·μL-1,4℃保存備用。
1.2.4 AS-real-time PCR定量檢測體系的建立序列測定:根據GenBank多主棒孢序列(AB548739.1), 應用Primer Premier 5.0設計引物Cc-SdhB-F和Cc-SdhB-R(表1),以表2中所有多主棒孢的DNA為模板,用Cc-SdhB-F和Cc-SdhB-R引物擴增基因片段,PCR產物進行測序。50 μL PCR體系:2×Taq PCR MasterMix 25 μL,Cc-SdhB-F和Cc-SdhB-R引物2 μL,模板DNA 2 μL,ddH2O補足50 μL。PCR反應程序:94℃ 5 min,94℃ 45 s,58℃ 45 s,72℃ 90 s,步驟2—4進行30個循環,72℃ 10 min。
引物設計:根據的測序信息,針對SNP位點和相同的序列信息,用Primer Premier 5.0設計特異性引物B-H278R-2F/2R14和內參引物B-H278R- TY-F/R(表1),引物設計策略和引物信息如圖1和表1所示。為增加引物的特異性,引物3′端與突變堿基G配對,在靠近3′端的第2、3位引入錯配堿基[13-16,19]。
通過對全球自動駕駛技術領域專利市場進行研究,發現當前自動駕駛技術專利申請數量逐年上升,研發熱情逐年高漲。但從技術角度出發,目前從L3有條件自動駕駛階段邁向未來L5完全無人駕駛階段仍需要很長的過程和時間。本文從專利時間分布、專利空間分布、專利內容分布這三大角度出發,全面揭示了全球自動駕駛技術的發展趨勢、技術公開國家、技術來源國家、技術研發機構、技術研究方向、研究熱點等情況,最終總結出以下6點結論,期望為自動駕駛技術的發展提供決策參考。

圖1 引物設計策略

表1 引物信息
單下劃線Single underline:突變位點Mutation site;雙下劃線double underline:人為錯配堿基additional mismatched base
引物特異性檢測:以含有H278R突變、其他點突變菌株以及常見的8種植物病原菌DNA為模板,以ddH2O為陰性對照,用引物B-H278R-2F和B-H278R-2R14進行PCR擴增,檢測引物特異性。20 μL PCR反應體系:2×Taq PCR MasterMix 10 μL,引物B-H278R-2F和B-H278R-2R14 0.4 μL,模板DNA 1.6 μL,ddH2O補足10 μL。PCR反應程序:94℃ 5 min,94℃ 45 s,65℃ 45 s,72℃ 30 s,步驟2—4進行35個循環,72℃ 10 min。PCR產物經1%瓊脂糖凝膠電泳檢測后,凝膠成像系統分析結果。
標準曲線的建立:為了定量檢測多主棒孢SdhB- H278R突變株在田間的比例,以含有H278R突變菌株(R278)和不含有H278R突變菌株(H278)的混合DNA作為模板,以R278 DNA摩爾質量分別占總量DNA的6.25%、12.5%、25%、50%、75%和100%作為不同的處理,3次重復,分別用特異性引物B-H278R-2F/2R14和內參引物B-H278R-TY-F/R在7500 real-time PCR system儀中進行AS-real-time PCR,計算ΔCT(ΔCT=CT特異性引物-CT內參引物),以ΔCT值為縱坐標,以R278 DNA相對摩爾質量的對數為橫坐標,制作標準曲線。
20 μL反應體系:2×SuperRealPreMix Plus 10 μL,50×ROX Reference Dye 0.4 μL,上游引物和下游引物各1 μL,模板DNA 40 pg,RNase-free ddH2O補足20 μL,AS-real-time PCR反應程序:95℃ 15 min;95℃ 10 s;60℃ 32 s,40個循環;95℃ 15 s;60℃ 1 min;60℃開始,每個循環增加0.35℃,100個循環,60℃ 15 s。
普通PCR和AS-real-time PCR靈敏度檢測:將定量的R278基因組DNA按濃度進行10倍梯度稀釋,用引物B-H278R-2F和B-H278R-2R14進行普通PCR和AS-real-time PCR擴增,檢測引物的靈敏度。
1.2.5 AS-real-time PCR定量檢測體系的驗證 DNA驗證:以R278和H278混合DNA作為模板,以R278 DNA摩爾質量分別占總量DNA的80%、40%、20%、10%和5%作為不同的處理,3次重復。按照已建立的AS-real-time PCR體系驗證標準曲線的可行性。用Excel計算標準差以及與預期值和檢測值之間的線性相關性。
孢子懸浮液驗證:將R278和H278菌株26℃下培養11 d,用0.1%的吐溫20刷下孢子懸浮液并用三層紗布過濾得到孢子懸浮液。用血球計數板調節孢子濃度為1×105個/mL,配置混合孢子懸浮液,其中以H278孢子數量分別占混合孢子數的80%、40%、20%、10%和5%作為不同的處理,12 000 r/min離心,收集沉淀,用植物組織DNA提取試劑盒提取不同處理的DNA。按照已建立的AS-real-time PCR體系驗證標準曲線的可行性。用Excel計算標準差以及與預期值和檢測值之間的線性相關性。
2 結果
2.1 多主棒孢對啶酰菌胺的敏感性測定
采用菌絲生長速率法測定采集的多主棒孢對啶酰菌胺的敏感性,結果表明,采自北京的24株多主棒孢分為敏感和抗性2個群體,其中敏感菌株16株,占66.7%,其EC50值為0.057—0.563 μg·mL-1,平均值為0.368 μg·mL-1。抗性菌株8株,占33.3%,其EC50值為5.395—11.710 μg·mL-1,平均值為7.586 μg·mL-1(圖2、表2)。
2.2 抗性和敏感菌株的生物學特性
隨機選取的12株多主棒孢之間的平均菌絲生長速率存在差異,敏感菌株菌絲生長速率為0.49—0.61 cm·d-1,抗性菌株菌絲生長速率為0.30—0.56 cm·d-1(表3)。與敏感菌株相比,抗性菌株除第9天的菌絲生長速率相等外,其他時間段均比敏感菌株生長慢(圖3),且抗性菌株的平均生長速率與敏感菌株差異極顯著(<0.01)。菌絲生長速率與EC50之間呈顯著負相關(表4)。
由表3可見,敏感菌株的產孢量在0.33×105—7.00×105個/mL,抗性菌株的產孢量在1.33×105—7.46×105個/mL,抗性菌株和敏感菌株在產孢量上不存在顯著差異(0.949)。產孢量與生長速率和致病性存在低度相關,但不顯著(表4)。
敏感菌株的病斑直徑在0.38—0.84 cm,抗性菌株的病斑直徑在0.33—0.91 cm。抗性和敏感菌株在致病性上不存在顯著差異(表3)。致病性與產孢量和生長速率之間存在低度相關性,但不顯著(表4)。

圖2 24株多主棒孢菌的敏感性分布

圖3 抗性和敏感菌株菌絲生長速率比較
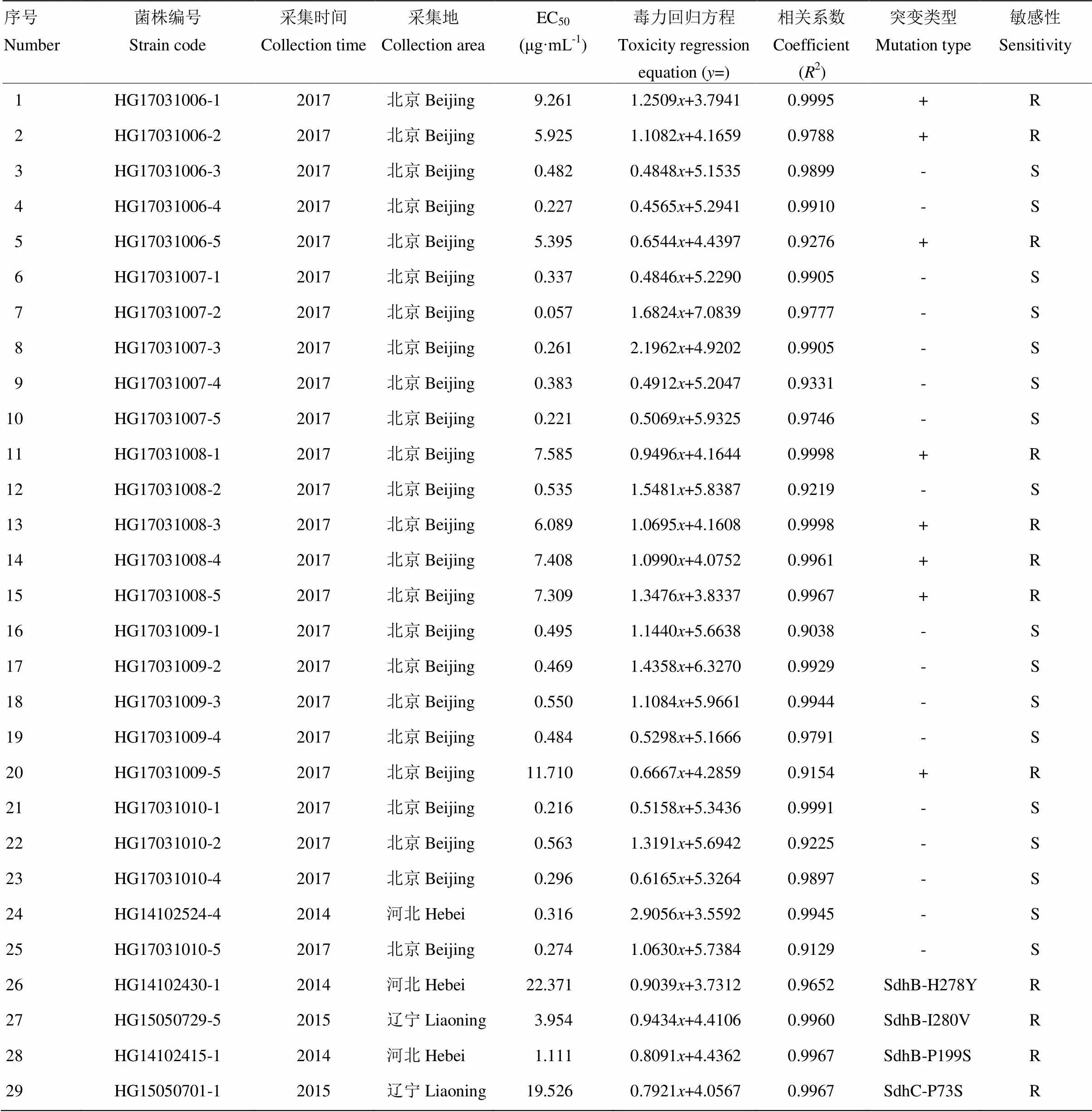
表2 供試菌株敏感性測定
+:有SdhB-H278R突變Carried SdhB-H278R mutation;-:無SdhB-H278R突變No SdhB-H278R mutation;R:抗性菌株resistant strain;S:敏感菌株sensitive strain
2.3 AS-real-time PCR定量檢測體系的建立
應用引物Cc-SdhB-F和Cc-SdhB-R測定的序列,結果如圖4 所示,抗性菌株(R)在第956位的A突變到G,導致在密碼子的第278組氨酸(H)突變成精氨酸(R),進一步發現含有H278R突變的菌株對啶酰菌胺具有抗性。
以攜帶不同點突變的多主棒孢和8株常見的病原菌基因組DNA為模板,采用引物B-H278R-2F和B-H278R-2R14進行特異性驗證(圖5),結果表明僅有攜帶SdhB-H278R突變的多主棒孢基因組DNA有擴增條帶,大小為244 bp,攜帶其他點突變的多主棒孢以及8種病原菌DNA均未檢測到擴增條帶,可用于不同菌種間多主棒孢H278R基因型的檢測。
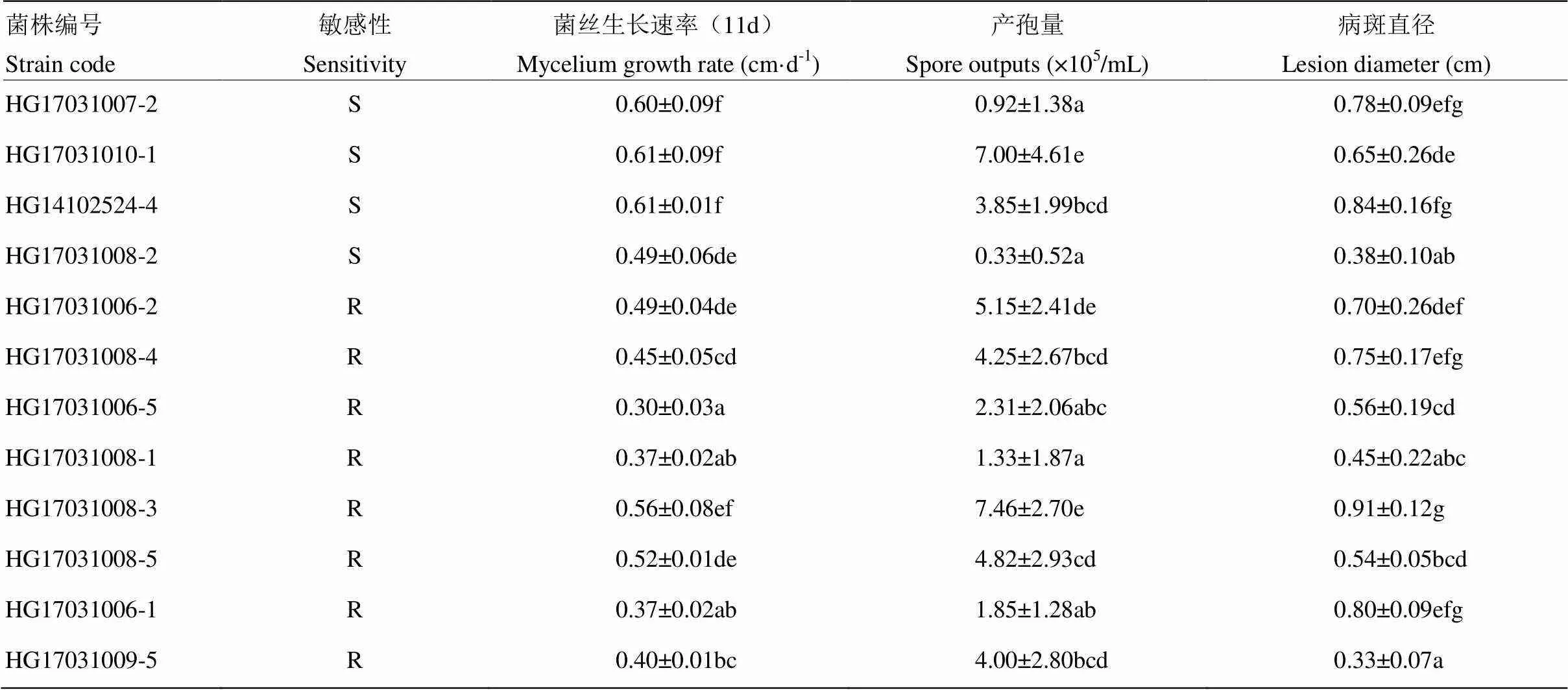
表3 抗性和敏感菌株的生物學特性
表中數據為平均值±標準差。表5同Data aremean±standard deviation. The same as Table 5根據Duncan’s最小顯著性差異測定,同列數值后不同字母表示差異顯著(<0.05)According to a Duncan’s least-signi?cant difference, different lowercases after data in the same column indicate significant difference (<0.05)

圖4 在SdhB上抗性和敏感菌株的核酸序列和氨基酸序列信息

M:分子量標準BM5000 Molecular weight marker BM5000;1:SdhB-H278R突變SdhB-H278R mutation;2:無突變no mutation;3:SdhB-H278Y突變SdhB-H278Y mutation;4:SdhB-I280V突變SdhB-I280V mutation;5:SdhB-P199S突變SdhB-P199S mutation;6:SdhC-S73P突變SdhC-S73P mutation;7:黃瓜葉片cucumber leaf;8:灰葡萄孢B. cinerea;9:瓜枝孢Cladosporium cucnerinu;10:立枯絲核菌Rhizoctonia solani;11:茄鏈格孢A. solani;12:茄葡柄霉Stemphylium solani;13:尖鐮孢Fusarium oxysporum;14:核盤菌S. sclerotiorum;15:古巴假霜霉菌Pseudoperonospora cubensis;16:ddH2O
利用10倍梯度稀釋的基因組DNA對引物B-H278R-2F和B-H278R-2R14進行普通PCR和AS-real-time PCR靈敏度檢測,結果表明普通PCR檢測的靈敏度為91 pg·μL-1(圖6-A),AS-real-time PCR檢測的靈敏度為9.1 pg·μL-1(圖6-B)。AS-real-time PCR的靈敏度為普通PCR的10倍。

表4 EC50與生物學特性的相關性分析
表中數據為Pearson相關系數Data in the table are Pearson correlation coefficient values;*:<0.05

A:普通PCR靈敏度檢測sensitivity detection with ordinary PCR;B:AS-real-time PCR靈敏度檢測sensitivity detection with AS-real-time PCR;M:分子量標準BM5000 Molecular weight marker BM5000;1—8:DNA稀釋為9.1、9.1×10-1、9.1×10-2、9.1×10-3、9.1×10-4、9.1×10-5、9.1×10-6、9.1×10-7 ng·μL-1 DNA diluted to 9.1, 9.1×10-1, 9.1×10-2, 9.1×10-3, 9.1×10-4, 9.1×10-5, 9.1×10-6, 9.1×10-7 ng·μL-1;9:ddH2O
利用優化的條件進行AS-real-time PCR,特異性引物B-H278R-2F/2R14擴增產物在熔解溫度為91.62℃處出現單一的特異性峰(圖7-A),內參引物B-H278R- TY-F/R擴增產物在熔解溫度為87.81℃處出現單一的特異性峰(圖7-B)。
以R278 DNA摩爾質量分別占總量DNA的6.25%、12.5%、25%、50%、75%和100%作為不同的處理,用引物B-H278R-2F/2R14、B-H278R-TY/R進行AS- real-time PCR檢測,建立了標準曲線=-3.513+9.807,斜率為-3.513,截距為9.807,相關系數2=0.9857,擴增效率為92.59%。R278 DNA占總DNA的6.25%—100%的比例中,呈現出良好的線性關系(圖8)。
2.4 AS-real-time PCR定量檢測體系的驗證
以R278菌株DNA摩爾質量和孢子數量分別占總量的80%、40%、20%、10%和5%作為不同的處理,進行AS-real-time PCR檢測并驗證標準曲線的可行性。結果顯示預期值為80%、40%、20%、10%和5%時,相應的DNA檢測值依次為85.95%、44.64%、22.24%、11.86%和6.40%,孢子檢測值依次為116.45%、48.39%、26.38%、11.86%和6.83%(表5)。隨著預期值逐漸降低檢測值的標準差也依次下降,且預期值在5%時具有最小的標準差。同時預期值和檢測值具有很高的相關性(2=0.9998和2=0.9922),說明此檢測體系具有可行性,在檢測SdhB-H278R突變比例為5%時具有更高的準確性。

圖8 AS-real-time PCR建立檢測SdhB-H278R突變的標準曲線
3 討論
多主棒孢是一種重要的植物病原菌,是棒孢屬內發現最早、寄主范圍最廣的種,可侵染葫蘆科、茄科和豆科等大部分蔬菜,園藝花卉,橡膠等經濟作物以及大豆等糧食作物,約380屬530多種植物[20]。黃瓜棒孢葉斑病在我國北京、山東、甘肅、河北、廣東和黑龍江等多個省份[21-23]以及在日本和韓國[9,10,24]均大范圍發生,一般田間發病率為10%—25%,嚴重時可達60%—70%,甚至100%。因此由多主棒孢引起的黃瓜棒孢葉斑病在黃瓜上已成為一種重要的病害。啶酰菌胺是德國巴斯夫公司開發的一種SDHIs類殺菌劑,自2006年開始在日本登記防治黃瓜棒孢葉斑病,隨后很快出現了對啶酰菌胺的抗藥性[9-10]。但在國內該藥劑并未登記在防治黃瓜棒孢葉斑病上,只登記用于防治黃瓜灰霉病,隨著啶酰菌胺在防治黃瓜灰霉病中的廣泛使用,灰葡萄孢對啶酰菌胺產生了抗藥性[25],間接地多主棒孢對啶酰菌胺也相應產生了抗藥性,導致黃瓜棒孢葉斑病大量發生。目前多主棒孢上的抗性突變包括SdhB-P199S、H278Y/R、I280V、SdhC-S73P、SdhD-S89P、D95E、H108R、G109V[10],而H278R為首次在國內報道,因此建立一種AS-real-time PCR檢測方法非常必要,可用于指導后續的抗性治理。若H278R抗性頻率升高,應使該藥劑減少甚至停止使用,并采用不同作用機制的殺菌劑輪換使用或具有負交互抗藥性藥劑復配使用,可延長啶酰菌胺的使用壽命,減少黃瓜棒孢葉斑病的發生。

表5 AS-real-time PCR驗證
通過測定在北京市大興區采集的黃瓜多主棒孢對啶酰菌胺的敏感性并參考Miyamoto等[9]的研究結果,將多主棒孢菌株分為敏感和抗性菌株兩個群體,通過對黃瓜多主棒孢序列的測定,抗性菌株均為SdhB-H278R突變。Miyamoto等[9]檢測到SdhB-H278R共4株且劃分為高等抗性菌株,EC50范圍為8.9—10.7 μg·mL-1,而本文檢測到SdhB-H278R突變共8株且EC50范圍更廣(5.395—11.710 μg·mL-1),推測可能與檢測到H278R基因型的數量有關。通過對抗性和敏感菌株的生物學特性分析,發現抗性和敏感菌株除在菌絲生長速率方面存在顯著差異外,在產孢量和致病性方面差異不顯著,說明H278R突變株與敏感菌株之間的田間適合度差異不大,在藥劑選擇壓力下易發展成優勢群體導致黃瓜葉斑病的大量發生。-H272Y/R/L、H277Y/R/Y和H278R/Y幾種點突變類型已經在小雙胞腔菌、鏈格孢和灰葡萄孢等多種病原菌中被報道[7,14,16,26-28]。這幾種點突變均發生在泛醌結合口袋及其附近[29],且氨基酸序列具有高度的保守性,可以將這幾種突變歸為一類。LALèVE等[30]研究發現,灰葡萄孢H272R/L/Y突變在以葡萄糖作為碳源時,前期菌絲生長速率較慢,后期一致;另外H272Y突變不影響SDH和呼吸活性。推測這類點突變在田間的適應性較強,極易導致田間病害的發生。結合AS-real-time PCR檢測體系,預測含有H278R突變位點菌株的發展趨勢,可指導藥劑的合理使用及制定合理的田間管理策略。
本研究建立的AS-real-time PCR檢測方法可以快速定量檢測田間多主棒孢SdhB-H278R突變位點的頻率,經驗證AS-real-time PCR檢測方法預期值和試驗值的線性相關性為2=0.9998和2=0.9922。此方法可以檢測到5%的SdhB-H278R抗性突變,靈敏度是普通PCR的10倍。相比高葦等[31-32]建立的檢測黃瓜多主棒孢實時熒光定量PCR檢測技術和普通PCR檢測技術,此檢測體系可以定量檢測SdhB-H278R抗性突變位點以及抗性突變在田間頻率的變化,克服了PCR-RFLP檢測體系中變異系數大的難題[33-35]。與常規PCR檢測方法相比較,該檢測體系具有快速、無污染和靈敏度高的特點,并可根據檢測結果指導科學用藥以及降低用藥成本和減少環境污染。
4 結論
建立了快速檢測黃瓜多主棒孢菌SdhB-H278R突變位點的AS-real-time PCR技術體系,該體系自動化程度高,準確性強、靈敏度高,整個過程可在一個封閉的體系中進行,無污染、操作簡單,可用于檢測該突變位點在田間的頻率。
[1] 李寶聚, 高葦, 石延霞, 謝學文. 多主棒孢和棒孢葉斑病的研究進展. 植物保護學報, 2012, 39(2): 171-176.LI B J, GAO W, SHI Y X, XIE X W. Progress in researches onleaf spot., 2012, 39(2): 171-176. (in chinese)
[2] 于淑晶, 王滿意, 田芳, 趙衛光, 邊強, 李寶聚. 黃瓜棒孢葉斑病的防治及抗藥性研究進展. 農藥, 2014, 53(1): 7-11.YU S J, WANG M Y, TIAN F, ZHAO W G, BIAN Q, LI B J. Progress in research on control of cucumberleaf spot and fungicide resistance., 2014, 53(1): 7-11. (in chinese)
[3] 李良孔, 袁善奎, 潘洪玉, 王巖. 琥珀酸脫氫酶抑制劑類(SDHIs)殺菌劑及其抗性研究進展. 農藥, 2011, 50(3): 165-169.LI L K, YUAN S K, PAN H Y, WANG Y. Progress in research on SDHIs fungicides and its resistance., 2011, 50(3): 165-169. (in chinese)
[4] 顏范勇, 劉冬青, 司馬利鋒, 石恒, 胡欣. 新型煙酰胺類殺菌劑——啶酰菌胺. 農藥, 2008, 47(2): 132-135.YAN F Y, LIU D Q, SIMA L F, SHI H, HU X. Boscalid, a novel carboxamide aka anilide class of fungicides., 2008, 47(2): 132-135. (in chinese)
[5] AVENOT H, Michailides T J. Resistance to boscalid fungicide inisolates from pistachio in California., 2007, 91(10): 1345-1350.
[6] YIN Y N, KIM Y K, XIAO C L. Molecular characterization of boscalid resistance in field isolates offrom apple., 2011, 101(8): 986-995.
[7] AVENOT H F, THOMAS A, GITAITIS R D, JR LANGSTON D B, STEVENSON K L. Molecular characterization of boscalid- and penthiopyrad-resistant isolates ofand assessment of their sensitivity to fluopyram., 2012, 68(4): 645-651.
[8] WANG Y, DUAN Y B, WANG J X, ZHOU M G. A new point mutation in the iron-sulfur subunit of succinate dehydrogenase confers resistance to boscalid in., 2015, 16(7): 653-661.
[9] MIYAMOTO T, ISHII H, SEKO T, KOBORI S, TOMITA Y. Occurrence ofisolates resistant to boscalid on cucumber in Ibaraki Prefecture, Japan., 2009, 58(6): 1144-1151.
[10] MIYAMOTO T, ISHII H, STAMMLER G, KOCH A, OGAWARA T, TOMITA Y, FOUNTAINE J M, USHIO S, SEKO T, KOBORI S. Distribution and molecular characterization ofisolates resistant to boscalid., 2010, 59(5): 873-881.
[11] FURUYA S, SUZUKI S, KOBAYASHI H, SAITO S, TAKAYANAGI T. Rapid method for detecting resistance to a QoI fungicide inpopulations., 2010, 65(8): 840-843.
[12] AOKI Y, FURUYA S, SUZUKI S. Method for rapid detection of thegene allele conferring resistance to mandipropamid, a carboxylic acid amide fungicide, inpopulations., 2011, 67(12): 1557-1561.
[13] 李紅霞, 周明國. 用等位基因特異性寡核苷酸(ASO)-PCR快速檢測抗多菌靈的油菜菌核病菌. 中國農業科學, 2004, 37(9): 1396-1399.LI H X, ZHOU M G. Rapid identification of carbendazim resistant strains ofusing allele-specific oligonucleotide (ASO)-PCR., 2004, 37(9): 1396-1399. (in chinese)
[14] MALLIK I, ARABIAT S, PASCHE J S, BOLTON M D, PATEL J S, GUDMESTAD N C. Molecular characterization and detection of mutations associated with resistance to succinate dehydrogenase- inhibiting fungicides in., 2014, 104(1): 40-49.
[15] WHEELER I, KENDALL S, BUTTERS J, HOLLOMON D. Detection of benzimidazole resistance inusing allele-specific oligonucleotide probes./, 1995, 25(1/2): 113-116.
[16] DE MICCOLIS ANGELINI R M, MASIELLO M, ROTOLO C, POLLASTRO S, FARETRA F. Molecular characterization and detection of resistance to succinate dehydrogenase inhibitor fungicides in()., 2014, 70(12): 1884-1893.
[17] LEHNER M S, JúNIOR T J P, SILVA R A, VIEIRA R F, SCHNABEL G, MIZUBUTI E S G. Fungicide sensitivity of: A thorough assessment using discriminatory dose, EC50, high-resolution melting analysis, and description of new point mutation associated with thiophanate-methyl resistance., 2015, 99(11): 1537-1543.
[18] SAMARAS A, MADESIS P, KARAOGLANIDIS G S. Detection ofB gene mutations in SDHI-resistant isolates ofusing high resolution melting (HRM) analysis., 2016, 7: Article 1815.
[19] 聶燕釵, 王斌, 趙子琴, 周懷谷. 等位基因特異性PCR技術及其法醫學應用. 法醫學雜志, 2014, 30(4): 282-287.NIE Y C, WANG B, ZHAO Z Q, ZHOU H G. Allele-specific PCR and its application in forensic science., 2014, 30(4): 282-287. (in chinese)
[20] DIXON L J, SCHLUB R L, PERNEZNY K, DATNOFF L E. Host specialization and phylogenetic diversity of, 2009, 99(9): 1015-1027.
[21] 楊苗.我國蔬菜棒孢葉斑病病原菌多樣性研究[D]. 北京: 中國農業科學院, 2013.YANG M. Diversity of pathogen of corynespora leaf spot on vegetables in china[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. (in chinese)
[22] 高葦, 李寶聚, 石延霞, 謝學文. 河北青縣黃瓜棒孢葉斑病病原菌種群分化的研究. 華北農學報, 2011, 26(5): 9-15.GAO W, LI B J, SHI Y X, XIE X W. Population differentiation ofin qing county, Hebei province., 2011, 26(5): 9-15. (in chinese)
[23] 李長松, 張眉, 李林, 李凡, 齊軍山, 徐作珽, 張博. 山東省黃瓜棒孢葉斑病(褐斑病)病原菌鑒定和防治. 中國蔬菜, 2009(18): 29-33.Li C S, ZHANG M, Li L, LI F, QI J S, XU Z T, ZHANG B. Identification of cucumber target leaf spot (brown spot) pathogen and its control., 2009(18): 29-33. (in chinese)
[24] KWON M K, KANG B R, CHO B H, KIM Y C. Occurrence of target leaf spot disease caused byon cucumber in Korea., 2010, 52(3): 424.
[25] 余玲, 劉慧平, 韓巨才, 張寶俊. 山西省灰霉菌對啶酰菌胺的敏感性測定. 山西農業大學學報(自然科學版), 2012, 32(3): 232-234.YU L, LIU H P, HAN J C, ZHANG B J. Sensitivity offrom Shanxi province to boscalid., 2012, 32(3): 232-234. (in chinese)
[26] VELOUKAS T, LEROCH M, HAHN M, KARAOGLANIDIS G S. Detection and molecular characterization of boscalid-resistantisolates from strawberry., 2011, 95(10): 1302-1307.
[27] 史曉晶. 番茄早疫病菌對啶酰菌胺的抗性檢測及抗性機理初探[D]. 太谷: 山西農業大學, 2015. SHI X J. Study on sensitivity ofto boscalid and resistant mechanisms[D]. Taigu: Shanxi Agricultural University, 2015. (in chinese)
[28] YANG J H, BRANNEN P M, SCHNABEL G. Resistance into SDHI fungicides causes rare disease outbreak in peach orchards., 2015, 99(1): 65-70.
[29] HORSEFIELD R, YANKOVSKAYA V, SEXTON G, WHITTINGHAM W, SHIOMI K, OMURA S, BYRNE B, CECCHINI G, IWATA S. Structural and computational analysis of the quinone-binding site of complex II (succinate-ubiquinone oxidoreductase): a mechanism of electron transfer and proton conduction during ubiquinone reduction., 2006, 281(11): 7309-7316.
[30] LALèVE A, GAMET S, WALKER A, DEBIEU D, TOQUIN V, FILLINGER S. Site-directed mutagenesis of the P225, N230 and H272 residues of succinate dehydrogenase subunit B fromhighlights different roles in enzyme activity and inhibitor binding., 2014, 16(7): 2253-2266.
[31] 高葦, 李寶聚, 王萬立, 郝永娟, 石延霞. 土壤中黃瓜棒孢葉斑病病原菌實時熒光定量PCR檢測技術研究. 華北農學報, 2014, 29(2): 71-74.GAO W, LI B J, WANG W L, HAO Y J, SHI Y X. Detection ofin soil with real-time quantitative PCR., 2014, 29(2): 71-74. (in chinese)
[32] 陳璐. 黃瓜細菌性角斑病菌和多主棒孢菌PCR檢測技術的建立[D]. 北京: 中國農業科學院, 2014.CHEN L. PCR-based specific detection ofpv.and[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in chinese)
[33] MICHALECKA M, MALINOWSKI T, BRONIAREKNIEMIEC A, BIELENIN A. Real-time PCR assay with SNP-specific primers for the detection of a G143A mutation level infield populations., 2011, 159(7/8): 569-578.
[34] LUO Y, MA Z H, MICHAILIDES T J. Quantification of allele E198A in beta-tubulin conferring benzimidazole resistance inusing real-time PCR., 2007, 63(12): 1178-1184.
[35] KIANIANMOMENI A, SCHWARZ G, FELSENSTEIN F G, WENZEL G. Validation of a real-time PCR for the quantitative estimation of a G143A mutation in the cytochrome1gene of., 2010, 63(3): 219-224.
Establishment of AS-real-time PCR for Quantitatively Detecting the H278R Allele in theAssociated within Cucumber
SUN BingXue, SHI YanXia, ZHU FaDI, XIE XueWen, CHAI ALi, LI BaoJu
(Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081)
【Objective】The objective of this study is to establish a rapid and efficient allele specific real-time PCR (AS-real-time PCR) method for quantitative detection of the H278R mutation in theassociated within cucumber, and to verify the effect. 【Method】A total of 24 single conidial strains ofwere isolated from Daxing, Beijing.The method of mycelial growth inhibition was used to determine the EC50value to boscalid. Mycelium growth rate, spore outputs and pathogenicity of 4 susceptible (S) and 8 resistant (R) strains were measured. Primer pair Cc-SdhB-F/R was used to detect the sequence ofand the base change ofBased on the sequencing results inby Cc-SdhB-F/R primers, specific primer pair B-H278R-2F/2R14 and internal primers B-H278R-TY-F/R were designed. An AS-real-time PCR reaction system was established and optimized. The specificity, sensitivity and melt curve of the system were also evaluated.DNA and spore suspension containing different proportions of H278R mutation were detected with the optimized reaction system, respectively. 【Result】The sensitive frequency ofto boscalid was 66.67% in 24 strains and the EC50values ranged from 0.057 to 0.563 μg·mL-1. The resistance frequency ofto boscalid was 33.33% and the EC50values ranged from 5.395 to 11.710 μg·mL-1. Resistant and susceptible strains only significantly differed in terms of mycelium growth rate, and there was a significant negative correlation between the rate of mycelial growth and EC50values, but no significant difference in spore outputs and pathogenicity. Sequencing analysis showed that all the resistant strains carried SdhB-H278R mutation. The primers B-H278R-2F/2R14 were of great specificity, the specific fragment was amplified from the DNA of H278R strains, but not from the DNA of other fungal strains. The sensitivity of ordinary AS-PCR was 91 pg·μL-1, while that of AS-real-time PCR was 9.1 pg·μL-1, which was 10 times higher than that of ordinary AS-PCR. The standard curve established by AS-real-time PCR showed a fine linear relationship between ΔCT value and lg of H278R frequency, the correlation coefficient of the standard curve was 0.9857 and with high amplification efficiency (92.59%). The absorption peak of melting curve was single. The internal reference primers B-H278R-TY-F/R and the specific primer B-H278R-2F/2R14 had a single specific peak at 87.81℃and 91.62℃, respectively. The result of mixtures DNA and mixtures spore suspension to verify the standard curve showed a fine linear relationship between expected percentage and detected percentage (2=0.9998 and2=0.9922). As the proportions of H278R mutation inDNA and spore suspension decreased, the accuracy of the system gradually increased, and the detection limit was 5%. 【Conclusion】An efficient, quantitative, and rapid AS-real-time PCR detection system was established for the detection of SdhB-H278R mutation site, which can provide a theoretical basis for the SDHIs resistance management.
cucumber;; AS-real-time PCR; resistance;; boscalid
2018-06-22;
2018-09-15
國家重點研發計劃(2018YFD0201300)、中國農業科學院科技創新工程(CAAS-ASTIP-IVFCAAS)、農業部園藝作物生物學與種質創制重點實驗室開放課題(IVF2017)
孫炳學,E-mail:sunbingxuechina@163.com。石延霞,E-mail:shiyanxia@caas.cn。孫炳學和石延霞為同等貢獻作者。
李寶聚,E-mail:libaoju@caas.cn
10.3864/j.issn.0578-1752.2018.24.006
(責任編輯 岳梅)

