血漿腎素-血管緊張素-醛固酮系統活性與原發性高血壓患者靶器官損害的相關性
袁會玲 張曉華 楊洪霞 田 勇 卜瑞紅 解彥格 秦利強 劉紅彬
(石家莊市第三醫院急診科,河北 石家莊 050011)
高血壓常累積全身各系統,尤其心、腎等靶器官出現功能性和結構性損害尤為明顯〔1,2〕。高血壓病因復雜,如精神心理因素、血流動力學因素、胰島素抵抗、自身免疫機制等,仍處于不斷探索之中〔3,4〕。腎素-血管緊張素-醛固酮系統(RAAS)活性影響血壓、水電解質平衡,維持內環境穩定性,與高血壓發生發展密切相關〔5〕。但目前沒有形成有效理論體系評價RAAS活性與高血壓患者靶器官損害相關性〔6,7〕。本研究擬分析高血壓患者RAAS活性與原發性高血壓患者靶器官損害的相關性。
1 資料與方法
1.1一般資料 選取2015年12月至2016年11月高血壓患者105例,納入標準:(1)符合《中國高血壓防治指南(2010年)》原發性高血壓診斷標準〔8〕。(2)年齡18~55歲。(3)近6 w未使用利尿劑,4 w未使用二氫吡啶類鈣離子拮抗劑、β受體阻斷劑、血管緊張素轉換酶抑制劑和血管緊張素(Ang)Ⅱ受體抑制劑和非甾體類消炎藥。(4)需要控制血壓患者均采用α受體阻斷劑和(或)非二氫吡啶類鈣離子拮抗劑控制血壓4~6 w。(5)病歷資料記錄完善。(6)患者自愿參加。排除標準:(1)精神疾病、認知異常和語言溝通障礙。(2)腎上腺占位、庫欣綜合征、腎性高血壓、腎血管性高血壓等繼發性高血壓。(3)惡性腫瘤、過度飲酒和嚴重肝腎功能異常、心力衰竭、心、腦、腎疾病急性期。(4)妊娠期女性。(5)中途病情變化等原因退出研究者。其中男72例,女33例,年齡34~52歲,體重指數(BMI)23.00~29.50 kg/m2,吸煙史47例,飲酒史44例,收縮壓140~151 mmHg,舒張壓90~104 mmHg,血漿腎素(PRA)0.24~2.99 ng·ml-1·h-1,醛固酮(PAC)9.23~18.73 pg/ml,根據納入患者血漿PRA活性水平分為:A組(PRA<0.44 ng·ml-1·h-1)25例、B1組(PRA 0.44~1.07 ng·ml-1·h-1)26例、B2組(PRA 1.08~2.36 ng·ml-1·h-1)27組、C組(PRA>2.36 ng·ml-1·h-1)27例。本研究經醫院倫理委員會批準,患者或家屬簽署知情同意書。4組男女比例、平均年齡、吸煙、飲酒、血壓、PRA、PAC比較差異有統計學意義(P<0.05)。見表1。
1.2方法 研究開始24 h內收集研究對象姓名、性別、年齡、身高、體重、文化程度、吸煙、飲酒、病程、是否規律用藥等基線資料,記錄患者動態血壓、心臟彩色超聲檢查結果、尿素、肌酐、24 h尿蛋白、尿微量白蛋白、血清胱抑素(Cys)C和PRA、血漿PAC水平。血壓監測:采用24 h動態血壓檢測儀(生產廠家:無錫中健科技公司,型號BLOX-180型)于上午9∶00~10∶00開始監測,白天(6∶00~22∶00)每間隔20 min測量1次,夜間(22∶00~6∶00)每間隔30 min測量1次,測量周期24 h。心臟彩超檢查:采用彩色多普勒超聲心動檢測儀檢測(生產廠家:美國惠普公司,型號Sonos5500),探頭頻率2~4 MHz,包括靜息狀態下測量室間隔厚度(IVST)、左心室后壁厚度(LVPWT)、左心室收縮末內徑(LVESD)、左心室舒張末內徑(LVEDD)。并計算收縮末期容積(EDV)、左心室收縮末期容積(ESV)、心搏出量(SV)、左心室射血分數(LVEF),所有指標連續檢測3個心動周期取其平均值。尿素、血肌酐、CysC水平檢測:于清晨空腹抽取5 ml肘部血液,采用羅氏C8000全自動生化儀測定。24 h尿蛋白、尿微量白蛋白檢測:早晨第1次小便排凈且記錄本次時間,留取第2次尿液直至第2天的第1次尿液,共計24 h,將24 h內留取的全部尿液置入清潔容器內、混勻,抽取10~20 ml待檢,采用美國貝克曼Dxc800全自動生化分析儀分析24 h尿蛋白、24 h尿微量白蛋白。PRA、PAC水平檢測:患者空腹10 h后,于上午10∶30坐位15 min后,抽取右上臂靜脈血5 ml置于含有酶抑制劑的抗凝管中混勻,低溫1 500 r/min離心10 min后分離血漿且保存于-70℃待測。其中PRA測定采用碘(125I)Ang放射免疫分析藥盒(由北京北方生物技術研究所提供),PRA活性檢測用酶抑制劑〔乙二胺四乙酸(EDTA)、8-羥基喹啉硫酸鹽及二巰基丙醇等〕抗凝管收集標本。PAC測定采用碘(125I)PAC放射免疫試劑盒檢測(由美國貝克曼公司提供),PAC測定要求用普通無添加劑采血管分離的血清或普通促凝管收集血漿。所有操作嚴格按照試劑盒說明書實施。
1.3評價標準〔8〕動態血壓正常值 24 h平均血壓<130/80 mmHg(≥130/80 mmHg總讀數25%為異常),白天平均血壓<135/85 mmHg(≥135/85 mmHg總讀數25%為異常),夜間平均血壓<120/70 mmHg(≥120/70 mmHg總讀數25%為異常)。左室肥厚(LVH)標準:彩超診斷LVH標準,LVH:左室重量指數(LVMI)>125(男)、LVMI>110(女)。腎臟損害標準:24 h尿蛋白增高≥0.15 g/24 h,24 h尿微量白蛋白增高≥30 mg/24 h,CysC異常≥1.03 mg/L。
1.4統計學方法 采用SPSS17.0軟件進行方差分析、多樣本非參數檢驗和Logistics回歸分析。
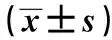
表1 4組臨床資料比較
2 結 果
2.14組心臟超聲指標和腎功能指標比較 4組心臟超聲IVST、LVH檢出率及腎臟功能指標尿素氮、肌酐、CysC水平差異有統計學意義(P<0.05),且C組明顯高于A組、B1組和B2組(P<0.05)。見表2,表3。

表2 4組心臟超聲指標比較〔M(Q25,Q75〕

表3 4組腎功能指標比較〔M(Q25~Q75〕
2.2不同血漿PRA活性與LVH關系Logistic回歸分析 以高血壓是否存在LVH為因變量,以性別、年齡和4組不同PRA活性為自變量,引入二分類Logistic回歸分析顯示,C組是A組發生LVH風險的1.661倍〔OR(95%CI):1.661(1.052~2.591),P=0.031〕,B1組OR(95%CI)為1.023(0.639~1.644),B2組為0.893(0.560~1.431);以性別、年齡、吸煙、飲酒和4組不同PRA活性為自變量,引入二分類Logistic回歸分析顯示,C組是A組發生LVH風險的2.250倍〔OR(95%CI)為2.250(1.322~3.910),P=0.005〕,B1組OR(95%CI)為1.355(0.781~2.364),B2組為1.192(0.693~2.100);以性別、年齡、吸煙、飲酒、24 h平均動脈壓和4組不同腎素活性為自變量,引入二分類Logistic回歸分析,校正后,高PRA活性是高血壓合并LVH的危險因素,且C組是A組發生LVH風險的2.271倍〔OR(95%CI)為2.271(1.271~4.023,P=0.008〕,B1組OR(95%CI)為1.421(0.797~2.512),B2組為1.253(0.700~2.301)。
2.3不同血漿PRA活性與腎臟損傷關系Logistic回歸分析 以高血壓是否存在腎臟損傷為因變量,以年齡、吸煙、飲酒和4組不同PRA活性為自變量,引入二分類Logistic回歸分析顯示,C組是A組發生腎臟損傷風險的1.020倍〔OR(95%CI)為1.020(0.846~2.280),P=0.044〕,B1組OR(95%CI)為0.982(0.594~1.876),B2組為1.003(0.624~1.584);以年齡、吸煙、飲酒、24 h平均動脈壓和4組不同PRA活性為自變量,引入二分類Logistic回歸分析顯示,C組是A組發生腎臟損傷風險的1.430倍〔OR(95%CI)為1.430(1.000~2.946),P=0.030)〕,B1組OR(95%CI)為1.193(0.750~2.370),B2組為1.200(0.715~2.201);以年齡、吸煙、飲酒、24 h平均動脈壓、CysC和4組不同PRA活性為自變量,引入二分類Logistic回歸分析,校正后,高PRA活性是原發性高血壓合并腎臟損傷的危險因素,且C組是A組發生腎臟損傷的2.087倍〔OR(95%CI)為2.087(1.458~2.987),P=0.008〕,B1組OR(95%CI)為0.840(0.574~1.230),B2組為0.978(0.675~1.420)。
3 討 論
高血壓作為心腦腎血管等靶器官損害的首要因素,能導致多種病變發生,因此嚴格控制血壓、加強高血壓靶器官損害早期診斷與早期防控,利于延長并發癥出現時間、延緩病程進展,提高患者生活質量等〔9,10〕。研究表明LVH和腎臟功能下降是最早出現的高血壓靶器官損害,且LVH被認為是冠心病、心力衰竭、猝死等心血管事件發生的獨立危險因素,因此加強心腎功能監測,利于評估高血壓所致靶器官損害程度等〔11,12〕。RAAS具有強大生理功能,利于血壓、血管功能和細胞生長調節及血容量等內環境穩定,尤其在高血壓病理生理中占據重要地位〔13〕。PRA作為腎臟入球小動脈近球細胞合成的水解蛋白酶,釋放入血液后能直接作用于肝臟分泌的Ang原上,將其轉化為AngⅠ,血管緊張素轉化酶催化AngⅠ轉化為AngⅡ,因此腎素被視為RAAS級聯反應的初始和限速步驟,其活性和(或)血漿PRA水平可反映RAAS活化程度,所以能夠作為RAAS活性替代標志物〔14,15〕。
本研究結果表明PRA活性高者以青年人群居多,吸煙、飲酒史、舒張壓、收縮壓與PRA活性高低具有一致性,加強此類人群重點監測,利于早期篩選原發性高血壓患者靶器官損害對象,早期防控。本研究結果說明PRA活性高低是導致LVH和腎臟損傷事件發生的關鍵因素,與Mcdonough等〔16〕研究結果一致。Logistic回歸分析結果表明PRA活性是LVH和腎臟損傷的獨立高危因素,風險事件發生率與PRA活性高低存在一定相關性,所以RAAS活性與原發性高血壓患者靶器官損害密切相關。因為血漿RAAS活性高的高血壓患者伴隨高PRA活性,致AngⅡ和PAC12合成增加,造成心肌纖維化、間質增生而引起心肌肥厚,且高PRA活性通過對血流動力學的調節,可以誘發血壓波動、壓力負荷過高而增加LVH發生率,所以血漿RAAS活性是導致高血壓患者LVH發生率高的原因。而關于血漿RAAS活性與腎臟功能損傷關系,可能與以下原因有關〔17〕,高水平的PRA活性反映了機體RAAS活性程度,隨著該系統激活,產生了強烈的縮血管效應,造成腎出球小動脈收縮作用超過入球小動脈,致腎臟壓力快速上升,腎小球負荷量超標,造成CysC水平和尿蛋白漏出升高;且高水平的PRA活性影響了機體營養物質傳遞和代謝產物排泄,致肌酐、尿素氮等指標升高;另外高PRA活性致機體鹽-容量減少,造成腎臟灌注量下降,因此血漿RAAS活性升高是高血壓患者腎臟早期損傷的相關因素。
綜上,高血壓患者血漿RAAS活性是原發性高血壓患者靶器官損傷的主要機制,與靶器官損傷密切相關。

