消退素D1對急性胰腺炎小鼠NLRP3炎癥小體通路的影響
急性胰腺炎(AP)是臨床常見急腹癥,病情及預后與炎癥程度直接相關。AP炎癥程度與機體大量炎性遞質合成釋放有關,抑制炎性遞質的合成可減輕AP炎癥損傷。消退素D1作為ω-3多不飽和脂肪酸衍生的內源性抗炎脂質分子,可抑制炎性反應遞質合成,減輕AP小鼠胰腺和肺的炎癥反應[1-2],其機制可能通過抑制NLRP3炎癥小體激活減少炎性遞質合成[3]。NLRP3炎癥小體是機體炎癥時調節促炎因子合成的多蛋白復合體[4-5],激活的NLRP3炎癥小體可引起IL-1β、HMGB1等促炎因子合成,參與AP炎癥損傷[6]。本研究采用雨蛙肽制備小鼠AP模型,觀察消退素D1對AP小鼠胰腺組織NLRP3炎癥小體通路的影響,探討消退素D1的抗炎作用機制。
一、材料與方法
1.實驗動物及分組:C57BL/6 雄性小鼠,6~8周齡,體重為18~22 g,由安徽省實驗動物中心提供。實驗前適應性飼養1周,造模前12 h禁食,不禁水。將30只小鼠分成對照組、AP組、消退素D1組,每組10只。參照文獻[2]方法,以腹腔注射雨蛙肽50 μg/kg體重7次、每次間隔1 h建立小鼠AP模型。消退素D1組小鼠在造模前1 h及造模后4 h腹腔注射消退素D1 50μg/kg體重,對照組腹腔內注射等容積生理鹽水。雨蛙肽購于美國Sigma公司,消退素D1購自美國Cayman公司。造模結束后處死所有小鼠,處死前稱小鼠體重,處死后取血,分離血清保存,取胰腺、肺組織。
2.血清淀粉酶、脂肪酶測定:采用比色法檢測淀粉酶、脂肪酶,試劑盒購自南京建成生物工程研究所,按說明書操作。
3.胰腺、肺濕重與體重比值:取新鮮小鼠胰腺及肺組織,稱濕重,計算胰腺、肺組織濕重與體重比值。
4.胰腺、肺組織病理學檢查:取胰腺、肺組織,常規固定、脫水、包埋、切片、蘇木精-伊紅(HE)染色。分別參照Schmidt等[7]和Imanaka等[8]標準對胰腺和肺組織進行病理損傷評分。
5.胰腺NLRP3 mRNA表達檢測:取液氮凍存的胰腺組織,應用Trizol提取總RNA,先反轉錄成cDNA,再應用實時熒光定量PCR法擴增,以β-actin為內參。引物序列:NLRP3上游引物5′-GCGGACTGTCCCATCAATGC-3′,下游引物5′-AGCAGCTCACCAACCACAGT-3′;β-actin上游引物5′-AGTGTGACGTTGACATCCGT -3′,下游引物5′-TGCTAGGAGCCAGAGCAGTA-3′。PCR反應條件:95℃ 2 min,95℃ 30 s,72℃ 20 s,循環40次。獲取目的基因和內參的Ct值,以公式2-△△CT計算目的基因mRNA相對表達量。
6.NLRP3炎癥小體組分及效應分子蛋白表達檢測:取胰腺組織,應用裂解液提取蛋白質,采用蛋白質印跡法檢測NLRP3、ASC、caspase-1、IL-1β、pro-IL-1β蛋白表達,以β-actin為內參。兔抗鼠NLRP3、ASC、caspase-1、IL-1β、pro-IL-1β抗體均購于北京博奧森生物有限公司,工作濃度分別為1∶200、1∶200、1∶500、1∶300、1∶300,最后ECL發光,X片曝光、顯影、定影、掃描,以目的條帶與內參條帶灰度值比表示相對表達量。
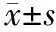
二、結果
1.消退素D1對各組小鼠血清淀粉酶和脂肪酶水平的影響:對照組、AP組、消退素D1組小鼠血清淀粉酶水平分別為(336±93)、(731±75)、(533±39)U/L;脂肪酶水平為(232±65)、(1212±102)、(764±144)U/L。AP 組較對照組顯著升高,消退素D1組較AP組顯著下降,差異均有統計學意義(P值均<0.05)。
2.消退素D1對各組小鼠胰腺、肺濕重與體重比的影響:對照組、AP組、消退素D1組胰腺濕重與體重比分別為(3.32±0.59)×10-3、(5.05±0.74)×10-3、(3.91±0.55)×10-3;肺濕重與體重比分別為(3.96±0.60)×10-3、(6.19±0.66)×10-3、(4.51±0.81)×10-3,AP組較對照組顯著升高,消退素D1組較AP組顯著下降,差異均有統計學意義(P值均<0.05)。
3.消退素D1對各組小鼠胰腺和肺組織病理損傷的影響:對照組小鼠胰腺及肺組織結構正常。AP組小鼠胰腺腺泡細胞腫脹,間質充血、水腫,小葉間隙增寬,間質和實質內可見大量炎細胞浸潤;肺間質明顯增寬,間質及肺泡腔充血、出血,大量炎細胞浸潤。消退素D1組小鼠胰腺組織腺泡細胞及間質輕度水腫,間質內少量炎細胞浸潤;肺間質增寬、充血、水腫,少量炎細胞浸潤(圖1)。對照組、AP組、消退素D1組胰腺病理評分分別為(0.6±0.2)、(5.3±0.4)、(3.1±0.4)分;肺組織病理評分分別為(1.6±0.5)、(9.6±0.5)、(5.6±0.6)分。AP 組較對照組顯著升高,消退素D1組較AP組顯著下降,差異均有統計學意義(P值均<0.05)。

圖1 對照組、AP 組、消退素D1組胰腺(1A、1B、1C)及肺組織(1D、1E、1F)病理改變(HE ×400)
4.消退素D1對各組小鼠胰腺NLRP3 mRNA表達的影響:對照組、AP組、消退素D1組小鼠NLRP3 mRNA表達量分別為1.01±0.12、4.36±0.40、1.69±0.14,AP組顯著高于對照組,而消退素D1組又顯著低于AP組,差異均有統計學意義(P值均<0.001)。
5.消退素D1對AP小鼠NLRP3炎癥小體組分及效應分子蛋白表達的影響:對照組、AP組、消退素D1組NLRP3蛋白表達量分別為0.62±0.11、1.50±0.08、0.93±0.07;ASC分別為0.15±0.04、1.81±0.07、0.92±0.05;caspase-1分別為0.37±0.05、1.11±0.04、0.70±0.06;效應分子pro-IL-1β分別為0.32±0.07、1.54±0.07、0.72±0.02;IL-1β分別為0.34±0.06、1.60±0.03、0.80±0.07(圖2)。AP組顯著高于對照組,而消退素D1組又顯著低于AP組,差異均有統計學意義(P值<0.05或<0.001)。

圖2 對照組(1)、AP組(2)、消退素D1組(3)小鼠胰腺NLRP3炎癥小體組分(2A)及效應蛋白表達(2B)
討論AP是臨床常見急腹癥,可導致全身炎癥反應綜合征和多器官功能衰竭。AP病情及預后與機體炎癥反應密切相關,IL-1β、IL-6、TNF-α等炎性遞質在胰腺炎性反應中具有關鍵作用,抑制炎性遞質的合成可減輕AP胰腺病理損傷。研究表明[9-10],AP炎癥遞質的合成釋放受NLRP3炎癥小體的調控,抑制其激活可減輕AP的炎癥程度。作為炎癥因子的啟動子,NLRP3炎癥小體可活化細胞因子前體,釋放炎癥遞質和細胞因子,激發和調節AP炎癥反應,與AP的發生、發展存在密切關系[11-12]。
NLRP3炎癥小體是由 NLRP3、ASC、pro-caspase-1組成的細胞內多蛋白復合體。Hoque等[6]通過分別敲除ASC、caspase-1、NLRP3基因,發現雨蛙肽誘導的AP嚴重程度減輕。Ren等[9]研究顯示,富氫鹽水抑制NLRP3炎癥小體激活可減輕AP炎癥反應。Dong等[10]研究發現,Sulforaphane通過抑制NLRP3、IL-1β等NLRP3炎癥小體通路組分的表達減輕雨蛙肽誘導的小鼠AP炎癥。研究表明[6,11],AP時胰腺損傷釋放的DAMPs激活NLRP3,通過與ASC結合形成能夠募集pro-caspase-1平臺,通過剪切pro-caspase-1活化為caspase-1,促進IL-1β、HMGB1等促炎因子的合成。IL-1β作為NLRP3炎癥小體發揮作用的主要效應分子在AP早期即明顯升高,它是AP時無菌炎癥和損傷反應的重要因子,還可引起胰腺腺泡細胞胰蛋白酶原激活并降低腺泡細胞活力[13]。基因敲除IL-1β或使用IL-1β拮抗劑可減輕AP的損傷[14]。因此,調控NLRP3炎癥小體通路可能是治療AP有效靶點。
消退素D1是ω-3多不飽和脂肪酸衍生的內源性抗炎脂質分子,具有限制中性粒細胞浸潤,減輕炎性損傷的作用[1-2]。消退素D1通過抑制IL-1β、IL-6、IL-8等炎性遞質合成[2],減輕雨蛙肽誘導AP的胰腺和肺組織病理損傷,減輕AP炎癥反應過程。Li等[3]研究發現,消退素D1可通過抑制NLRP3炎癥小體活化,抑制炎性反應遞質合成,減輕同型半胱氨酸引起的腎小球損傷。Yin等[15]的研究顯示,消退素D1通過抑制NLRP3炎癥小體激活發揮抗炎作用。
本研究通過雨蛙肽誘導制備AP小鼠模型,結果顯示消退素D1降低AP小鼠血清淀粉酶和脂肪酶水平及胰腺、肺濕重與體重比,減輕胰腺和肺組織病理損傷,減輕AP小鼠炎癥過程。消退素D1顯著下調胰腺組織NLRP3、ASC、caspase-1的表達,降低pro-IL-1β及IL-1β水平,提示消退素D1通過抑制NLRP3炎癥小體通路,降低炎癥遞質合成,減輕AP小鼠炎癥損傷,其具體機制需進一步研究。

