斜紋夜蛾核型多角體病毒Ⅱ型分離株同源重復區hr1的結構功能分析
劉惠芬 衣葵花 劉文光 董亞茹 張志芳 李云芝 王安皆


摘要:斜紋夜蛾核型多角體病毒Ⅱ型(Spodoptera litura nucleopolyhedrovirus Ⅱ,SpltNPVⅡ)基因組DNA同源重復區hr1大小為1 746 bp,含有6個64 bp不完全回文序列、4個正向重復序列以及7個與病毒基因組DNA復制相關的基序。瞬時表達分析結果表明,SpltNPVⅡhr1在感染野生型家蠶核型多角體病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)和苜蓿丫紋夜蛾多粒包埋型核多角體病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)的BmN和Sf21細胞中均具有增強早期基因ie1啟動子活性的功能,增強效率分別為30、350倍;實時熒光定量PCR結果顯示,hr1在BmN和Sf21細胞中具有基因組DNA復制起始原點的功能,拷貝數分別為(8.46×104±6.13×103)、(592×106±2.95×105)copies/μg DNA。研究證明,SpltNPVⅡ hr1在異源細胞BmN和Sf21中具有復制起始原點和增強子的雙功能作用。
關鍵詞:斜紋夜蛾;核型多角體病毒;同源重復區;hr1
中圖分類號: S433.4;Q78文獻標志碼: A
文章編號:1002-1302(2019)21-0100-03
收稿日期:2019-08-09
基金項目:山東省自然科學基金(編號:ZR2017BC080);山東省現代農業產業技術體系蠶桑產業創新團隊建設項目(編號:SDAIT-18-03)。
作者簡介:劉惠芬(1982—),女,山東滕州人,博士,助理研究員,主要從事昆蟲病毒學研究。Tel:(0535)6527628;E-mail:liuhuifen77@163.com。
通信作者:李云芝,研究員,主要從事家蠶病理研究,Tel:(0535)6527628,E-mail:yzli888@163.com;王安皆,副研究員,主要從事家蠶病理研究,Tel:(0535)6527628,E-mail:wangaj77@126.com。
桿狀病毒是一類環狀雙鏈DNA病毒,其基因組大小為80~180 kb。在桿狀病毒的發育循環中,DNA復制是其生命周期中最重要的一環,也是病毒增殖周期最重要的事件[1]。DNA復制原點是最為重要的順式作用元件,對DNA的復制極為重要。研究發現,桿狀病毒DNA復制原點有2種類型,分別為同源重復區(homologous repeat regions,hr)和非同源重復區起始位點(non-hr)[2-4]。其中,hr存在于大多數桿狀病毒基因組中,是目前研究較多的類型。
hr作為核型多角體病毒(nucleopolyhedrovirus,NPV)DNA復制原點已在眾多桿狀病毒中得到證實[5-9]。苜蓿丫紋夜蛾多粒包埋型核多角體病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)基因組含有8個復制原點,包括7個hr和1個HindⅢ-K片段,研究發現7個AcMNPVhr均具有復制原點功能[5]。家蠶核型多角體病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)基因組含有8個復制原點,其中hr3和hr5不僅在宿主細胞中具有復制原點功能,在AcMNPV感染的非宿主Sf21細胞中亦可得到復制,而且hr5在AcMNPV感染的Sf21細胞中的復制功能比在BmNPV感染的BmN細胞中高一些[6,10-11],表明與AcMNPV復制有關的因子亦能作用于BmNPV的hrs。hr除具有復制原點的功能外,還具有早期基因表達增強子的功能。BmNPV ZJ-8株 hr3具有增強ie1和hel基因啟動子活性的功能,其增強轉錄活性分別高達2 400、7 000倍左右,即使僅含有hr3中1個典型完整的回文序列,其增強能力也高達79倍[12-13]。在Sf9細胞中,AcMNPVhr1序列除具有復制原點的功能外,還能夠增強多角體啟動子和果蠅hsp70基因啟動子的轉錄活性[14]。
斜紋夜蛾核型多角體病毒Ⅱ型(Spodoptera litura nucleopolyhedrovirus Ⅱ,SpltNPVⅡ)基因組DNA含有7個hrs,前期研究證實7個hrs在宿主細胞Spli221中具有復制原點和增強子的功能[7],本研究擬對SpltNPVⅡhr1進行結構分析,并采用脂質體介導的質粒轉染法與實時熒光定量聚合酶鏈式反應(PCR)相結合的方法,探討hr1在非敏感宿主BmNPV-BmN和AcMNPV-Sf21細胞系統中是否具有復制原點和增強子的功能。
1材料與方法
1.1試驗材料和主要試劑
BmN和Sf21細胞均由中國農業科學院生物技術研究所提供。質粒pBm-ie1P-hr1和pAc-ie1P-hr1分別含有BmNPVie1和AcMNPVie1啟動子序列以及SpltNPVⅡ hr1序列,質粒pUC19-hr1含有SpltNPVⅡ hr1序列,均為筆者所在研究室保存。寡核苷酸引物的合成由北京三博遠志生物技術有限責任公司完成。昆蟲細胞培養基TC-100、胎牛血清及脂質體(lipofectin)試劑均購自GIBCO公司。SYBR Green Ⅰ試劑購自Promega公司。
1.2試驗方法
1.2.1細胞培養
BmN和Sf21細胞用含10%胎牛血清(FBS)的TC-100培養基在27 ℃按Summers等的方法[15]進行培養。
1.2.2SpltNPVⅡhr1序列分析
利用ClustalW、DNAMAN、Lasergene 7.1和MEGA 4等生物軟件對SpltNPVⅡ hr1序列進行分析。
1.2.3脂質體法轉染昆蟲細胞
接種約5×105個細胞于12 cm2 ?25 mL培養瓶中,貼壁培養過夜。除去含FBS的培養基,用無血清培養基洗2次細胞,加入1 mL無血清培養基,接種野生型NPV病毒(感染復數=1),感染1 h。然后傾去培養基,加入3 mL 含血清的完全培養基,27 ℃培養2 h。移去上述完全培養基,用無血清培養基洗2次細胞,再加1 mL無血清培養基。事先在50 μL反應體系中加入2 μg質粒DNA和適量的lipofectin試劑,用ddH2O補足體積,輕輕混勻,27 ℃溫育15 min 使DNA被脂質體包埋,制成轉染液。將轉染液逐滴加入培養瓶中,并輕輕轉動混勻。轉染4~5 h后傾去含轉染液的無血清培養基,補加3 mL含FBS的培養基,27 ℃培養。
1.2.4瞬時表達分析
將功能質粒pBm-ie1P-hr1和pAc-ie1P-hr1 DNA分別轉染野生型病毒BmNPV和AcMNPV感染的BmN和Sf21細胞或未感染細胞,培養48 h,用細胞刮將貼壁細胞刮下,5 000 r/min離心5 min,收集細胞。加入適量磷酸緩沖液,重懸細胞后,5 000 r/min離心5 min,棄上清,如此反復清洗細胞2~3次。加入細胞裂解液將細胞重懸,裂解5~10 min,使之充分裂解。在每個樣品管中加入100 μL熒光素酶反應底物,加入一定體積的細胞裂解混合液,振蕩混勻。將樣品放入熒光儀,按照設定程序開始測量讀數[16]。設置3組重復試驗。以pRL-CMV質粒作為內參質粒,以只含ie1啟動子的pBm-ie1P和pAc-ie1P質粒作對照。將牛血清白蛋白配制成標準濃度(0.5 mg/mL)蛋白質,用酶標儀進行蛋白質定量測定。
1.2.5實時熒光定量PCR
將功能質粒pUC19-hr1 DNA轉染野生型病毒BmNPV和AcMNPV感染的BmN和Sf21細胞。48 h后收集細胞,提取細胞總DNA,經DpnⅠ酶切后,進行實時熒光定量PCR,并制作標準曲線[7]。用實時熒光定量PCR獲得的CT值及標準曲線來計算功能質粒在BmN和Sf21細胞中的拷貝數。
2結果與分析
2.1SpltNPVⅡhr1序列分析
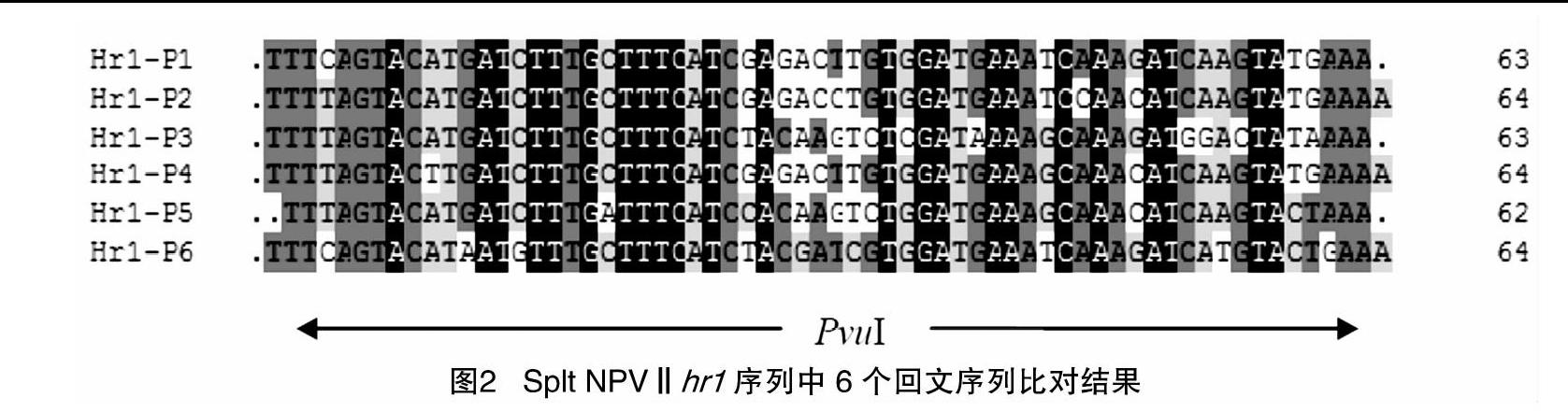
SpltNPVⅡ hr1大小為1 746 bp,位于基因組127 816~130 509 bp、開放閱讀框(ORF)8~ORF9之間。hr1含6個64 bp 不完全回文序列(圖1),其序列的核苷酸一致性高達90%以上,回文序列的中心均含有1個PvuⅠ限制性酶切位點,含有4個正向重復序列,并且存在7個不規則重復序列和7個與病毒基因組DNA復制相關的motif基序(圖2)。
2.2SpltNPVⅡhr1對BmNPV和AcMNPVie1啟動子轉錄活性的增強作用
采用脂質體介導功能質粒在昆蟲細胞中的轉染與瞬時表達方法,將構建的含有BmNPV和AcMNPVie1啟動子以及SpltNPVⅡhr1的功能質粒分別轉染感染野生型BmNPV和AcMNPV的BmN和Sf21細胞,以只含ie1啟動子的pBmie1-P和pAc-ie1P質粒作對照。結果顯示,SpltNPVⅡhr1在非敏感宿主細胞BmN中,增強BmNPVie1啟動子轉錄活性的效率是對照的30倍,增強AcMNPVie1啟動子轉錄活性的功能較強,其增強效率為對照的350倍(表1)。
將功能質粒pUC19-hr1按照108~104個拷貝進行梯度稀釋,作為模板進行實時熒光定量PCR。以所得CT值對相應拷貝數的對數作圖,即得所需標準曲線及其線性方程y=ax+b,結果顯示,標準曲線線性關系良好,r2>0.99(圖3)。
用含有SpltNPVⅡhr1的功能質粒分別轉染BmNPV和AcMNPV感染的BmN和Sf21細胞,培養48 h后提取細胞總DNA,經DpnⅠ酶切后進行實時熒光定量PCR,將獲得的CT值代入圖3中制作的標準曲線,計算出含有SpltNPVⅡhr1的功能質粒在BmN和Sf21細胞中的拷貝數。結果顯示,SpltNPVⅡhr1在BmN細胞中的拷貝數為(8.46×104±6.13×103)copies/μg DNA,在Sf21細胞中的拷貝數為(5.92×106±2.95×105)copies/μg DNA。
3討論與結論
大多數桿狀病毒基因組都含有同源重復序列,分布于基因組的多個位置,具有基因組DNA復制起始原點和增強基因啟動子轉錄活性的雙重功能。本研究通過序列分析發現,SpltNPVⅡhr1具有作為病毒基因組DNA復制起始原點的特征結構,并探討了SpltNPVⅡhr1在非敏感宿主BmN和Sf21細胞中是否具有復制起始原點以及增強BmNPVie1和AcMNPVie1基因啟動子轉錄活性的功能,發現hr1在2種非敏感宿主細胞中均具有復制起始原點和增強子功能,但復制和增強效率各不相同。在Sf21細胞中的復制和增強效率遠高于在BmN細胞中,并且同樣處理條件下,在異源細胞中的復制和增強效率高于在宿主細胞Spli221中[7]。
胡建新等通過Southern雜交檢測發現,含BmNPVhr5的質粒在AcMNPV-Sf細胞系統中的復制起始原點功能要比在BmNPV-BmN細胞系統中高一些[11]。Chen等曾報道,BmNPVhr3具有增強BmNPVie1和AcMNPVie1基因啟動子轉錄活性的功能,并且在異源Sf21細胞中的增強作用遠高于宿主細胞BmN[13]。這可能是由于細胞轉化和感染方法等都是仿照細胞Sf21/AcMNPV系統所采用的方法,對于其他細胞株來說可能不是最適合的條件。張志芳等研究發現,BmNPVhr3和hr5與AcMNPV同源性高達90%以上,并且在AcMNPV感染的Sf21細胞中均能得到顯著復制,推測hr作為病毒復制起始原點與其結構以及所需病毒因子的同源性可能有關[6,11]。
參考文獻:
[1]呂鴻聲. 昆蟲病毒分子生物學[M]. 北京:中國農業科學技術出版社,1998:217-274.
[2]Pearson M N,Bjornson R M,Ahrens C,et al. Identification and characterization of a putative origin of DNA replication in the genome of a baculoviruspathogenic for Orgyia pseudotsugata[J]. Virology,1993,197(2):715-725.
[3]Huang J H,Levin D B. Identification and functional analysis of a putative non-hr origin of DNA replication from the Spodoptera littoralis type B multinucleocapsid nucleopolyhedrovirus[J]. Journal of General Virology,1999,80(8):2263-2274.
[4]Jehle J A. The expansion of a hypervariable,non-hr ori-like region in the genome of Cryptophlebia leucotreta granulovirus provides in vivo evidence for the utilization of baculovirus non-hr oris during replication[J]. Journal of General Virology,2002,83(8):2025-2034.
[5]Kool M,Voeten J T,Goldbach R W,et al. Identification of seven putative origins of Autographa californica multiple nucleocapsid nuclear polyhedrosis virus DNA replication[J]. Journal of General Virology,1993,74(12):2661-2668.
[6]張志芳,張穎,呂鴻聲,等. 家蠶核多角體病毒DNA復制起始點hr3的結構功能[J]. 中國科學,1995,25(9):949-955.
[7]Liu H F,Gao H J,Guo G,et al. The homologous regions of Spodoptera litura(Lepidoptera:Noctuidae)nucleopolyhedrovirus Ⅱhave both the function as origin of DNA replication and enhancer[J]. Journal of Insect Science,2015,15(1):89-96.
[8]Kuzio J,Faulkner P. Regions of repeated DNA in the genome of Choristoneura fumifefana nuclear polyhedrosis virus[J]. Virology,1984,139(1):185-188.
[9]Alves C A,Ikeda M,Kobayashi M. Identification and characterization
of Hyphantria cunea nucleopolyhedrovirus homologous repeated regions[J]. Virus Genes,2002,25(3):281-290.
[10]Cheng R L,Xu Y P,Zhang C X. Genome sequence of a Bombyx mori nucleopolyhedrovirus strain with cubic occlusion bodies[J]. Journal of Virology,2012,86(18):10245.
[11]胡建新,吳祥甫,李載平,等. 家蠶核型多角體病毒同源重復區hr5的結構和功能[J]. 中國科學(C輯:生命科學),1996,26(3):194-199.
[12]肖慶利,張志芳,易詠竹,等. 家蠶核多角體病毒解旋酶基因啟動子及增強子hr3功能分析[J]. 生物化學與生物物理學報,2001,33(5):525-530.
[13]Chen Y,Yao B,Zhu Z Z,et al. A constitutive super-enhancer:homologous region 3 of Bombyx mori nucleopolyhedrovirus[J]. Biochemical and Biophysical Research Communications,2004,318(4):1039-1044.
[14]Viswanathan P,Venkaiah B,Kumar M S,et al. The homologous region sequence (hr1) of Autographa californica multinucleocapsid polyhedrosis virus can enhance transcription from non-baculoviral promoters in mammalian cells[J]. Journal of Biological Chemistry,2003,278(52):52564-52571.
[15]Summers M D,Smith G E. A manual of methods for baculovirus vectors and insect cell culture procedures[M]. Texas:Texas Agricultural Experiment Station Bulletin,1987:1555-1556.
[16]Idahl L A,Sandstrm P E,Sehlin J. Measurements of serum glucose using the luciferin/luciferase system and a liquid scintillation spectrometer[J]. Analytical Biochemistry,1986,155(1):177-181.

