叢枝菌根真菌對鎳脅迫桂花幼苗光合作用及抗氧化酶活性的影響
李曉曼 王建軍
摘要:以桂花幼苗為材料,研究接種叢枝菌根真菌(AMF)對0、100、200、300、400 mg/L這5種鎳(Ni)質量濃度脅迫下桂花光合作用及抗氧化酶活性等的影響。結果表明,5種Ni脅迫質量濃度下,未接種AMF的桂花幼苗根系菌根侵染率均為0,而接種AMF的根系菌根浸染率則隨Ni脅迫質量濃度的增大而逐漸降低;隨Ni脅迫質量濃度的增大,接種、未接種AMF的桂花幼苗葉片葉綠素含量、類胡蘿卜素含量、凈光合速率(Pn)、氣孔導度(Gs)、蒸騰速率(Tr)、植株株高、莖粗、總干物質含量呈逐漸降低趨勢,且接種AMF的桂花幼苗相應指標下降幅度多顯著低于未接種處理(P<0.05),而胞間二氧化碳濃度(Ci)呈先降后增,接種AMF的桂花幼苗葉片Ci顯著低于未接種處理,相對電導率、丙二醛(MDA)含量呈逐漸上升趨勢,且接種AMF的桂花幼苗的相應指標多顯著低于未接種處理,超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)則呈先升后降趨勢,接種AMF的桂花幼苗抗氧化酶活性顯著高于未接種處理;Ni脅迫質量濃度為400 mg/L時,接種AMF的桂花幼苗葉綠素含量、Pn、Gs、Tr、株高、總干物質質量、SOD活性、POD活性、CAT活性分別較未接種的分別顯著增加69.72%、80.22%、61.90%、42.48%、22.12%、15.76%、6085%、21.83%、22.03%,Ci、相對電導率、MDA含量分別較未接種的顯著降低6.98%、10.04%、19.21%。
關鍵詞:叢枝菌根真菌;桂花;光合作用;抗氧化酶;鎳
中圖分類號: S685.130.1;S182文獻標志碼: A
文章編號:1002-1302(2019)21-0223-05
收稿日期:2018-08-07
基金項目:全國農業(yè)職業(yè)教育“十三五”科研項目(編號:2016-135-Y-005)。
作者簡介:李曉曼(1980—),女,遼寧營口人,碩士,講師,從事園林植物栽培及園林規(guī)劃設計研究。E-mail:582659554@qq.com。
近年來,隨著我國工業(yè)化的飛速發(fā)展,土壤環(huán)境污染問題日趨嚴重,其中,土壤重金屬污染因其毒性強、易富集、難降解等特點而愈發(fā)被人們關注[1-2]。據(jù)《全國土壤污染狀況調查公報》顯示,我國土壤重金屬總超標率為16.1%,其中,鎳(Ni)超標量達到4.8%,僅次于鎘(Cd),已成為我國土壤重金屬污染的主要元素之一[3]。鎳是植物生長發(fā)育所必需的微量元素之一,但當土壤中Ni含量過高時,往往會對植物水分、養(yǎng)分的吸收及光合作用產生干擾,進而影響農作物產量、品質及園林綠化植物的景觀效果,而如何提高植物對Ni脅迫的耐受性已成為亟待解決的關鍵問題之一[4-5]。
叢枝菌根真菌(arbuscular mycorrhiza fungi,AMF)是一類在土壤中廣泛存在的有益真菌,可與絕大多數(shù)植物形成互利的共生體系,在提高植物對生物及非生物脅迫抗性方面發(fā)揮著非常重要的作用[6-7]。有研究表明,外源接種AMF可提高植物對重金屬的耐受性,其作用機制主要體現(xiàn)在:一是AMF可通過菌絲體組分纖維素、幾丁質等來吸附重金屬,減少重金屬在植物體內的轉移量[8-9];二是AMF可對植物的根系分泌物、根際土壤微生物群落結構及土壤pH值產生影響,從而降低土壤重金屬的有效性,減少植物吸收[10-11];三是AMF可以改善植物礦質營養(yǎng)和根系形態(tài),從而影響植物對重金屬的吸收和轉移[12-13];四是AMF可以提高植物的抗氧化酶活性,從而提高植物對重金屬的耐受性[14-15]。目前,有關提高植物對鎳耐受性的方法主要為化學方法,如外源施用甜菜堿、褪黑素、水楊酸等[3,16-17],但存在成本高、周期長且易造成二次污染等缺點。
桂花(Osmanthus sp.)別稱巖桂,為木犀科木犀屬植物,是我國十大名花之一,因其集綠化、香化、美化于一體,在我國園林綠化中被廣泛應用,而當前利用AMF提高其對鎳耐受性的研究鮮見報道。本研究以桂花幼苗為試驗材料,采用不同質量濃度Ni進行脅迫處理,并分別接種AMF,以分析接種AMF對鎳脅迫下桂花幼苗光合作用及抗氧化酶活性的影響,以期為提高植物對鎳脅迫的耐受性提供一定的理論依據(jù)。
1材料與方法
1.1試驗材料
試驗于2017年4月在重慶三峽職業(yè)學院苗圃進行,供試植物為桂花幼苗,購自重慶科光種苗有限公司;供試叢枝菌根真菌為摩西球囊霉菌(Glomus mosseae),購自北京市農林科學院植物保護環(huán)境保護研究所;氯化鎳(NiCl2)分析純,購自上海阿拉丁生化科技股份有限公司。
1.2試驗方法
桂花幼苗采用直徑為40 cm、深45 cm的花盆栽種,每盆定植1株,栽培基質為改良土壤基質,定植前,以基質接種叢枝菌根真菌20 g為處理(AMF),以接種經高溫滅活的叢枝菌根真菌20 g(視為未接種叢枝菌根真菌,全文同)為對照(CK);緩苗生長30 d,即2017年6月,選取長勢、大小基本一致的桂花幼苗,分別采用NiCl2進行Ni脅迫試驗,設NiCl2終質量濃度分別為0、100、200、300、400 mg/L,每天按100 mg/L梯度遞增,直至達到各處理預定質量濃度;后每隔3 d按預定鎳質量濃度澆灌1次,澆灌量為250 mL;連續(xù)鎳脅迫處理60 d,采樣測定各指標。試驗共設10個處理,每處理20盆,隨機區(qū)組排列,試驗期間進行正常養(yǎng)分管理及病蟲害防治。
1.3測定內容與方法
1.3.1桂花幼苗生長及菌根侵染情況測定脅迫處理結束,采用軟尺測量桂花植株株高、莖粗,采用電子天平稱量總的干物質質量;桂花幼苗根系菌根侵染情況采用Phillips等的方法[18]測定,統(tǒng)計菌根侵染率,計算公式為:
菌根侵染率=侵染菌根段數(shù)/檢測菌根段數(shù)×100%。
1.3.2光合指標及抗氧化酶活性測定每處理選取植株的第2~3張功能葉,采用美國LI-COR公司產Li-6400 XT型便攜式光合測量儀測定其凈光合速率(Pn)、氣孔導度(Gs)、胞間CO2濃度(Ci)、蒸騰速率(Tr);采用丙酮比色法測定光合色素含量,采用相對電導法(RC)測定葉片細胞膜透性;分別采用抑制氮藍四唑(NBT)光還原比色法、愈瘡木酚法和紫外分光光度法測定超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)活性;采用硫代巴比妥酸比色法測定丙二醛(MDA)含量。
1.4數(shù)據(jù)分析
采用Excel 2013軟件對數(shù)據(jù)進行整理、統(tǒng)計及作圖,采用SPSS 18.0軟件進行差異顯著性分析。
2結果與分析
2.1叢枝菌根真菌對Ni脅迫下桂花幼苗生長的影響
由表1可見,隨著Ni脅迫質量濃度的增大,接種、未接種AMF的桂花幼苗植株株高、莖粗、總干物質質量均呈逐漸減小趨勢,接種AMF的植株株高、莖粗、總干物質質量均明顯高于未接種處理;Ni脅迫質量濃度分別為100、200、300、400 mg/L 時,接種AMF的桂花幼苗株高較CK處理分別增加6.84%、10.84%、13.80%、22.12%,除Ni脅迫質量濃度為400 mg/L 的植株株高顯著高于未接種的(P<0.05)外,其他3種質量濃度處理接種與未接種間差異不顯著(P>0.05),接種AMF的桂花幼苗莖粗分別較CK處理增加3.67%、682%、7.95%、7.87%,除Ni脅迫質量質量濃度為300 mg/L的植株幼苗莖粗顯著高于未接種的外,其他3種質量濃度處理接種與未接種間差異不顯著,接種AMF的桂花幼苗總干物質質量分別較CK處理增加7.14%、11.82%、16.69%、1576%,接種與未接種間差異顯著。可見,Ni脅迫可明顯抑制桂花幼苗的生長,而接種AMF可明顯促進Ni脅迫下桂花幼苗的生長。
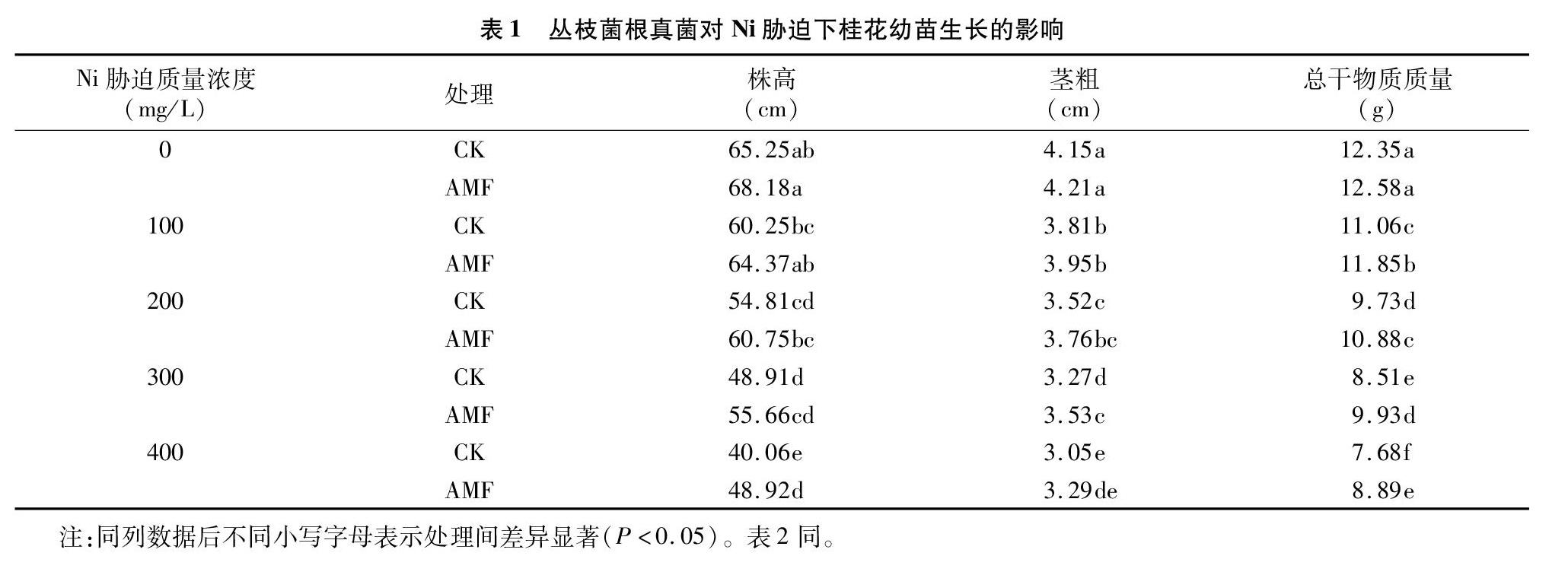
2.2Ni脅迫對叢枝菌根真菌侵染桂花幼苗根系的影響
由圖1可見,5種Ni質量濃度脅迫下,未接種叢枝菌根真菌的桂花幼苗根系均未發(fā)現(xiàn)有菌絲生成,菌根侵染率為0;隨Ni脅迫質量濃度的增大,接種AMF的桂花幼苗根系菌根浸染率逐漸降低,可能是由于Ni脅迫不利于AMF的侵染和菌根發(fā)育所致;Ni脅迫質量濃度為0 mg/L時,接種AMF的桂花幼苗根系菌根浸染率為78.25%,而Ni脅迫質量濃度分別為100、200、300、400 mg/L時,接種AMF的桂花幼苗根系菌根浸染率分別為60.58%、44.39%、35.68%、27.22%,分別較0 mg/L處理的顯著降低17.67、33.86、42.57、51.03百分點(P<0.05)。
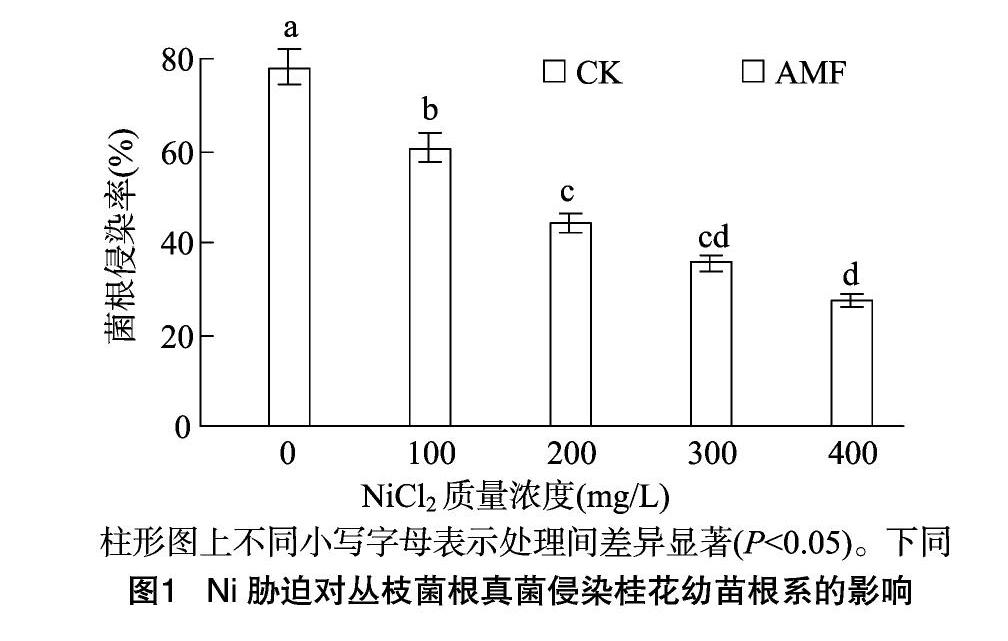
2.3叢枝菌根真菌對Ni脅迫下桂花幼苗葉片光合色素含量的影響
由圖2可見,隨Ni脅迫質量濃度的增大,接種、未接種AMF的桂花幼苗葉片葉綠素、類胡蘿卜素含量均呈逐漸下降趨勢?接種AMF的葉綠素、類胡蘿卜素含量均明顯高于未接
種處理;Ni脅迫質量濃度分別為100、200、300、400 mg/L時,接種AMF的桂花幼苗葉片葉綠素含量分別為14.25、11.69、9.05、7.23 mg/g,分別較未接種的顯著增加27.80%、4522%、44.34%、69.72%(P<0.05);Ni脅迫質量濃度分別為100、200、300 mg/L時,接種AMF的桂花幼苗葉片類胡蘿卜素含量分別為2.48、2.41、2.33 mg/g,分別較未接種的顯著增加10.22%、15.31%、23.94%,而Ni脅迫質量濃度為400 mg/L 時,接種AMF的桂花幼苗葉片類胡蘿卜素含量為1.68 mg/g,較未接種的增加33.33%,但相互間差異不顯著(P>0.05)。可見,Ni脅迫可明顯降低桂花幼苗葉片光合色素含量,而接種AMF可明顯提升Ni脅迫下桂花幼苗葉片的光合色素含量。
2.4叢枝菌根真菌對Ni脅迫下桂花幼苗葉片光合作用的影響
由圖3可知,隨Ni脅迫質量濃度的增大,接種、未接種AMF的桂花幼苗葉片凈光合速率(Pn)、氣孔導度(Gs)、蒸騰速率(Tr)均呈逐漸下降趨勢,且接種AMF的Pn、Gs、Tr均明顯高于未接種處理,而接種、未接種AMF的桂花幼苗葉片胞間二氧化碳濃度(Ci)呈先降后升趨勢,接種AMF的Ci顯著低于未接種處理;Ni脅迫質量濃度分別為100、200、300、400 mg/L 時,接種AMF的桂花幼苗葉片Pn分別為15.55、13.15、9.98、6.65 μmol/(m2·s),分別較未接種的增加1013%、18.58%、32.01%、80.22%,除Ni脅迫質量濃度為300 mg/L的葉片Pn與未接種的差異不顯著(P>0.05)外,其他3種質量濃度處理下接種AMF的葉片Pn顯著高于未接種的(P<0.05),接種AMF的桂花幼苗葉片Gs分別為241、201、153、102 mmol/(m2·s),分別較未接種的顯著增加711%、10.44%、33.04%、61.90%(P<0.05),接種AMF的桂花幼苗葉片Tr分別為3.12、2.71、2.35、2.18 mmol/(m2·s),分別較未接種的顯著增加11.03%、15.32%、19.90%、4248%;Ni脅迫質量濃度分別為100、400 mg/L時,接種AMF的桂花幼苗葉片Ci分別為260.35、358.69 μmol/mol,分別較未接種的顯著降低8.88%、6.98%。可見,Ni脅迫可明顯降低桂花幼苗葉片的Pn、Gs、Tr,增加Ci,光合作用受到明顯抑制,而接種AMF可明顯緩解Ni脅迫對桂花幼苗葉片光合作用的抑制。
2.5叢枝菌根真菌對Ni脅迫下桂花幼苗葉片抗氧化酶活性的影響
由表2可見,隨Ni脅迫濃度的增大,接種、未接種AMF的桂花幼苗葉片SOD、 POD、CAT活性均呈先升后降趨勢,除Ni脅迫質量濃度為0 mg/L外,接種AMF的SOD、POD、CAT活性均顯著高于未接種處理(P<0.05);Ni脅迫質量濃度為300 mg/L時,接種AMF的桂花幼苗葉片SOD、POD、CAT活性分別較未接種的顯著增加29.58%、32.59%、24.93%,Ni脅迫質量濃度為400 mg/L時,接種AMF的桂花幼苗葉片SOD、POD、CAT活性分別較未接種的顯著增加60.85%、2183%、22.03%。可見,接種AMF可明顯提升Ni脅迫下桂花幼苗葉片的抗氧化酶活性,提升抗氧化能力。
2.6叢枝菌根真菌對Ni脅迫下桂花幼苗葉片細胞膜透性的影響
由圖4可見,隨Ni脅迫濃度的增大,接種、未接種AMF的桂花幼苗葉片相對電導率呈逐漸增加趨勢,接種AMF的相對電導率多顯著低于未接種處理(P<0.05);Ni脅迫質量濃度分別為100、200、300、400 mg/L時,接種AMF的桂花幼苗葉片相對電導率分別為11.22%、16.75%、24.26%、4065%,分別較未接種的降低2.94、5.26、9.30、10.04百分點,除Ni脅迫質量濃度為100 mg/L的葉片相對電導率與未接種的差異不顯著(P>0.05)外,其他3種質量濃度處理下接種AMF的葉片相對電導率顯著高于未接種的;隨Ni脅迫質量濃度的增大,接種、未接種AMF的桂花幼苗葉片MDA含量呈先降后增趨勢;Ni脅迫質量濃度分別為100、200 mg/L時,接種AMF的桂花幼苗葉片MDA含量分別為16.85、1856 nmol/g,分別較未接種的降低0.94%、12.70%,與未接種的差異不顯著(P>0.05),而Ni脅迫質量濃度分別為300、400 mg/L時,接種AMF的桂花幼苗葉片MDA含量分別為23.25、31.92 nmol/g,分別較未接種的顯著降低18.68%、1921%。這說明,Ni脅迫可對桂花幼苗葉片的細胞膜造成破壞,而接種AMF可顯著降低Ni脅迫下桂花幼苗葉片的細胞膜破壞程度,可能是由于接種AMF可明顯提升Ni脅迫下桂花幼苗葉片的抗氧化水平,進而降低活性氧水平所致。
3結論與討論
菌根侵染率是衡量植物根系菌根化的重要指標,侵染率越高說明菌根效應越強[19]。本研究結果表明,隨鎳(Ni)脅迫質量濃度的增大,接種叢枝菌根真菌(AMF)的桂花幼苗根系菌根侵染率逐漸降低,Ni脅迫質量濃度分別為0、400 mg/L時,接種AMF的桂花幼苗根系菌根侵染率分別為78.25%、27.22%,差異顯著(P<0.05),可能是由于重金屬脅迫會對叢枝菌根真菌合成和侵染產生一定的抑制作用,這與尹大川等的研究結果[14,19]較為一致。
葉片光合色素是植物進行光合作用的重要色素,其含量高低與植物光合作用強弱密切相關。本研究結果表明,隨著Ni脅迫質量濃度的增大,桂花葉片葉綠素、類胡蘿卜素含量呈逐漸下降趨勢,而接種AMF的桂花其葉綠素、類胡蘿卜素含量均明顯高于未接種處理。凈光合速率(Pn)、氣孔導度(Gs)、蒸騰速率(Tr)、胞間二氧化碳(Ci)是衡量光合作用的重要參數(shù)。本研究結果表明,隨著Ni脅迫質量濃度的增大,桂花葉片Pn、Gs、Tr呈逐漸降低趨勢,而Ci則呈先降后增趨勢,接種AMF的桂花幼苗葉片Pn、Gs、Tr明顯高于未接種處理、Ci則明顯低于未接種處理;Ni脅迫質量濃度為400 mg/L時,接種AMF的桂花幼苗葉片葉綠素含量、Pn、Gs、Tr分別較未接種顯著增加69.72%、80.22%、61.90%、42.48%(P<005),而Ci則較未接種顯著降低6.98%,這種造成光合速率下降的原因可能是由于Ni脅迫可使葉肉細胞光合活性下降所致,而接種AMF可明顯緩解桂花因Ni脅迫而造成的光合色素降解,進而提高光合速率,同時,接種AMF可明顯提升Ni脅迫下桂花的葉肉細胞光合活性,從而提高光合速率,這與尹大川等的研究結果[14,19]較為一致。
植物在遭遇生物和非生物脅迫時,會啟動自身的抗氧化防御體系,以最大程度地減少逆境對自身造成的傷害[20]。本研究結果表明,隨Ni脅迫質量濃度的增大,桂花葉片超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)活性均呈先增后降趨勢,而接種AMF的SOD、POD、CAT活性均明顯高于未接種處理。相對電導率和丙二醛(MDA)含量是衡量膜質過氧化程度的重要指標。本研究結果表明,隨Ni脅迫質量濃度的增大,桂花葉片的相對電導率和MDA含量呈增加趨勢,且接種AMF的相對電導率、MDA含量均明顯低于未接種處理;Ni脅迫質量濃度為400 mg/L時,接種AMF的桂花幼苗葉片SOD、POD、CAT活性分別較未接種的顯著增加60.85%、21.83%、22.03%,而相對電導率、MDA含量分別較未接種的顯著降低10.04%、19.21%,接種AMF可明顯提升鎳脅迫下桂花葉片的抗氧化酶活性,活性氧清除能力有明顯增加,細胞受傷害程度有明顯降低,這與尹大川等的研究結果[14,19]較為一致。
另外,本研究結果表明,隨Ni脅迫質量濃度的增大,桂花幼苗植株株高、莖粗、總干物質質量呈逐漸下降趨勢,接種AMF的植株株高、莖粗、總干物質質量均明顯高于未接種處理;Ni脅迫質量濃度為400 mg/L時,接種AMF的桂花株高、總干物質質量分別較未接種的顯著增加22.12%、15.76%,這可能是由于接種AMF可明顯提升鎳脅迫下桂花的光合速率,緩解鎳脅迫對桂花生長發(fā)育造成的傷害,進而促進桂花生長,這與尹大川等的研究結果[14,19]較為一致。
參考文獻:
[1]黃益宗,郝曉偉,雷鳴,等. 重金屬污染土壤修復技術及其修復實踐[J]. 農業(yè)環(huán)境科學學報,2013,32(3):409-417.
[2]Mcbride M B. Environmental chemistry of soils[M]. New York:Oxford Univemity Press,1994.
[3]劉仕翔,黃益宗,羅澤嬌,等. 褪黑素對水稻幼芽鎳脅迫的緩解作用[J]. 環(huán)境科學,2017,38(4):1675-1682.
[4]黃錦孫,韋東普,郭雪雁,等. 田間土壤外源銅鎳在小麥中的累積及其毒害研究[J]. 環(huán)境科學,2012,33(4):1369-1375.
[5]姚俊朝,殷永泉,崔兆杰,等. Ni和V脅迫對翅堿蓬和棉花生長生理的影響[J]. 環(huán)境科學與技術,2013,36(12):33-37.
[6]賈振宇,于潔,德英,等. 叢枝菌根真菌接種對羊草抗旱性的影響[J]. 干旱區(qū)資源與環(huán)境,2017,31(1):132-136.
[7]Matsubara Y,Tamura H,Harada T. Growth enhancement and verticillium wilt control by vesicular-arbuscular mycorrhizal fungus inoculation in eggplant Solanum melongena[J]. Journal of the Japanese Society for Horticultural Science,1995,64(3):555-561.
[8]Gaur A,Adholeya A. Prospects of arbuscular mycorrhizal fungi in phytoremediation of heavy metal contaminated soils[J]. Current Science,2004,86(4):528-534.
[9]Gohre V,Paszkowski U. Contribution of the arbuscular mycorrhizal symbiosis to heavy metal phytoremediation[J]. Planta,2006,223(6):1115-1122.
[10]Li X L,Christie P. Changes in soil solution Zn and pH and uptake of Zn by arbuscular mycorrhizal red clover in Zn-contaminated soil[J]. Chemosphere,2001,42(2):201-207.
[11]Hildebrandt U,Regvar M,Bothe H. Arbuscular mycorrhiza and heavy metal tolerance[J]. Phytochemistry,2007,68(1):139-146.
[12]黃晶,凌婉婷,孫艷娣,等. 叢枝菌根真菌對紫花苜蓿吸收土壤中鎘和鋅的影響[J]. 農業(yè)環(huán)境科學學報,2012,31(1):99-105.
[13]王凱淵,蔣園園,宋文俊,等. AM真菌與鎘互作影響桑生長和無機元素吸收轉運[J]. 菌物學報,2017,36(7):996-1009.
[14]尹大川,鄧勛,宋小雙,等. Cd脅迫下外生菌根菌對樟子松生理指標和根際土壤酶的影響[J]. 生態(tài)學雜志,2017,36(11):3072-3078.
[15]Zhang X H,Wang L M,Zhang X,et al. Effects of arbuscular mycorrhizal fungi on upland rice oxidative stress induced by Cu and Pb contamination in soil[J]. Agricultural Science & Technology,2014,15(1):123-126.
[16]巴青松,張根生,凌玉,等. 根施甜菜堿對鎳脅迫下小麥幼苗生長生理的影響[J]. 西北植物學報,2017,37(2):315-320.
[17]孫天國,沙偉,張建. 水楊酸對鎳脅迫下甜瓜幼苗生理活性的影響[J]. 北方園藝,2010(11):39-41.
[18]Phillips J M,Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society,1970,55(1):158-161.
[19]楊國,盧可,朱高樑,等. 叢枝菌根真菌摩西球囊霉對銅脅迫下白術幼苗光合特性及抗氧化酶活性的影響[J]. 植物生理學報,2018,54(4):618-626.
[20]樊瑞蘋,周琴,周波,等. 鹽脅迫對高羊茅生長及抗氧化系統(tǒng)的影響[J]. 草業(yè)學報,2012,21(1):112-117.

