納米ZnO對1株異養硝化-好氧反硝化菌Halomonas sp. KGL1的生物脅迫效應研究?
康兆顏, 白 潔,2, 郭曉旭, 陳 琳, 胡春輝, 李巋然
(1.中國海洋大學環境科學與工程學院,山東 青島 266100; 2.中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 266100; 3.青島農業大學生命科學學院,山東 青島 266109;4.中國海洋大學海洋生命學院,山東 青島 266003)
納米技術的迅速發展引起眾多領域發生革命性變化,隨著納米產品種類和數量的逐年遞增,釋放到環境中的納米材料量也逐漸增多,嚴重威脅生態環境和人類健康,因此納米材料的安全性近年來受到國內外眾多學者的廣泛關注[1]。ZnO-NPs因其同時具有納米材料和傳統氧化鋅材料的雙重特性,在紡織工業、化妝品、工業涂層、醫學抗菌和水處理等領域中被廣泛的應用[2-4],導致其被加速釋放到水環境中。由于納米材料具有顆粒小、表面積大的特點,與其他材料相比具有更大的表面活性和遷移性能,因此其毒性與常規尺寸的物質不同或毒性效應更大[5],且ZnO-NPs比其他金屬氧化物納米顆粒(如TiO2、SiO2、CuO等)的毒性更大[6-7]。
海洋作為各種污染物質的最終歸趨地,納米材料將不可避免地通過各種途徑進入海洋環境,人類利用海水進行水產品養殖等活動時產生的高鹽含氮廢水中也會含有納米材料。據報道,ZnO-NPs被頻繁檢測到存在于污水處理系統中[8-9],自然水體中ZnO-NPs顆粒的總量在1~100 μg·L-1之間,但由于污水處理系統的過濾、沉淀功能以及納米顆粒易吸附在生物活性污泥表面等性質,導致污水處理系統中納米顆粒濃度累積達到mg·L-1的水平[10]。納米顆粒的累積會影響海水養殖污水處理系統中脫氮細菌的正常生長代謝,從而導致水處理生物脫氮效率下降,影響海水養殖廢水的循環利用及排放,最終會對海洋生態系統造成危害[9],其中河口地區污染尤為嚴重[11]。
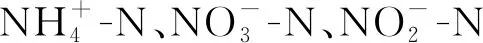
1 材料與方法
1.1 ZnO-NPs的表征及懸濁液制備
本研究中ZnO-NPs購自美國Sigma-Aldrich公司,純度>99.7%,直接取樣用于觀察表征ZnO-NPs的形態;為制備懸濁液,取500 mg ZnO-NPs分散于100 mL經高溫滅菌的去離子水中,使用前室溫下超聲3 h,現用現配。
1.2 菌株來源及培養基
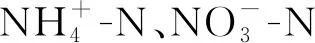

微量元素溶液(g·L-1):Na2EDTA 63.70;CaCl25.50;ZnSO42.20;MnCl2·4H2O 5.06;FeSO4·7H2O 5.0;CoCl2·6H2O 1.61;Na2MoO4·4H2O 1.10;CuSO4·5H2O 1.57。
1.3 ZnO-NPs對Halomonas sp. KGL1的短期暴露實驗

1.4 測定方法

LDH使用南京建成生物公司的LDH試劑盒來檢測,取適量菌液1 000 r·min-1離心5 min,取上清液并逐步添加試劑后,使用酶標儀(Multiskan Spectrum)在450 nm波長下測定樣品。
ROS使用南京建成生物公司的活性氧試劑盒來檢測,取適量菌液加入適量的ROS探針DCFH-DA(2,7-dichlorofuorescin diacetate),在細菌培養相同條件下培養30 min 后,1 000 r·min-1離心10 min收集菌體,用pH為7.4的PBS緩沖液洗滌菌體2次,使用流式細胞儀(AccuriTM C6 Plus Flow Cytometer)在最佳激發波長485 nm、最佳發射波長525 nm下進行樣品測定。
1.5 數據分析
采用SPSS Statistics統計軟件進行T檢驗差異性分析,當P<0.05時表示有顯著性差異。
2 結果與分析
2.1 ZnO-NPs的形態表征
經透射電子顯微鏡掃描分析顯示(見圖1),ZnO-NPs顆粒形態呈不規則桿狀,粒徑較不均勻,但粒徑均低于100 nm,有研究發現[25-27],顆粒尺寸會影響ZnO-NPs的毒性,尺寸越小,比表面積越大,暴露于顆粒表面的活性位點越多,顆粒的表面活性越強,ZnO-NPs的毒性也越強;其顆粒間存在不同程度的團聚,因此后續實驗中使用ZnO-NPs時,都使用超聲分散儀進行分散,以有效緩解其團聚現象。
2.2 不同濃度ZnO-NPs對Halomonas sp. KGL1形態結構的影響
細菌表面一般帶有負電荷,帶正電荷的ZnO-NPs和細菌間可能產生較強的靜電引力,使其更容易吸附到細菌表面,直接與細菌接觸[28]。納米顆粒吸附在細菌表面會磨損細胞壁、損傷細胞膜,同時由于ZnO-NPs顆粒體積微小,可能堵塞細菌細胞膜上的各種運輸通道,導致細胞膜滲透性增加,引起細菌細胞破裂等,一部分ZnO-NPs顆粒還可能進入細胞內[29],進一步造成菌體形態結構的損傷。

圖1 ZnO-NPs透射電鏡圖Fig.1 TEM image of ZnO-NPs
菌株Halomonassp. KGL1在不同濃度ZnO-NPs暴露24 h后的形態如圖2所示,對照組菌體為短桿狀且形態飽滿分散(見圖2(a)),隨著ZnO-NPs濃度的升高,菌體發生不同程度的團聚和損傷。ZnO-NPs濃度為1 mg·L-1時菌體表面即開始出現粘連現象,發生小規模團聚,但沒有明顯的損傷產生(見圖2(b))。隨著ZnO-NPs濃度升高到10和50 mg·L-1時,菌體出現大規模團聚和粘連現象,菌體開始出現損傷,濃度為10 mg·L-1時少部分菌體發生凹陷(見圖2(c)),濃度為50 mg·L-1時菌體損傷嚴重,較多的菌體出現凹陷和破碎現象(見圖2(d))。結果表明ZnO-NPs濃度越高,對該菌株形態結構的影響越顯著。有研究通過透射電子顯微鏡觀察到ZnO-NPs可導致污水生物處理系統中的典型氨氧化菌Nitrosomonaseuropaea(N.europaea)的細胞形態發生改變、細胞膜受到損傷,并呈現顯著的濃度抑制效應[20-21,30],其結果與本研究相似。
2.3 不同濃度ZnO-NPs對Halomonas sp. KGL1細胞膜完整性的影響
細胞膜作為細胞接觸外界的第一道屏障,可以維持細胞內穩定的代謝環境,同時調節和選擇進出細胞的營養物質。LDH是一種細胞溶質酶,在正常情況下,不能透過細胞膜,當細胞膜發生損傷時,LDH即會釋放到細胞外,因此可以通過對LDH釋放率的分析推測出菌株Halomonassp. KGL1細胞膜的完整性[31]。
以對照組LDH釋放率為100%,計算該菌株在不同濃度ZnO-NPs暴露24 h后LDH的釋放率。如圖3所示,隨ZnO-NPs濃度的增加,LDH釋放率呈上升趨勢。當ZnO-NPs濃度為1和10 mg·L-1時,LDH釋放率分別為118%和136%,在這兩種濃度下ZnO-NPs對菌株細胞膜完整性無顯著影響(P>0.05);當ZnO-NPs濃度為50 mg·L-1時,LDH釋放率為372%,顯著高于對照組(P<0.05),表明該菌株在此暴露濃度下細胞膜完整性受到嚴重破壞,導致菌體形態結構發生顯著變化,與掃描電鏡(見圖2(d))的結果一致。已有研究發現8 mg·L-1的ZnO-NPs會導致大腸桿菌細胞產生LDH,并且使細胞膜滲透性明顯増強[32],與之相比,本研究中菌株相對更加敏感,1 mg·L-1的ZnO-NPs即會導致該菌株的細胞產生LDH,改變菌株細胞膜的粘滯性。

((a)0 mg ·L-1;(b)1 mg ·L-1;(c)10 mg ·L-1;(d)50 mg ·L-1)
圖2 ZnO-NPs對Halomonassp. KGL1形態的影響
Fig.2 Impacts of ZnO-NPs on morphology ofHalomonassp. KGL1
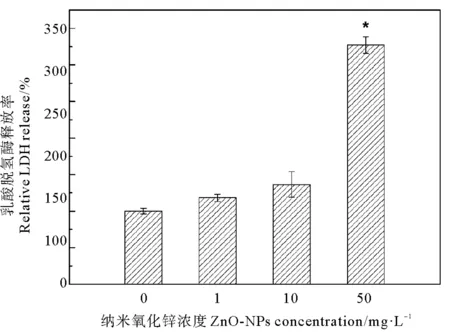
(*表示與對照組相比,兩組間差異顯著,下同。* indicates that there is a significant difference between the two groups compared with the control group, the same below.)
圖3 ZnO-NPs對LDH釋放的影響
Fig.3 Impacts of ZnO-NPs on LDH production
2.4 不同濃度ZnO-NPs對Halomonas sp. KGL1活性氧的影響
ROS是一類含氧活性分子的總稱,主要有3種類型:超氧陰離子(O2-),過氧化氫(H2O2)以及羥自由基(·OH),細菌體內代謝過程會產生少量ROS,在外源環境的脅迫下則會產生過多ROS[33]。
以對照組中ROS產生率為1,研究菌株Halomonassp. KGL1在不同濃度ZnO-NPs暴露24 h后ROS的產生情況(見圖4)。ZnO-NPs脅迫會使該菌株細胞產生ROS,且隨ZnO-NPs濃度的增加,ROS產生量越高。當ZnO-NPs濃度為1和10 mg·L-1時,檢測到ROS含量分別為對照組的1.11和1.27倍(P>0.05),且菌株細胞膜未發生顯著損傷,表明在這兩種濃度下ZnO-NPs未誘導菌株細胞發生明顯的氧化應激效應;當ZnO-NPs濃度為50 mg·L-1時,檢測到ROS含量為對照組的2.76倍(P<0.05),ROS產生量顯著增大,在此濃度下菌株細胞氧化應激效應顯著,從而導致菌體嚴重損傷(見圖2(d)),產生該結果的原因可能與細胞膜被破壞(見圖3)導致ZnO-NPs進入菌株細胞有關。結果表明ZnO-NPs對該菌株的生物脅迫效應除直接作用于菌株表面外,也與菌株細胞內ROS水平變化密切相關。
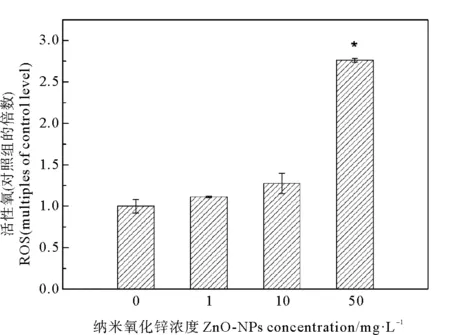
圖4 ZnO-NPs對ROS釋放的影響Fig.4 Impacts of ZnO-NPs on ROS production
2.5 不同濃度ZnO-NPs對Halomonas sp. KGL1生長的影響
菌株細胞損傷會影響菌株的生長,不同濃度ZnO-NPs對菌株Halomonassp. KGL1生長的影響如圖5所示。菌株在不同濃度ZnO-NPs暴露初期OD600值的變化趨勢一致,但暴露8 h后不同濃度組的菌株生長速率開始出現差異,ZnO-NPs濃度越高,菌株生長速率越慢,OD600值越低。當ZnO-NPs濃度為1 mg·L-1時,菌株的OD600值變化趨勢較對照組無顯著差異(P>0.05);當菌株在ZnO-NPs濃度為10、50 mg·L-1的培養基中培養24 h后,OD600值分別為1.82和1.36,分別較對照降低19%和43%(P<0.05),生長速率受到顯著抑制。由此可見,ZnO-NPs濃度越高,對該菌株生長的抑制程度越強,產生該結果的原因可能與高濃度ZnO-NPs導致細胞結構破壞并產生大量ROS有關。
2.6 不同濃度ZnO-NPs對Halomonas sp. KGL1脫氮能力的影響
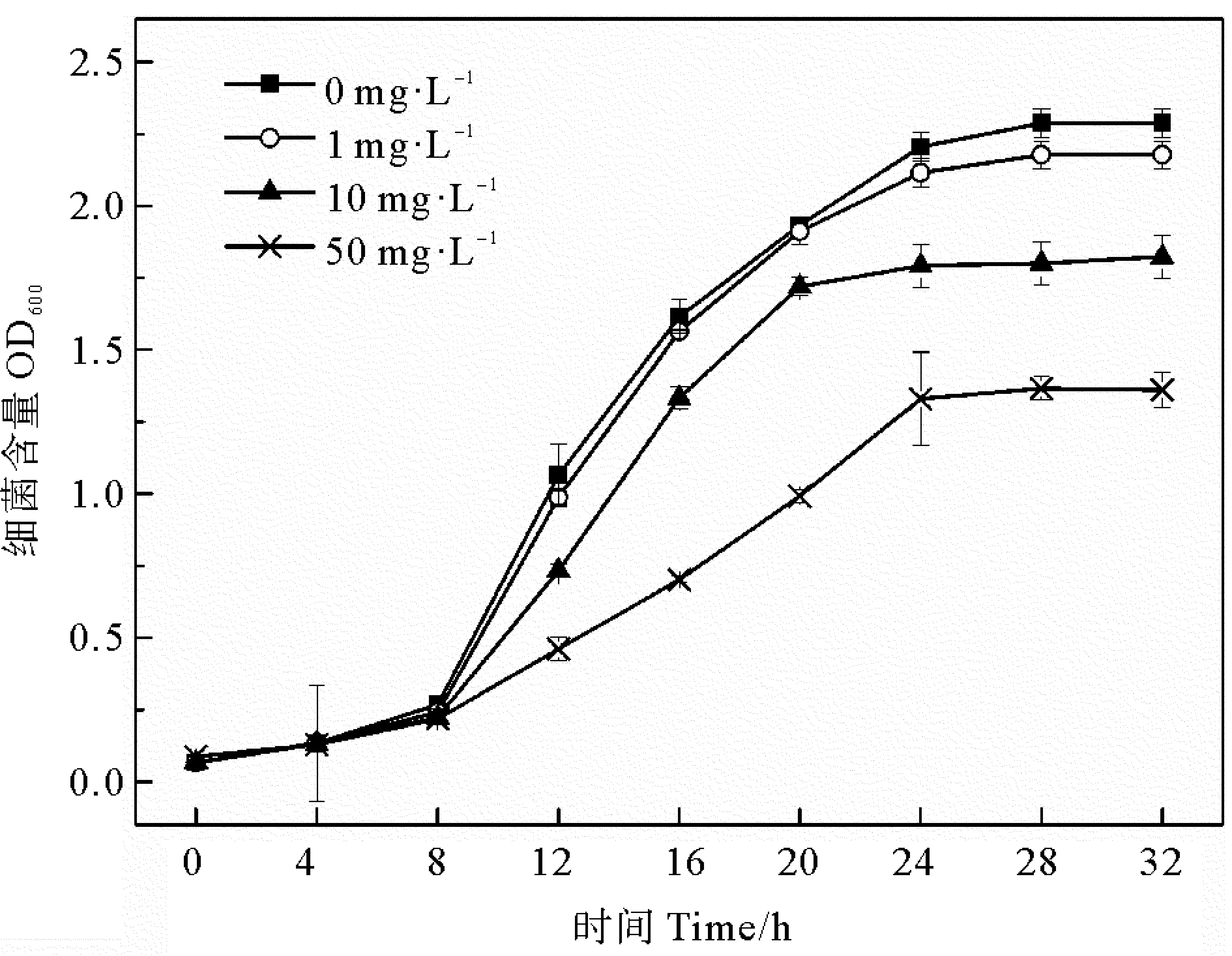
圖5 ZnO-NPs對菌株生長的影響Fig.5 Impacts of ZnO-NPs on growth of Halomonas sp. KGL1

圖6 ZnO-NPs對去除率的影響Fig.6 Impacts of ZnO-NPs on removal efficiency of
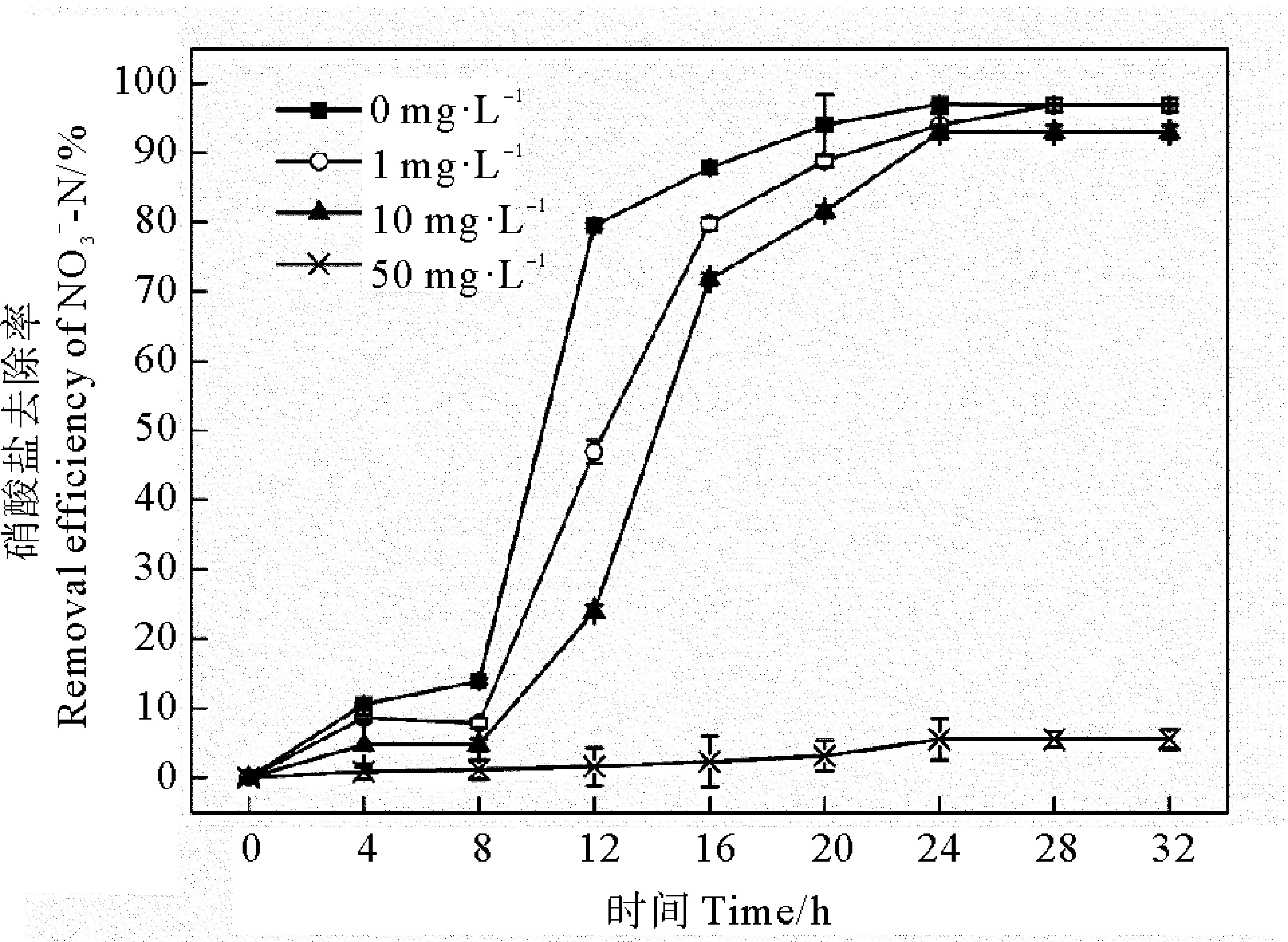
圖7 ZnO-NPs對去除率的影響Fig.7 Impacts of ZnO-NPs on

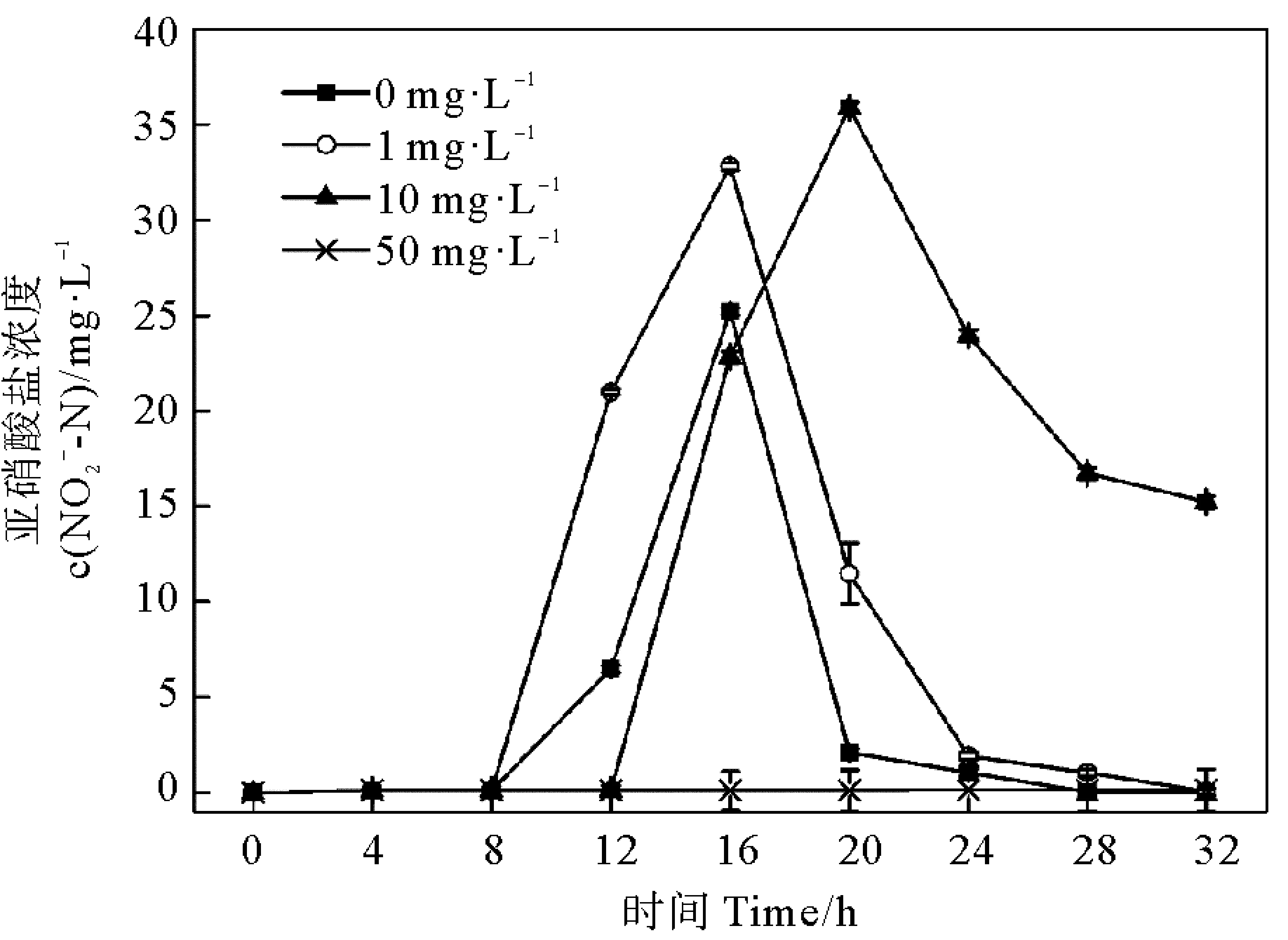
圖8 ZnO-NPs對累積量的影響Fig.8 Impacts of ZnO-NPs on accumulation amount of
3 討論
目前關于納米材料對細菌毒性機制的研究主要集中在細胞膜損傷和氧化脅迫兩個方面[21],其中ROS的產生等對生物體的氧化脅迫目前被認為是導致納米材料生物脅迫效應的主要方式[34-36]。ZnO-NPs等納米材料可與細菌細胞直接接觸,并吸附在細菌細胞膜表面[12],進而改變細胞膜粘滯性和細胞膜滲透性,此外,ROS的產生也可能會損傷細菌細胞膜[37-39],細胞膜的損傷導致細菌細胞形態發生改變并且損傷細胞功能,甚至導致細胞死亡[40-41]。本研究通過掃描電鏡的觀察研究以及對LDH的測定發現,ZnO-NPs會破壞菌株Halomonassp. KGL1的細胞膜,改變菌株細胞膜粘滯性,從而導致菌株細胞發生團聚,菌體形態結構發生變化,其中50 mg·L-1的ZnO-NPs對菌株細胞影響最為顯著。細胞膜被破壞可能導致ZnO-NPs進入細菌細胞誘導其發生氧化應激效應,細胞內氧化與抗氧化作用失衡造成細胞內ROS累積[42],過量ROS會導致細胞中DNA、脂質、蛋白質等分子過度氧化,脂質過氧化會引起機體一系列代謝反應的失常和免疫功能降低,損害生物膜及其功能,對細胞造成進一步損傷[32]。已有研究者[15,21-22,34,37]發現ZnO-NPs導致細菌細胞膜完整性被破壞、細菌濃度、脫氮速率降低的原因可能與ZnO-NPs誘導細胞內ROS大量產生密切相關。本研究中,ZnO-NPs能夠誘導菌株Halomonassp. KGL1細胞發生氧化應激效應產生ROS,且ROS的產生量與ZnO-NPs濃度呈正相關關系,50 mg·L-1的ZnO-NPs誘導菌株細胞產生大量ROS,并且在該濃度下菌株生長和脫氮過程受脅迫程度最強。

綜上所述,當海水養殖污水處理系統中ZnO-NPs濃度低于10 mg·L-1時,菌株Halomonassp. KGL1在該環境中受脅迫程度較小,其在處理此類高鹽含氮廢水時仍可以發揮高效的脫氮能力,并且當ZnO-NPs濃度低于1 mg·L-1時,對菌株Halomonassp. KGL1的影響是可以忽略不計的。鑒于納米材料應用的日趨廣泛性與潛在的安全性問題, 不同納米材料對菌株Halomonassp. KGL1的生物脅迫效應需要繼續探究。
4 結論
(1) ZnO-NPs對菌株Halomonassp. KGL1的生物脅迫除直接作用于菌體表面破壞菌株細胞細胞膜和形態結構外,也與菌株細胞內ROS水平密切相關。
(2) ZnO-NPs濃度為1 mg·L-1時對菌株Halomonassp. KGL1無顯著影響,濃度為50 mg·L-1時對菌株Halomonassp. KGL1抑制作用顯著,各生物脅迫效應強度均隨ZnO-NPs濃度的升高而增大。

