P16INK4A免疫組化染色在CIN2患者分流中的作用
宋 潔,張曉松,畢 蕙
(1.北京大學第一醫院婦產科,北京 100034;2.保定市第一中心醫院婦科,河北 保定 071000)
臨床上對于子宮頸上皮內瘤變(cervical intraepithelial neoplasia,CIN)2級患者的管理一直存在爭議,大量的研究證據表明CIN1為HPV一過性感染所致的病理改變,約90%婦女病變可自然消退或處于靜止狀態,為非子宮頸浸潤癌的癌前病變,CIN3為子宮頸浸潤癌的癌前病變,如果不干預,每年有1%~2%的婦女進展為浸潤癌,是目前子宮頸癌早診早治的主要目標人群。而CIN2有超過60%的婦女可自然消退或處于靜止狀態,尤其是年輕女性,進展為浸潤癌的幾率低于5%[1-3]。但同時對所有的CIN2患者進行干預,尤其是年輕婦女可導致恐懼、焦慮等情緒以及妊娠時早產、胎膜早破、低出生體重兒等的風險增加[4]。如何平衡干預的利益與風險,如何將組織學CIN2中真正的高級別病變分流出來并進行針對性的治療是子宮頸癌預防的關鍵所在。由于既往的HE染色病理為形態學的診斷,人為因素較多,臨床需要一種更為量化的指標來輔助病理診斷,以提高病理診斷的準確性。目前研究也發現P16INK4A表達與鱗狀上皮病變的級別高度相關[5],2012年美國病理醫師協會,陰道鏡檢查與子宮頸病理協會也建議采用P16INK4A免疫組織化學染色進一步分流HE染色病理診斷為CIN2的患者,以提高CIN2診斷的特異性。為了進一步闡明P16INK4A免疫組織化學染色在CIN2患者分流中的作用,本研究將2010年1月至2012年12月及2014年9月至2015年4月在北京大學第一醫院病理科根據HE染色診斷的CIN2患者進行P16INK4A免疫組織化學染色分層,并與既往組織學診斷的CIN2患者進行比較,分析P16INK4A在降低CIN2診斷級別及預測錐切術后高級別子宮頸鱗狀上皮內病變(high-grade squamous intraepithelial lesion,HSIL)的作用。
1資料與方法
1.1研究對象
收集北京大學第一醫院婦科門診2010年1月至2012年12月及2014年9月至2015年4月在陰道鏡指引下行宮頸多點活檢診斷CIN2患者共444例,年齡在20~76歲,平均年齡(40.34±9.53)歲。所有病例均因子宮頸癌篩查細胞學和(或)人乳頭瘤病毒(human papilloma virus,HPV)高危型分型檢測異常轉診陰道鏡檢查,并對陰道鏡異常發現者進行陰道鏡多點活檢組織病理學檢查,對HE染色形態學診斷為CIN2患者行子宮頸錐切術。
1.2分組情況
444例病理診斷CIN2患者按診斷的時期分為兩組,將2014年9月至2015年4月診斷的107例CIN2患者設為A組,對HE染色形態學診斷CIN2的組織蠟塊再次連續切片,行P16INK4A免疫組織化學染色,全部采用P16INK4A分流。根據P16INK4A染色程度的不同又分為染色陽性組、灶陽組及染色陰性組;并將CIN2 P16INK4A染色陽性者定義為HSIL,將CIN2 P16INK4A染色陰性或灶狀陽性者定義為低級別子宮頸鱗狀上皮內病變(low-grade squamous intraepithelial lesion,LSIL)。同時將2010年1月至2012年12月(該時期尚未開展P16INK4A免疫組化染色)診斷的337例患者設為B組,CIN的診斷根據HE染色的形態學結果得出。
1.3陰道鏡檢查指征
細胞學未見異常但HPV高危亞型16、18、31、33陽性、細胞學不能明確意義的非典型鱗狀上皮細胞(atypical squamous cells of undertermined significance,ASC-US)HPV高危亞型陽性、細胞學LSIL及以上,以及所有腺上皮細胞異常者轉診陰道鏡檢查,在陰道鏡指引下在病變最異常處行多點活檢,對于不滿意陰道鏡檢查必要時行子宮頸四象限隨機活檢+子宮頸管黏膜搔刮術(endocervical curettage,ECC)。
1.4子宮頸錐切術方法選擇
對于陰道鏡指引下多點活檢病理診斷CIN2患者444例全部行子宮頸環電切術(Loop electrosurgical excision procedure,LEEP)。所有病理切片均經兩位病理科醫生閱片,對于診斷不一致的病理片由第三位病理醫生復審。
1.5 P16INK4A蛋白的檢測及免疫組化陽性結果判斷
采用免疫組織化學方法檢測,取子宮頸組織石蠟切片,按試劑盒說明書進行操作,一抗用鼠抗人的P16INK4A單克隆抗體(克隆號E6H4,Roche),1∶100稀釋。陰性對照為磷酸鹽緩沖液(PBS)替代一抗,陽性對照為已知陽性的胰腺切片。免疫組化陽性結果判定:P16INK4A陽性表達定位在細胞核和細胞質,細胞核或細胞質出現棕黃色為染色陽性細胞。著色按陽性細胞所占百分比并參考著色強度確定分級如下:染色陽性組,上皮彌漫全層染色;灶陽組,局灶、不連續染色陽性;陰性組,無明顯染色。
1.6 統計學方法
采用SPSS 22.0統計軟件進行分析,各年齡組間差異以及不同組間錐切術后病理級別的差異采用χ2檢驗,P<0.05為差異有統計學意義。
2結果
2.1 CIN2患者年齡分布
CIN2患者年齡20~76歲,平均年齡(40.34±9.53)歲。其中A組平均年齡(41.80±10.53)歲,B組平均年齡(39.88±9.15)歲,兩組患者在不同年齡段所占比例比較無統計學差異(χ2=3.698,P=0.055),見表1。
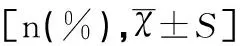
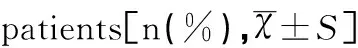

年齡(歲)A組(n=107)B組(n=337)<255(4.7)7(2.1)25~3425(23.4)103(30.6)35~4443(40.2)134(39.8)45~5421(19.6)68(20.2)55~648(7.5)23(6.8)≥655(4.7)2(0.6)平均年齡41.80±10.5339.88±9.15
2.2 CIN2患者的HPV高危亞型檢測結果
444例CIN2患者中HR-HPV檢測陰性者18例,占4.1%(18/444),陽性者426例,占95.9%(426/444)。排在前五位的亞型分別為:HPV16型,占49.1%(218/444);HPV58型,占15.3%(68/444);HPV33型,占14.9%(66/444);HPV18型52型,占13.9%(62/444);HPV31型,占6.8%(30/444)(對多重型感染者,亞型陽性率重復計算)。在A組中,HR-HPV陽性者101例,占94.4%(101/107);在B組中,HR-HPV陽性者315例,占93.5%(315/337)。
2.3 CIN2患者子宮頸錐切術后病理結果
A組中,錐切術后病理≤CIN1共34例,占31.8%(34/107);CIN2 44例,占41.1%(44/107);CIN3 29例,占27.1%(29/107);浸潤癌0例。
B組中,錐切術后病理≤CIN1共133例,占39.5%(133/337);CIN2 143例,占42.4%(143/337);CIN3 60例,占17.8%(60/337);宮頸癌1例,占0.3%(1/337)。
2.4 A組中P16INK4A染色的表達
在107例CIN2患者中,P16INK4A陽性者85例,占79.4%(85/107),P16INK4A灶陽者16例,占15.0%(16/107),P16INK4A陰性者6例,占5.6%(6/107)。
2.5子宮頸錐切術前及術后病理一致性的比較
陰道鏡下多點活檢病理診斷的444例CIN2患者,錐切術后病理CIN2及以上的共277例,病理診斷陽性率為62.4%(277/444),子宮頸活檢病理診斷的CIN2預測錐切術后病理診斷為CIN2+的陽性預測值(positive predictive valve,PPV)為62.4%。A組、B組錐切術后病理診斷CIN2及以上的陽性預測值見表2。兩組患者錐切術前、術后病理結果相比無統計學差異(χ2=5.739,P>0.05)。
表2 A、B組錐切術后病理診斷CIN2及以上病變的陽性預測值比較[n(%)]

Table 2 Comparison of PPV of CIN 2 and above in pathological diagnosis after LEEP between group A and group B[n(%)]
2.6 A組中不同P16INK4A的表達與錐切術前后病理一致性的比較
按P16INK4A染色程度不同進行進一步分層分析,P16INK4A陽性組與P16INK4A灶陽組及陰性組相比較,錐切術前后病理一致性的差異有統計學意義(χ2值分別為10.603、10.733,均P<0.05,調整α’=0.0167>P值);灶陽組與P16INK4A陰性組相比較,錐切術前后病理一致性的差異無明顯統計學意義(χ2=0.873,P=0.350)。
如果采用下生殖道鱗狀細胞診斷術語(lower anogenital squemous terminology,LAST)的診斷標準,A組中有22例P16INK4A陰性者歸為LSIL,占20.6%(22/107);另85例P16INK4A陽性者歸為HSIL,占79.4%(85/107),則A組子宮頸活檢病理診斷的HSIL預測錐切術后病理診斷為CIN2+的陽性預測值提高至77.6%。
2.7 B組與A組中不同P16INK4A結果的比較
B組與A組中P16INK4A陽性組相比較,錐切術前后病理一致性的差異有統計學意義(χ2=8.626,P=0.003);B組與P16INK4A灶陽組相比較,錐切術前后病理一致性的差異無明顯統計學意義(χ2=7.818,P=0.098);B組與P16INK4A陰性組相比較,錐切術前后病理一致性的差異有統計學意義(χ2=18.143,P=0.001),見表3。
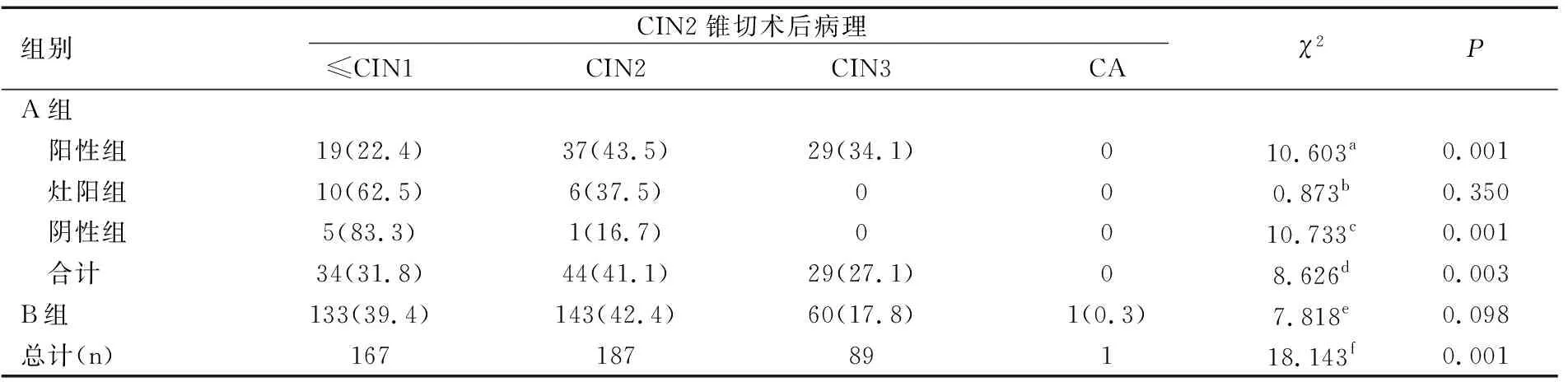
表3 B組與A組中不同P16INK4A結果下錐切術后病理結果的比較[n(%)]
注:aP16INK4A陽性組與灶陽組比較;b灶陽組與陰性組比較;c陰性組與陽性組比較;dB組與A組P16INK4A陽性者的比較;eB組與 A組P16INK4A灶陽者的比較;fB組(組織學CIN2)與A組P16INK4A陰性者的比較。
3討論
3.1 P16INK4A免疫組織化學染色可對HE病理診斷的CIN2分流,提高HSIL診斷的一致性
目前的研究發現P16INK4A蛋白可與cyclinD1競爭性結合CDK4,抑制CDK4 酶活性,P16INK4A/CDK-cyclinD/Rb分子復合物是細胞出G1期進入S期的關鍵因子,該分子鏈中任何基因異常都可使該分子失去細胞周期的控制作用。高危型HPV表達的E7蛋白通過與PRb結合擾亂了Rb基因的正常功能,使其功能失活,解除了PRb對P16INK4A蛋白表達的負反饋抑制,引起P16INK4A過表達[6],導致宮頸上皮細胞的細胞周期發生紊亂,使其具有永生性的特點而啟動一系列癌變過程[7-10]。李思琦等[11]曾對35歲以下CIN患者的病理切片行P16INK4A及Ki67免疫組化染色,發現二者染色的陽性率與CIN的分級有著非常好的一致性。
既往的研究發現不同病理學家對于HE染色診斷的CIN2的可重復性差,一致性低于50%[12]。2007年在美國癌癥協會督導項目中Castle等兩位病理專家回顧CIN2病理片的診斷一致性僅有13%及31%,而CIN3的診斷一致性可達84%及81%。2009年在美國ALTS研究中Dalla 等發現CIN2的可重復性僅有43%。Meta分析發現與單純HE染色相比,輔助使用p16INK4A染色提高了診斷者間的診斷一致性[13]。2012年美國病理醫師協會和陰道鏡檢查與子宮頸病理協會建議采用肛門下生殖道HPV相關的鱗狀上皮病變術語,將既往的子宮頸上皮內瘤變病理診斷分級分類法改為二級分類,即LSIL與HSIL,并建議采用P16INK4A免疫組織化學染色對HE病理診斷的CIN2進行進一步分流,將CIN1及CIN2 P16INK4A陰性者歸為LSIL,將CIN2 P16INK4A陽性及CIN3歸為HSIL,2014年WHO出版的第4版《女性生殖器官腫瘤分類》關于子宮頸鱗狀上皮癌前期病變也建議采用了鱗狀上皮內病變兩級命名即LSIL與HSIL。
3.2 P16INK4A免疫組織化學染色分流CIN2可降低20.6%患者的診斷級別,提高預測錐切術后CIN2+的能力
本研究通過對不同時期CIN2錐切術前后病理級別的對比發現陰道鏡下多點活檢病理診斷CIN2的對于錐切術后病理CIN2+總的陽性預測值為62.4%,但經過P16INK4A染色,僅對染色陽性的HSIL患者進行治療時,可降低20.6%患者的診斷級別,同時也減少了對20.6% CIN2患者的有創干預,并可將子宮頸活檢病理診斷的HSIL錐切術后診斷CIN2+的陽性預測值提高至77.6%。Maniar等[14]的研究也發現采用P16INK4A免疫組化染色分流子宮頸活檢病理診斷的CIN2患者時,可減少1/3 HSIL的診斷,同時發現用于手術前預測病變的級別更準確,可避免不必要的有創干預。Clinton等[15]的研究也發現由于廣泛使用P16INK4A免疫組化染色,子宮頸活檢病理的HSIL 診斷自1.4%提高至2.3%(P<0.05),同時P16INK4A陽性的HSIL的陽性預測值由48%增加至76%(P<0.05)。
在我們的研究中也發現A組中P16INK4A染色陽性者錐切術前后的病理一致性明顯高于P16INK4A染色灶狀陽性及陰性婦女,分別為77.6%、37.5%及16.7%,并均有統計學差異,這一結果也支持了美國LAST項目對于CIN患者進行P16INK4A分流并進行分層管理的理念。但在研究中也發現有15.0%(16/107)的患者P16INK4A染色上皮區域呈現灶狀、不連續染色陽性,這部分患者按照美國LAST項目中的管理是與P16INK4A染色陰性者一并歸為P16INK4A陰性,屬于低級別病變范疇,建議臨床隨訪觀察。但在我們的研究中也看到對于P16INK4A灶狀陽性及陰性的CIN2患者進行錐切后也分別診斷了6例(6/16,37.5%)及1例(1/6)的CIN2,由于納入的病例僅為107例,標本量相對較小,目前尚未見到術后為CIN3的病理,但也應引起足夠的重視。尤其是對于P16INK4A染色灶狀陽性患者,這部分患者的臨床結局與P16INK4A陰性者是否完全一致,在隨訪過程中進展為HSIL的比例是否高于P16INK4A陰性婦女仍需要擴大樣本量,并進行進一步的前瞻性研究。但在目前尚無足夠的循證醫學證據的情況下建議密切隨訪,以免漏診。
總之,對待CIN2患者的管理應個性化,尤其是在年輕有生育要求婦女中,建議行P16INK4A染色進一步分流,對于染色陽性者可行子宮頸消融或切除性治療,對于P16INK4A灶狀陽性或陰性婦女建議結合患者年齡、既往篩查歷史、細胞學及HPV檢測結果、陰道鏡滿意度等進行綜合評估,避免治療的過度與不足。

