中山杉組織培養中無菌體系建立的初步研究
黃志偉,曹 劍
?
中山杉組織培養中無菌體系建立的初步研究
黃志偉,曹 劍
(重慶三峽職業學院 農林科技系,重慶 404155)
為建立中山杉Zhongshanshan’無菌體系,從中山杉外植體消毒及腋芽啟動兩方面開展研究。外植體消毒試驗以枝條類型、HgCl2濃度及其處理時間為試驗因素,采用3因素隨機區組試驗設計,試驗結果表明:采用木質化嫩梢作為外植體的消毒處理污染率都高達100%,而采用未木質化嫩梢作為外植體,0.2% HgCl2處理10 min進行消毒效果最好,污染率為0;外植體腋芽啟動試驗則以NAA,6-BA和活性炭為試驗因素,采用正交試驗設計L9(34),試驗結果表明:NAA,6-BA對中山杉腋芽萌動都有促進作用,其中6-BA起主導作用,而活性炭則對中山杉腋芽萌動有抑制作用,其腋芽啟動效果最佳培養基為MS+6-BA1.0 mg·L-1+NAA0.5 mg·L-1,腋芽啟動率達84.62%。
中山杉;無菌體系;外植體消毒;腋芽啟動
中山杉Zhongshanshan’為杉科Taxodiaceae落羽杉屬半常綠高大喬木,具有耐水淹、耐鹽堿、抗風力強、病蟲害少、樹形美觀等特點。目前中山杉作為長江三峽庫區消落帶植被恢復的絕佳樹種[1-2],用苗量激增,采用傳統的扦插繁殖,其繁殖系數較低且受季節影響較大[3],苗木市場上出現一苗難求現象,制約了三峽庫區消落帶生態植被恢復的發展,故必須尋求更好地中山杉種苗繁育途徑。
目前,中山杉組織培養育苗的報道極少,僅唐興國、朱躍珍、郝樹芹等做了中山杉組培快繁技術的初步研究[4-6],存在污染率偏高,存活率較低及芽誘導率不高等諸多問題,其組培育苗技術在生產上難以應用。本試驗采用中山杉當年生健壯嫩枝作為外植體,就中山杉組織培養中無菌體系建立,包括外植體消毒及腋芽啟動培養開展研究,以期建立起較穩定的中山杉組織培養體系,為探索適合中山杉工廠化育苗的組織培養快繁技術提供實驗材料及技術支撐,同時為該樹種的推廣種植提供技術支持。
1 材料與方法
1.1 材料
試驗材料采自重慶市禾佳香料植物開發有限公司中山杉118品種采穗圃,以8年生優良單株當年生健壯枝條作為試驗材料。
試劑HgCl2(廣州化學試劑廠),α-萘乙酸(NAA)、6-芐氨基嘌呤(6-BA)、瓊脂粉、活性炭試劑來自上海伊卡生物公司,酒精(無錫市亞泰聯合化工有限公司),蔗糖(天津市福晨化學試劑廠),洗衣粉采用的是雕牌速溶快潔無磷洗衣粉,超凈工作臺(上海貝塔,型號CA-S-11)。
1.2 外植體采集及預處理
1.2.1 中山杉外植體消毒 于2017年11月16日,采集健壯、莖粗約0.5 cm、無病蟲害的當年生春梢(木質化)及秋梢(未木質化),帶回實驗室仔細剪掉其針葉及萌生的小側枝,并剪成長約2 cm的莖段,用0.5%洗衣粉溶液浸泡5 min,并輕柔搓洗15 min,再用自來水沖洗30 min,置于超凈工作臺備用。
1.2.2 中山杉腋芽啟動試驗 2017年6月7日采集當年生半木質化嫩梢為試驗對象,預處理方法同上。
1.3 試驗設計
1.3.1 外植體消毒試驗設計 采用3因素隨機區組試驗設計,以枝條類型、HgCl2濃度及其處理時間為試驗因素,其中枝條類型和HgCl2濃度設2水平,HgCl2處理時間設3水平(表1)。
表1 外植體消毒試驗處理設計
Table 1 Different treatments of disinfection of explants

1.3.2 腋芽啟動試驗設計 采用正交試驗設計,以NAA(A),6-BA(B),活性炭(C)為因素,每因素設3個水平,得到L9(34)正交試驗設計表(表2)。
表2 腋芽啟動正交試驗設計L9(34)
Table 2 Experiment on germination of axillary bud by orthogonal design L9(34)

1.4 試驗步驟及培養條件
1.4.1 外植體消毒試驗 將已經預處理好的枝條用75%酒精處理30 s后用無菌水漂洗3次,再按表1試驗設計進行消毒,最后用無菌水沖洗4次,濾干后進行接種。每處理接種10瓶,每瓶接1個外植體,3次重復。培養基為MS,6.5 g·L-1瓊脂粉,30.0 g·L-1蔗糖,pH值調節至5.8 ~ 6.2,不添加植物生長劑;培養溫度25±1℃、光照強度2 000 ~ 2 500 lx、光照時間12 h·d-1。
1.4.2 腋芽啟動試驗 外植體消毒方法及步驟同上,僅0.2% HgCl2處理時間固定為10 min。每處理接種30瓶,每瓶接1個外植體。培養條件同上。
1.5 數據記錄及處理
外植體消毒試驗每隔5 d采集1次數據,連續記錄4次。記錄外植體污染發生類型、部位及數量,腋芽初始萌動時間、萌動程度、材料的生理狀態(是否褐化、玻璃化)等情況。腋芽啟動試驗記錄每隔10 d采集1次數據,連續記錄4次,記錄腋芽萌動情況,腋芽啟動標準為腋芽打破休眠,出現芽體積變大及逐漸變綠現象。根據統計結果計算污染率、啟動率等,公式如下:

試驗數據用Excel和DPS軟件進行統計分析。
2 結果與分析
2.1 不同消毒處理對中山杉外植體污染率的影響
由表3可以看出,以春梢(木質化)作為外植體的6個處理在接種后5 d時就出現大量外植體霉菌污染,在接種后10 d就全部污染;而以秋梢(未木質化)作外植體的6個處理在接種后5 d時,僅有零星污染,在隨后的10 d,15 d,20 d觀察中新增污染數也極少,20 d時,7-12號處理平均污染率僅為12.2%,污染率最高的7號處理也僅為26.7%,而11號處理污染率為0。20 d時7-12號處理的外植體平均啟動率達90%以上,9,10號處理啟動率為100%,最低的12號處理為75.9%。
表3 外植體消毒試驗結果
Table 3 Effect of different disinfection on contamination rate of explants

注:*表示的數值特指腋芽已萌動的外植體數,不是已萌動腋芽的數量。
通過方差分析得出枝條類型、HgCl2濃度、HgCl2處理時間以及枝條類型與HgCl2濃度、枝條類型與HgCl2處理時間對外植體消毒效果差異極顯著(<0.01,表4)。進一步進行各因素的差異顯著性檢驗,結果表明,春梢與秋梢2水平間差異極顯著(<0.01),0.1% HgCl2與0.2% HgCl22水平之間差異顯著(<0.05),HgCl2處理8 min與10 min及12 min之間顯著(<0.05),而HgCl2處理10 min與12 min之間不顯著。由此得出選用未木質化嫩梢作為外植體,用0.2% HgCl2處理10 min為佳。
表4 消毒試驗方差分析
Table 4 ANOVA on disinfection effect
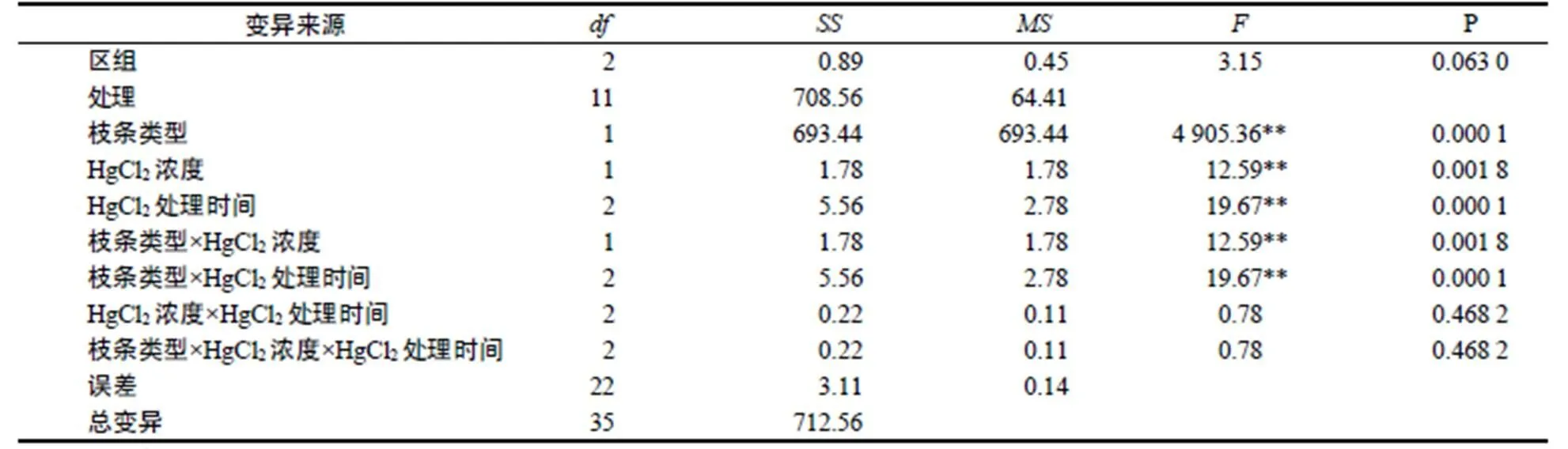
注:**表示差異極顯著。
2.2 不同培養基對外植體腋芽啟動培養的影響
接種后10 d觀察時就有部分外植體的腋芽開始萌動,出現芽體變大變綠現象,到20 d時尤為突出,但到30 d時腋芽萌動的外植體新增現象減緩,此時大量腋芽開始展葉并生長,到40 d時腋芽進入伸長生長階段,部分嫩梢長度達1.0 ~ 1.5 cm。
通過極差分析(表5)可知,各因素作用的主次順序為B>A>C,即6-BA對中山杉腋芽萌動起主導作用,其次是NAA,而活性炭對腋芽萌動有抑制作用,隨著活性炭濃度增加,腋芽萌動越困難。理論上得出適合中山杉腋芽啟動培養的最優組合為B3A3C1,即MS+6-BA 1.0 mg·L-1+NAA 1.0 mg·L-1。值得注意的是40 d時觀察發現8,9號處理雖然啟動率很高,但芽體過于膨大且萌發時間較晚,最早的都需要30 d,存在新芽長度短,新芽展葉慢等特點。
表5 腋芽啟動正交試驗分析
Table 5 Orthogonal test for germination of axillary bud


6號處理表現則較好,首先腋芽萌動早且芽體也較飽滿,到40 d時最長的嫩梢達到1.5 cm(見圖1)。從成本、育苗時間考慮,以枝條為外植體的最佳組合可調整為B3A2C1,即MS+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1。

圖1 40 d時中山杉腋芽啟動情況(左:6號處理,右:1號處理)曹劍攝
Figure 1 Growth of axillary bud 40 days later of treatment
3 結論與討論
在中山杉外植體消毒的一系列前期試驗中,外植體的污染率都一直居高不下,特別是在2017年9-10月先后進行的外植體消毒試驗,最終在接種后10 d時都全部污染。通過試驗觀察及查閱文獻資料[7-10]后推測,已經木質化的健壯枝條為外植體其自身帶菌量太多導致消毒不徹底,此次試驗充分證實了上述推測。可以看到木質化枝條由于生長時間長,長期暴露在外,加之隨著時間的推移枝條的皮層縱裂明顯,容易滋生大量雜菌且不易去除;而未木質化的枝條,由于暴露在外的時間較短,加之枝條皮層光滑未曾開裂,雜菌不易滋生及附著,因此在消毒過程中能徹底清除雜菌。觀察中也發現用0.2% HgCl2處理12 min后,外植體啟動率最低,且未啟動的外植體都出現不同程度的褐化現象,這與HgCl2處理時間較長導致腋芽受損重有關系[8,11-12]。
眾所周知,木本植物無菌體系建立時外植體消毒技術很難把控,而目前的資料表明僅唐興國等[6]開展了中山杉外植體消毒試驗,但該試驗方法其外植體預培養時間相對較長,試驗效果方面雖然污染率可低至6.7%,但外植體的存活率也降至20%,這在實際生產上的指導意義不大。本試驗外植體消毒試驗中,外植體不進行預培養,通過對外植體類型、HgCl2濃度及處理時間進行對比試驗,其消毒試驗結果甚為理想,在實際生產上有節省時間、可操作性強等實用價值。然而采用未木質化嫩梢作為外植體,其萌動抽生的腋芽質量不佳,芽體也較瘦弱,而采用木質化的粗壯枝條作為外植體,其抽生的腋芽飽滿壯實。因此,針對木質化中山杉枝條為外植體探索出一套行之有效的消毒方案,將會更有實際應用價值。
腋芽啟動培養過程中,6-BA作為細胞分裂素類物質,表現出極為明顯的促進作用,在一定濃度范圍內能促進細胞分裂,促進芽的形成與生長;而NAA作為生長素類物質,也能明顯促進體內細胞的生長,但當濃度過高時則會抑制芽的產生,當6-BA/NAA比值大時更有利于腋芽啟動,李慶偉等[7,13-14]也得出過相似的結論。但此次研究也發現在消毒試驗中未添加任何植物生長調節劑的情況下,未木質化嫩枝的腋芽啟動率為90%,但在后續觀察中發現幼芽黃綠且瘦弱,實際應用價值不高;而腋芽啟動試驗外植體采用的是春季萌生的半木質化嫩枝,消毒難度較秋季萌生嫩枝更難,扣除外植體污染樣本數量后,一定程度上影響了腋芽啟動數據的統計,但腋芽啟動率仍達到了87.5%,僅稍低于秋季嫩枝,同時,腋芽啟動試驗所獲得的幼芽質量極高。因此在后續的研究工作中,將進一步對中山杉枝條木質化程度、枝條萌發季節等納入因素進一步深入研究。
中山杉無菌體系的建立尤為重要,特別是外植體的消毒是最為關鍵的環節。試驗表明外植體以未木質化、表皮無裂紋的新梢為佳,以0.2% HgCl2處理時間10 min為好,接種20 d時外植體污染率為0,且啟動率也達90%。在中山杉啟動培養中,腋芽萌動集中出現在接種后10 ~ 20 d,30 d時腋芽便開始展葉及伸長生長。通過正交試驗得出NAA,6-BA對其腋芽萌動都有促進作用,其中6-BA起主導作用,而活性炭則相反,對中山杉腋芽萌動有抑制作用。中山杉外植體腋芽啟動培養的最佳組合是MS+6-BA1.0 mg·L-1+NAA0.5 mg·L-1。
[1] 張虹. 三峽庫區消落帶土地資源特征分析[J]. 水土保持通報,2008,28(01):46-49.
[2] 殷云龍,於朝廣,華建峰,等. 重慶萬州三峽庫區消落帶中山杉造林試驗[J]. 林業科技開發,2014,28(02):110-114.
[3] 陸小清,陳永輝,李乃偉,等. 中山杉優良品種的扦插繁殖技術研究[J]. 安徽農業科學,2011,39(31):19209-19210.
[4] 唐興國,張美璐. 中山杉離體快繁技術初探[J]. 安徽農業科學,2012,40(16):8836-8838.
[5] 朱躍珍,楊寶明,劉芳,等. 中山杉組培快繁技術研究[J]. 西部林業科學,2013,42(02):107-109.
[6] 郝樹芹,朱坤,陳昆. 中山杉微體快繁技術研究[J]. 西部林業科學,2017,46(05):135-138.
[7] 李慶偉,梁明勤,樊亞敏,等. 不同取材時期和處理方法對瓦松無菌體系建立的影響[J]. 江蘇農業科學,2014,42(01):55-58.
[8] 金為民. 梅花‘美人梅’組織培養中無菌體系建立的初步研究[J]. 江蘇林業科技,2007,34(04):9-11,56.
[9] 張玲玲,郭軍站,張敏,等. 垂絲海棠無菌體系建立研究[J]. 北方園藝,2012,265(10):126-129.
[10] 本瑪麗,王曉明,李永欣,等. 光皮樹優良無性系組織培養的無菌體系建立[J]. 湖南林業科技,2010,37(02):5-7,11.
[11] 于婷喬,秦棟,霍俊偉,等. 不同滅菌條件對藍果忍冬組培苗成活率的影響[J]. 南方農業學報,2014,45(2):259-265.
[12] 王曉明,易靄琴,宋慶安,等. 灰氈毛忍冬新品種組織培養的無菌體系建立[J]. 經濟林研究,2005,23(04):14-16,31.
[13] 劉柏玲,李守潔,張凱,等. 彩葉植物紅葉石楠離體再生體系的研究[J]. 林業科技,2016,41(5):1-4.
[14] 施瓊,胡峰,黃烈健,等. 馬大雜種相思腋芽高效組培增殖體系[J]. 林業科學, 2014,50(6):55-60.
Preliminary Test on Establishment of Sterile Culture of‘Zhongshanshan’
Huang Zhi-wei,Cao Jian
(Chongqing Three Gorges Polytechnic College, Chongqing 404155, China)
Current spring and autumn shoots of 8-year‘Zhongshanshan’ were collect on 16 November of 2017 at cutting orchard in Chongqing for test of sterile culture of explant and axillary bud germination. Sterile culture test was designed by randomized block of three factors, namely type of shoot, concentration and treatment time of HgCl2. The results showed that the best sterile culture of explant was autumn shoot treated by 0.2% HgCl2for 10 minutes, with contamination rate of 0. Axillary bud germination test was designed by orthogonal of L9(34), with NAA, 6-BA and activated carbon as factors. The results indicated that NAA and 6-BA had the positive effect on germination of axillary bud, especially 6-BA, while activated carbon had inhibitory effect. The optimal medium of bud germination was MS + 1.0 mg?L-1of 6-BA + 0.5 mg?L-1NAA.
‘Zhongshanshan’; sterile culture; explant disinfection; axillary bud germination
S791
A
1001-3776(2018)05-0061-06
2018-03-29;
2018-07-15
重慶市高職院校新技術推廣項目-三峽庫區消落帶植被恢復中山杉118良種中試與示范(GZTG201611)
黃志偉,工程師,從事林業生態工程研究;E-mail:475221232@qq.com。
曹劍,副教授,從事森林病蟲害及林業生態相關研究;E-mail:407586199@qq.com。
10.3969/j.issn.1001-3776.2018.05.010

