阿膠、黃明膠對被動吸煙小鼠肺臟Th17/Treg細胞亞群分化及相關細胞因子表達的影響差異①
張 喆 胡晶紅 姚成芳 蘭紅云 張永清
(山東中醫藥大學,濟南250355)
阿膠(Colla Corii Asini)是我國傳統的名貴中藥,自《神農本草經》首載至今已有兩千多年的藥用歷史[1]。根據文獻記載:阿膠產生之初原料為牛皮,后因歷史原因被驢皮取代并沿用至今,而牛皮膠改稱黃明膠(Colla Corii Bovis)[2]。阿膠和黃明膠制作工藝相似,但藥理功效和臨床適應癥卻各有側重[2,3]:除同時具有止血功效外,阿膠在臨床上用于治療肺燥咳嗽,眩暈心悸,心煩不眠等癥,黃明膠口服治療體虛便秘、腎虛遺精,外用對跌打損傷、瘡癰腫毒有很好的治療效果。中醫本草類古籍中有諸多關于阿膠和黃明膠治療氣道炎癥的記載,如《本草匯》中阿膠項下有“治喘嗽者,不論肺虛肺實,可下可溫,須用以安肺潤肺”的記載;《證類本草》中黃明膠項下有“治咳嗽不瘥者,黃明膠炙令半焦為末,每服一錢匕”的記載[2,3],但中醫理論以“驢皮色黑屬陰,阿井之水千里所注,清而且重,其性下趨,故止虛勞咳嗽”、“黃明膠氣味與阿膠同,但非阿井水及驢皮同造,故不能疏利下行耳”為依據,認為黃明膠治療氣道炎癥效果不及阿膠,二者對氣道炎癥的治療效果及作用機制比較卻均未見現代研究報道。隨著對黏膜免疫研究的不斷深入,發現吸煙作為許多呼吸道疾病如慢性阻塞性肺炎(COPD)、哮喘及呼吸道感染的主要危險因素可能與香煙煙霧改變宿主的免疫反應有關[4,5],輔助型T細胞(T hell cell)亞群參與機體適應性免疫,在氣道炎癥性疾病中扮演著重要角色[6],除早期發現的Th1/Th2細胞亞群外,Th17/Treg細胞亞群功能平衡被認為是影響呼吸道炎性因子分泌及促炎癥反應的關鍵因素[7,8]。因此,本研究建立被動吸煙小鼠模型,從Th17/Treg細胞亞群比例及相關細胞因子表達角度研究阿膠和黃明膠治療氣道炎癥作用機制的異同。
1 材料與方法
1.1實驗材料、試劑
1.1.1實驗動物 SPF級雄性C57BL/6小鼠32只,體質量18~22 g,6~8周齡,購自濟南朋悅實驗動物繁育有限公司[SYXK(魯)20140007],26℃、12 h 光照,12 h暗室飼養,自由進水、進食,Co60輻照滅菌全營養大小鼠飼料。
1.1.2主要試劑及儀器 抗小鼠熒光抗體:PE-CD3、percp-CD4、APC-cy7-IL-17A、PE-cy5.5-CD25、PE-Foxp-3均購自eBioscience公司;TRIzol Reagent、2×Es Taq Master-Mix、dNTP、RNase、5×Buffer購自北京康為世紀生物科技有限公司;M-MLV購自Invitrogen公司;RNA酶抑制劑購于BioBasic公司;二乙基焦碳酸酯(DEPC)、瓊脂糖購于AMRESCO公司;丙酮、氯仿、異丙醇、無水乙醇購于天津廣成化學試劑有限公司;內參照GAPDH、Foxp-3、ROR-γ引物由上海博尚生物技術有限公司合成,引物序列見表1;RIPA裂解液購自Beyotime公司;ELISA IL-17A、ELISA IL-6、ELISA TGF-β1試劑盒均購于聯科生物技術有限公司。梯度PCR擴增儀(Tgradient,Biometra,德國);凝膠成像系統(Alplha ImagerTM 2200,美國);電泳儀、酶標儀(Thermo,美國);FACSCalibur流式細胞儀(Becton Dickinson公司)。
1.2實驗方法
1.2.1氣道炎癥動物模型建立方法 32只小鼠按隨機數字法平均分成對照組、模型組、阿膠組和黃明膠組。除對照組外,其余各組每日兩次香煙煙熏,煙熏量10支/次(將軍煙:焦油量11 mg,煙堿含量:1.1 mg,一氧化碳量:11 mg,山東中煙工業有限責任公司),具體方法為:每次點然5支香煙插入40×30×20 cm3自制煙熏箱自然燃盡,每次2組,共10支香煙,煙熏時間共30 min,兩次煙熏間隔 4 h以上,阿膠組小鼠每日給予0.2 ml濃度為0.2 g/ml 阿膠溶液灌胃,黃明膠組小鼠每日給予0.2 ml濃度為0.2 g/ml 黃明膠溶液灌胃,模型組小鼠每日0.2 ml 生理鹽水灌胃,按上述方法造模24周后進行實驗。
表1RT-PCR引物序列
Tab.1RT-PCRprimersequence
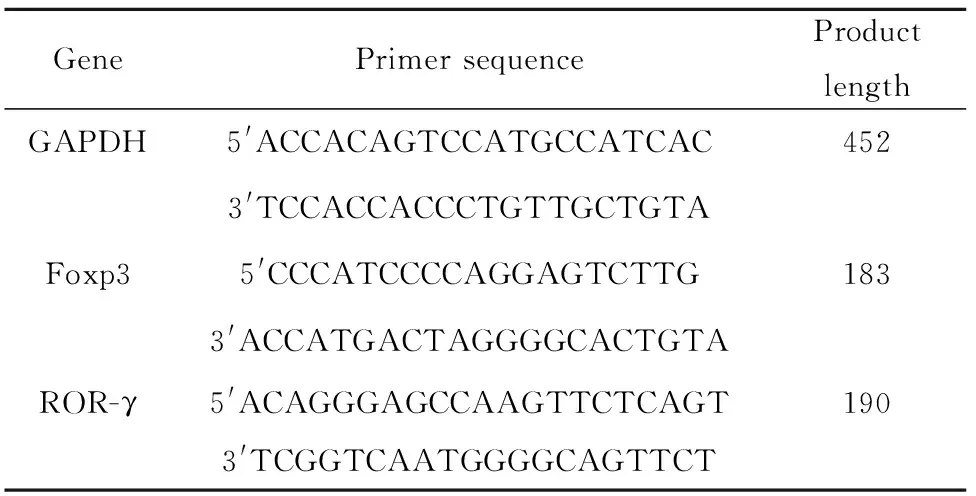
GenePrimer sequenceProductlengthGAPDH5'ACCACAGTCCATGCCATCAC4523'TCCACCACCCTGTTGCTGTAFoxp35'CCCATCCCCAGGAGTCTTG1833'ACCATGACTAGGGGCACTGTAROR-γ5'ACAGGGAGCCAAGTTCTCAGT1903'TCGGTCAATGGGGCAGTTCT
1.2.2檢測指標及實驗方法
1.2.2.1外周血細胞分類計數 眼球取血約1.0 ml 收集于加入EDTA-2Na的抗凝管中,緩緩搖晃使血液充分與抗凝劑接觸,取100 μl加到EP管中,使用pocH-100iv血細胞分析儀檢測血細胞成分。
1.2.2.2酶聯免疫吸附法(ELISA)測定ELISA血清IL-17A、IL-6、TGF-β1因子蛋白表達 眼球取血約1.0 ml收集于EP管中,離心(4 000 r/min,15 min,4℃)取上清,按照ELISA試劑盒的操作說明檢測IL-17A、IL-6、TGF-β1因子蛋白水平。
1.2.2.3肺臟HE染色切片觀察病理改變 小鼠取血后脫頸椎處死,無菌分離肺臟組織。左肺上葉置于4%甲醛溶液中固定72 h,按照常規方法制作石蠟切片,HE染色評價其病理改變。
1.2.2.4逆轉錄-PCR檢測肺臟Foxp-3、ROR-γ 因子轉錄水平 小鼠左肺下葉置于經DEPC處理的EP管中,采用TRIzol Reagent提取樣本總mRNA,采用oligo dT為RT反應引物,PCR反應條件:RNase free water 6.5 μl,Taq酶12.5 μl,RT反應產物4 μl,上、下游特異性引物各1 μl,總體積20 μl。PCR循環參數:預變性95℃,5 min;94℃,1 min;58℃,1 min;72℃,1 min,30個循環,末次循環后72℃延長10 min。PCR產物經1.2%凝膠電泳,結果采用 Alpha凝膠成像系統分析圖像,以GAPDH為內參照,計算目的基因與同步GAPDH灰度值比值作為相對表達量。
1.2.2.5流式細胞術檢測肺臟Th17及Treg細胞 小鼠右肺經過消化、研磨、破紅、過濾等操作制備單核細胞懸液,調整單個核細胞濃度(1×106/管)后離心,沉淀用1.5 ml刺激液重懸,置于細胞培養箱中37℃,5%CO2,刺激培養6 h后收集細胞,經濾網過濾后轉移至EP管中,1×PBS洗2次,離心后棄上清,沉淀加入小鼠血清重懸后室溫避光封閉15 min,按說明書參考抗體濃度加入外標抗體(PE-CD3、percp-CD4、percp-cy5.5-CD8、PE-cy5.5-CD25),4℃避光孵育30 min;1×PBS洗2次,加入穿膜固定液500 μl, 4℃固定30 min,固定后細胞用穿膜液洗2次后加入500 μl穿膜液4℃避光孵育30 min,按說明書加入內標抗體(APC-cy7-IL-17A、PE-Foxp-3),4℃避光孵育30 min后分別用1×Perm Wash和1×PBS各洗1遍,隨后上機檢測,采用Flowjo7.6分析Th17 亞群(CD3+CD4+IL-17A+)及Treg亞群(CD3+CD4+CD25+Foxp3+)比例。

2 結果
2.1小鼠外周血血細胞分析 與對照組相比,模型組小鼠外周血白細胞、中性粒細胞、嗜酸性粒細胞、血小板及血紅蛋白含量均升高(P均<0.05),淋巴細胞數量降低(P<0.05);阿膠能夠顯著降低中性粒細胞數(P<0.05),黃明膠能夠顯著降低嗜酸性粒細胞數(P<0.05),兩組紅細胞、血小板及血紅蛋白含量均顯著回落,顯示阿膠和黃明膠能夠使肺臟組織缺氧狀態得到有效緩解。見表2。
2.2阿膠、黃明膠對被動吸煙小鼠血清 IL-17A、IL-6 、TGF-β1 因子表達的影響 血清ELISA檢測結果顯示:被動吸煙小鼠肺臟IL-17A、IL-6、TGF-β1因子表達均顯著升高(P均<0.05);阿膠能夠降低IL-17A、IL-6、TGF-β1蛋白表達(P<0.05);黃明膠對IL-17A、IL-6因子影響均不顯著,但可顯著降低TGF-β1蛋白水平(P<0.05),結果見表3。
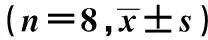
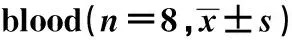

GroupWBC(103/μl)LYM(103/μl)Neutrophil(103/μl)Eosinophils(103/μl)PLT(g/dl)HGB(g/L)RBC(106/μl)C4.07±0.451.84±0.201.74±0.090.61±0.1114.46±0.5616.6±1.810.5±1.4M4.95±0.631)1.51±0.391)2.57±0.111)0.69±0.1216.90±0.661)18.8±2.31)12.6±1.91)E4.36±0.402)1.87±0.241.99±0.122)0.60±0.0214.61±0.722)17.3±1.92)11.2±1.82)H4.71±0.511.94±0.292.42±0.210.51±0.022)16.37±0.6917.0±2.02)11.7±2.02)
Note:C.Control group;M.Model group;E.Colla Corii Asini group;H.Colla Corii Bovis group.Compared with control group,1)P<0.01;compared with model group,2)P<0.05.
2.3小鼠肺組織病理切片分析 肺臟切片HE染色顯示:對照組為正常肺組織結構,模型組肺間質有大量炎性細胞浸潤,有紅細胞滲出,肺間質明顯增厚,氣道管壁增厚、管腔變窄;阿膠組和黃明膠組炎性細胞浸潤程度明顯降低,無紅細胞滲出,肺間質增厚不明顯,氣道管壁增厚、管腔變窄情況明顯改善,其中阿膠對肺臟炎癥的治療效果較黃明膠更為顯著,結果見圖1。
2.4阿膠、黃明膠對被動吸煙小鼠肺臟RORγt、Foxp3因子轉錄水平的影響 RT-PCR檢測結果顯示:模型組小鼠肺臟RORγt 及Foxp3 mRNA表達均顯著升高(P均<0.05);阿膠可顯著降低RORγt mRNA表達,同時Foxp3 mRNA表達隨之降低(P<0.05);與模型組相比,黃明膠組RORγt mRNA表達降低,Foxp3 mRNA表達升高,但差異均無顯著(P>0.05),結果見圖2。
2.5阿膠、黃明膠對被動吸煙小鼠肺臟Th17、Treg細胞亞群的影響 與對照組相比,模型組小鼠肺臟Th17 亞群(CD3+CD4+IL-17A+細胞)比例及細胞數目均顯著升高,Treg 亞群(CD3+CD4+CD25+Foxp3+細胞)比例及細胞數目顯著升高;與模型組相比,阿膠組Th17 亞群及Treg 亞群比例和細胞數目均顯著降低(P均<0.05),黃明膠組Th17 亞群及Treg 亞群比例及細胞數目均未發生顯著變化(P>0.05),結果見圖3。
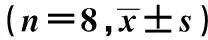

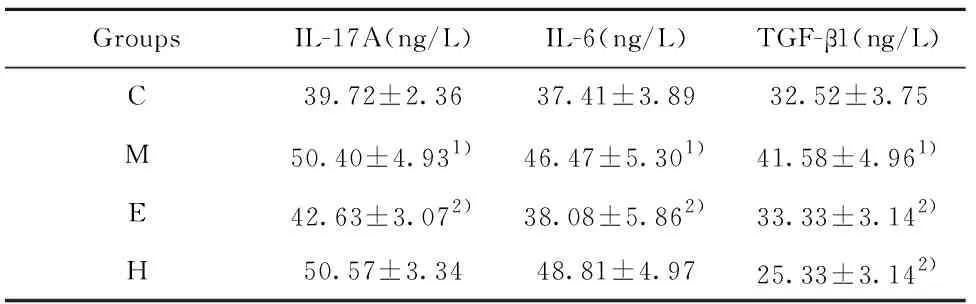
GroupsIL-17A(ng/L)IL-6(ng/L)TGF-β1(ng/L)C39.72±2.3637.41±3.8932.52±3.75M50.40±4.931)46.47±5.301)41.58±4.961)E42.63±3.072)38.08±5.862)33.33±3.142)H50.57±3.3448.81±4.9725.33±3.142)
Note:C.Contol group;M.Model group;E.Colla Corii Asini group;H.Colla Corii Bovis group.Compared with control group,1)P<0.01;compared with model group,2)P<0.05.

圖1 小鼠肺臟組織切片(×200)Fig.1 Paraffin sections with H&E staining of mice lung tissue(×200)Note: C.Contol group,M.Model group;E.Colla Corii Asini group;H.Colla Corii Bovis group.C1,M1,E1,H1.Inflammatory cell infiltration in lung tissue in each group;C2,M2,E2,H2.Airway inflammation in lung tissue in each group.

圖2 阿膠、黃明膠對被動吸煙小鼠肺臟RORγt、Foxp3因子轉錄水平的影響Fig.2 Effect on expression of RORγt,Foxp3 mRNA of Colla Corii Asini and Colla Corii Bovis in mice with chronic cigarette smoke exposureNote: C.Control group;M.Model group;E.Colla Corii Asini group;H.Colla Corii Bovis group.Compared with control group,*.P<0.01;compared with model group,#.P<0.05.
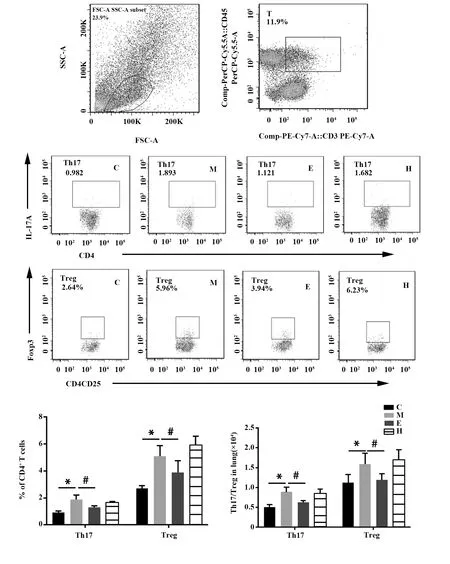
圖3 阿膠、黃明膠對被動吸煙小鼠肺臟Th17、Treg細胞亞群比例及細胞數目的影響Fig.3 Effects of Colla Corii Asini and Colla Corii Bovis on balance of Th17/Treg cell subsets in lungs of mice with chronic cigarette smoke exposureNote: C.Control group;M.Model group;E.Colla Corii Asini group;H.Colla Corii Bovis group.Compared with control group,*.P<0.01;compared with model group,#.P<0.05.
3 討論
眾所周知,吸煙是哮喘、肺氣腫、慢性阻塞性肺炎(COPD)等呼吸道疾病發生的主要危險因素[9]。近年來,隨著人們對吸煙危害的認知程度加深,吸煙率呈現逐年下降趨勢,但大氣細顆粒物(Fine particulate matter,PM2.5)污染問題日益嚴重,已成為人類呼吸系統面臨的新挑戰[10]。香煙煙霧引發呼吸道疾病的作用機制十分復雜,目前仍未完全闡明,局部免疫失調導致的持續炎癥反應在疾病的形成、發展及轉歸中的重要作用被國內外諸多動物及人類研究所證實[11-13],其中,Th17/Treg細胞亞群平衡及相關細胞因子表達在慢性氣道炎癥性疾病發病機制中的作用是當前的研究熱點[14,15]。Th17細胞亞群主要分泌IL-17A等細胞因子促進中性粒細胞聚集和活化,導致機體產生強烈的炎癥反應,參與多種炎癥性疾病和自身免疫性疾病,特異性轉錄因子ROR-γt在誘導Th17亞群分化中發揮主導作用;CD4+CD25+Foxp3+調節性T細胞(Treg)是一類起負調節作用的CD4+CD25+T細胞亞群,能夠抑制T淋巴細胞活化,在維持免疫耐受中起著關鍵性作用,叉頭狀轉錄因子3(Foxp3)作為其特征性標志同時也參與其分化和發育。兩類細胞均來自初始CD4+T細胞,其分化過程受多種細胞因子共同調節,調控機制仍未完全明確。當前被多數研究者接受的觀點為:當TGF-β與IL-6同時存在時,初始T細胞向Th17細胞分化,而只有TGF-β的情況下,初始T細胞向Treg細胞分化。兩類細胞在分化過程中互相遏制,功能上相互拮抗,對于維持體內內環境的穩定至關重要[16-18]。當呼吸道黏膜上皮細胞接觸到有害顆粒物后,被激活的抗原提呈細胞分泌大量IL-6等前炎性細胞因子,在趨化中性粒細胞的同時,上調RORγt表達,Th17亞群特異性趨化轉錄因子RORγt誘導初始T細胞向Th17細胞分化,加重Th17介導的炎癥反應,增加的Th17細胞分泌大量IL-17A等促炎細胞因子,募集中性粒細胞和巨噬細胞浸潤至炎癥組織釋放彈性蛋白酶、基質金屬蛋白酶破壞肺組織,刺激更多炎性介質釋放;而活化的T細胞和損傷細胞修復過程中分泌大量TGF-β促進細胞外基質沉積,誘導氣道重塑和纖維化的發生。Treg細胞亞群通過分泌IL-10等細胞因子抑制T淋巴細胞活化,在炎癥反應中表達上調發揮抗炎保護作用,但體內Treg細胞表達上調會抑制其他免疫細胞對癌細胞的監視作用,說明即使未出現肺功能改變,吸煙也是引發腫瘤產生的重要危險因素[19]。
前人研究顯示Th17/Treg細胞及相關細胞因子在吸煙誘導的氣道炎癥中的作用機制十分復雜,實驗結果的差異可能因個體耐受程度不同而有所差異,同時我們也發現不同的模型構建方法雖然能得到相似的病例改變,但作用機制可能有所差異,如在建立動物模型探索COPD的發病機制時,單獨應用香煙煙霧與煙熏聯合脂多糖(LPS)滴鼻,以及香煙煙霧暴露的方法及煙霧劑量、小鼠品系選擇等對結果均產生很大影響。一直以來,阿膠以“補血圣藥”著稱,對各種出血癥及貧血有顯著療效,現代研究也逐漸揭開了阿膠抑制癌細胞增殖、協助放化療后機體免疫重建、抗休克、抗疲勞、美容等藥理功效的作用機理[3]。但是作為治療肺陰虛咳嗽的常用藥,阿膠治療氣道炎癥的作用機制鮮有研究報道。因此,為探明阿膠和黃明治療呼吸道炎癥的效果及作用機制的異同,同時發掘中藥抗霧霾的藥理功效,本研究采用較低劑量香煙煙霧連續暴露方式建立動物模型,且未使用脂多糖誘導急性炎癥反應,意圖模擬大氣細顆粒物和被動吸煙時低濃度有害氣體的致病環境,在此基礎上從組織、細胞、分子層面上探討阿膠和黃明膠對氣道炎癥小鼠肺臟保護作用。結果顯示:C57BL/6小鼠經過24周低劑量香煙煙霧暴露后肺間質有大量炎性細胞浸潤,肺泡破裂融合,出現紅細胞滲出,氣道上皮細胞在煙霧顆粒刺激下IL-6、TGF-β等前炎性因子表達顯著升高,誘導中性粒細胞、巨噬細胞等炎性細胞浸潤造成基質損傷,同時通過上調轉錄因子RORγt表達促進Th17細胞亞群分化,細胞因子IL-17A表達升高;組織的不斷損傷和修復導致肺間質明顯增厚,氣道管壁增厚、管腔變窄等氣道重塑過程的發生,導致呼吸功能受到影響;同時,在低濃度香煙煙霧引發的慢性氣道炎癥中,Treg細胞亞群及轉錄因子Foxp3表達上調,原因可能是機體免疫系統通過上調Treg細胞抑制機體過強的免疫反應來保護宿主,避免因過強的免疫反應造成嚴重病理損害。本研究顯示:阿膠通過下調細胞因子IL-6、TGF-β及轉錄因子RORγt的表達降低小鼠肺臟Th17細胞亞群比例及數目從而減輕氣道炎癥程度,Foxp3因子表達和Treg細胞比例及數目相應降低,肺臟病理切片顯示炎癥情況得到明顯改善,無紅細胞滲出,肺間質增厚、氣道管壁增厚、管腔變窄情況明顯改善。在本研究中,盡管病理切片顯示黃明膠能有效減輕香煙煙霧導致的肺臟炎癥,但細胞及細胞因子檢測未顯示黃明膠對IL-6、IL-17A因子表達及Th17細胞的抑制作用,肺臟Treg細胞比例及轉錄因子Foxp3表達出現較小幅度的上調,而對于Th17亞群和Treg亞群重要的活化因子,黃明膠組小鼠血清TGF-β水平卻呈現顯著下降,與其余研究結果相矛盾,出現這一結果的原因可能與血清TGF-β與其在肺臟的表達并不是完全統一,亦有可能是由于實驗誤差或取樣方法有關,需要進一步實驗進行驗證;同時,黃明膠治療氣道炎癥的效果不及阿膠,說明古籍中“黃明膠氣味與阿膠同,但非阿井水及驢皮同造,故不能疏利下行耳”雖是從中醫理論角度進行闡釋,但仍具有一定科學性。另外,本研究選擇的實驗動物給藥劑量是按照阿膠和黃明膠藥品說明書中成人用藥劑量的中等水平換算而來,阿膠和黃明膠對Th17/Treg細胞分化的影響是否與給藥劑量有關仍需進一步研究確定。

