高效氟吡甲禾靈在馬鈴薯和土壤中的殘留消解動態及殘留量
毛 佳,梁 林,金 杰,潘金菊,齊曉雪,劉 偉,馮義志*
(1.云南省農業科學院農業環境資源研究所,云南 昆明 650205;2.山東省農藥科學研究院 山東省化學農藥重點實驗室,山東 濟南 250033)
高效氟吡甲禾靈(haloxyfop-P-methyl)又名高效蓋草能,是美國陶氏益農公司開發的一種芳氧苯氧丙酸類除草劑,具有殺草快、內吸作用強及對作物高度安全等特點,對白菜、油菜、大豆、棉花和花生等闊葉作物田的一年生禾本科雜草有很好的防效[1]。其作為一種苗后選擇性除草劑,通過抑制植株體內乙酰輔酶A羧化酶而影響雜草的脂肪酸合成[2-3],進而抑制根、莖分生組織的生長,使受藥雜草逐漸枯萎死亡。高效氟吡甲禾靈結構中丙酸α-碳為不對稱碳原子,故存在R和S兩種光學異構體,其中S體沒有除草活性,高效氟吡甲禾靈是除去了非活性部分(S體)的精制品(R體)[4]。隨著高效氟吡甲禾靈的廣泛使用,其在環境和農作物中的殘留問題也日益受到人們關注。黃雪等[1]建立了高效液相色譜測定土壤中高效氟吡甲禾靈殘留量的分析方法,其中方法定量限為0.05mg/kg。謝勇波等[5]建立了檢測土壤、煙草和油菜中高效氟吡甲禾靈的分析方法。吳祥為和武秀停等[6-7]分別建立了氣相色譜法測定了大豆和穿心蓮中高效氟吡甲禾靈的分析方法。馬恒麟等[8]研究了蓋草能(氟吡甲禾靈)在棉花上的殘留量及消解動態。以上有關高效氟吡甲禾靈的研究主要以殘留分析方法為主,尚未涉及馬鈴薯中消解動態及殘留量的研究,并且只檢測了高效氟吡甲禾靈而未對其代謝物進行檢測。目前,我國和歐盟對高效氟吡甲禾靈的殘留物定義同氟吡甲禾靈一樣都是以氟吡甲禾靈、氟吡禾靈及其共軛物之和,以氟吡甲禾靈表示。本文建立了GC-MS法測定氟吡甲禾靈及氟吡禾靈在馬鈴薯和土壤中殘留的分析方法,研究了高效氟吡甲禾靈在馬鈴薯和土壤中消解規律及其殘留量。研究結果為該藥在馬鈴薯上的科學合理使用及限量研究提供了技術依據。
1 材料與方法
1.1 供試材料 供試農藥:28%高效氟吡甲禾靈微乳劑(某公司產品)。氣質聯用儀(QP2010ultra),Shimadzu公司;多功能食品加工機(XBLL-25A),上海帥佳電子科技有限公司;電子天平(JA21002),上海精密科學儀器有限公司;離心機(TDL-5-A),上海安亭科學儀器廠。無水硫酸鎂(分析純,國藥集團化學試劑有限公司);98%硫酸(分析純,國藥集團化學試劑有限公司);甲醇、正己烷、苯(分析純,國藥集團化學試劑有限公司);弗羅里硅土小柱(1 000mg/6mL,天津博納艾杰爾科技有限公司);氟吡甲禾靈標準品(純度為99%,Sigma-Aldrich公司);氟吡禾靈(純度為98%,Sigma-Aldrich公司)。
1.2 田間試驗設計 試驗于2015~2016年在山東省濟南市、吉林省雙遼市,試驗用地田間管理精細,灌溉方便。山東和吉林馬鈴薯品種分別為荷蘭1號和荷蘭7號,所有試驗小區的栽培條件一致,栽培管理按照試驗田統一生產規范進行,符合當地良好農業規范(GAP),試驗過程參考《農藥殘留試驗準則》[9]和《農藥登記殘留田間試驗標準操作規程》[10]。28%高效氟吡甲禾靈微乳劑在馬鈴薯上防治一年生雜草的推薦使用制劑量:10~15g/667m2(42~63g a.i/hm2)。施藥方法:莖葉噴霧;施藥1次。
1.2.1 消解動態試驗 消解動態按制劑量337.5 g/hm2(94.5 g a.i/hm2),于馬鈴薯苗期施藥。施藥后2h、1、3、5、7、14、21、28、35、42d分別采集馬鈴薯植株樣品。植株樣品采集方法:在試驗小區內隨機采集2.5 kg,切碎、混勻后用四分法留樣500 g。土壤動態試驗在另一空地噴霧施藥,施藥濃度按制劑量337.5 g/hm2(94.5 g a.i/hm2),施藥后2h、1、3、5、7、14、21、28、35、42d采集土壤樣本。土壤樣本的采集方法:用土鉆隨機采集0~10 cm深度土壤6~12點,除去土壤中的碎石、雜草和植物根莖等雜物,混勻后采用四分法留樣500 g。所有樣品貯存于~20℃冰柜中保存。另設清水空白對照。每處理重復3次,處理間設保護間隔區。
1.2.2 最終殘留試驗 設2個施藥劑量:低劑量按制劑量225 g/hm2(63 g a.i/hm2),高劑量按制劑量337.5 g/hm2(94.5 g a.i/hm2),各設1次施藥。收獲期分別采集馬鈴薯和土壤樣品。土壤采集0~15 cm深土層,去除雜草、石塊等,每次隨機取3份,縮分后留樣,于-20℃低溫冷凍保存。
1.3 分析方法
1.3.1 色譜條件 TG-1701MS毛細管柱(30m × 0.25 mm × 0.25 μm);載氣:He(純度>99.999%);柱流量1.6 mL/min;柱頭壓143.6kPa;進樣體積1μL;不分流進樣;進樣口溫度250℃;氣-質接口溫度250 ℃。柱升溫程序:初始溫度150℃保持5min,20℃/min升至250℃,保持5min;檢測器電壓1 kV;離子源溫度200℃;溶劑延遲時間4 min;定性離子m/z 375、288,定量離子m/z 316,目標峰保留時間11.0min左右,(圖1)。

圖1 氟吡甲禾靈定量離子色譜圖(0.01mg/L)
1.3.2 樣品前處理方法 準確稱取搗碎馬鈴薯和植株樣品10.0g于50mL具塞塑料離心管中,加入1mL 20%NaOH水溶液和20mL甲醇,振蕩提取2h,靜置過夜,4 000 r/min離心5min,取全部上清液至另一50mL具塞塑料離心管中,再加入1mL 20%NaOH水溶液和20mL甲醇渦旋提取5min,4 000 r/min離心5min,合并所有上清液,加入8g無水MgSO4,劇烈振蕩1min,靜置1h,4 000 r/min離心5min,取10mL上清液至另一50mL具塞塑料離心管中,依次加入20mL飽和食鹽水,2mL 3mol/L的H2SO4水溶液和10mL苯,振蕩萃取2min,4 000 r/min離心5min。取上清液8mL至50mL雞心瓶中,旋蒸濃縮至近干,吹干,待用。馬鈴薯樣品直接進行甲基化反應,用1mL甲醇溶解并轉移至15mL具塞離心管中,加入50μL 98%濃硫酸,混勻后放入30℃水浴鍋中水浴30min,每10min晃動1次。甲基化完成后向離心管中加入5mL蒸餾水和1mL正己烷,振蕩萃取30s,取正己烷相進行檢測;植株樣品先凈化后甲基化反應,用2mL正己烷溶解殘留物至5mL正己烷活化過的弗羅里硅土小柱,分別用5mL正己烷、5mL乙酸乙酯淋洗雜質,棄去。擠干小柱內乙酸乙酯,用10mL 0.5% NaOH水溶液洗脫并收集到15mL具塞試管中。向具塞試管中加入1g NaCl,50μL 98%濃硫酸,2mL正己烷,振蕩萃取1min,取1mL正己烷至50mL雞心瓶旋蒸近干。甲基化同馬鈴薯。
準確稱土壤樣品10.0g于50mL具塞塑料離心管中,加入1mL 20%NaOH水溶液和20mL甲醇,振蕩提取2h,靜置過夜,加入2g無水MgSO4,劇烈振蕩1min,靜置1h,4 000 r/min離心5min,取10mL上清液至另一50mL具塞塑料離心管中,依次加入20mL飽和食鹽水,1mL 3mol/L的H2SO4水溶液和10mL苯,振蕩萃取2min,4 000 r/min離心5min。取上清液8mL至50mL雞心瓶中,旋蒸濃縮至近干,吹干。甲基化同馬鈴薯。
1.3.3 標準曲線制作 準確稱取0.050 5g氟吡甲禾靈標準品于50 mL容量瓶中,用正己烷溶解并定容,配制成質量濃度為1 000 mg/L的標準品母液,再用正己烷分別稀釋成質量濃度為10、5、1、0.5、0.1、0.01 mg/L系列標準工作溶液,在1.3.1節色譜條件下進行測定。
1.3.4 添加回收率測定 分別在空白土壤、馬鈴薯樣品中按照0.01、0.1、1 mg/kg水平添加氟吡禾靈標準溶液,在空白馬鈴薯植株中按照0.02、0.1、1 mg/kg水平添加氟吡禾靈標準溶液每個濃度5次平行試驗。分別在空白土壤、馬鈴薯樣品中按照0.01、0.1、1 mg/kg水平添加氟吡甲禾靈標準溶液,在空白馬鈴薯植株中按照0.02、0.1、1 mg/kg水平添加氟吡甲禾靈標準溶液每個濃度5次平行試驗。按1.3.2節方法進行提取、凈化,按1.3.1節色譜條件進行檢測,測定回收率及相對標準偏差,添加典型譜圖(圖2、3、4)。
圖2 土壤添加氟吡甲禾靈(0.01mg/kg)和土壤空白譜圖

圖3 馬鈴薯添加氟吡甲禾靈(0.01mg/kg)和馬鈴薯空白譜圖
圖4 植株添加氟吡甲禾靈(0.02mg/kg)和植株空白譜圖
2 結果與分析
2.1 線性范圍及檢出限 以氟吡甲禾靈定量離子峰面積y為縱坐標、進樣質量濃度x為橫坐標繪制標準曲線。結果表明,在0.01~10 mg/L范圍內,氟吡甲禾靈定量離子峰面積與進樣質量濃度間呈良好的線性關系,線性方程為y=37 215x-3 243.6,相關系數r=0.999 8。通過最小添加水平得到氟吡甲禾靈在馬鈴薯和土壤中的定量限(LOQ)為0.01 mg/kg,植株中的定量限(LOQ)為0.02 mg/kg。
2.2 添加回收率和精密度 在馬鈴薯、土壤和植株空白樣品中,分別單獨添加3個不同質量分數的氟吡甲禾靈和氟吡禾靈標準品溶液。結果表明(表1):氟吡甲禾靈在馬鈴薯等3種基質中平均回收率83.9%~101.1%,相對標準偏差1.9%~9.9%;氟吡禾靈在馬鈴薯等3種基質中平均回收率79.5%~100.1%,相對標準偏差1.5%~8.7%,符合農藥殘留分析標準要求。
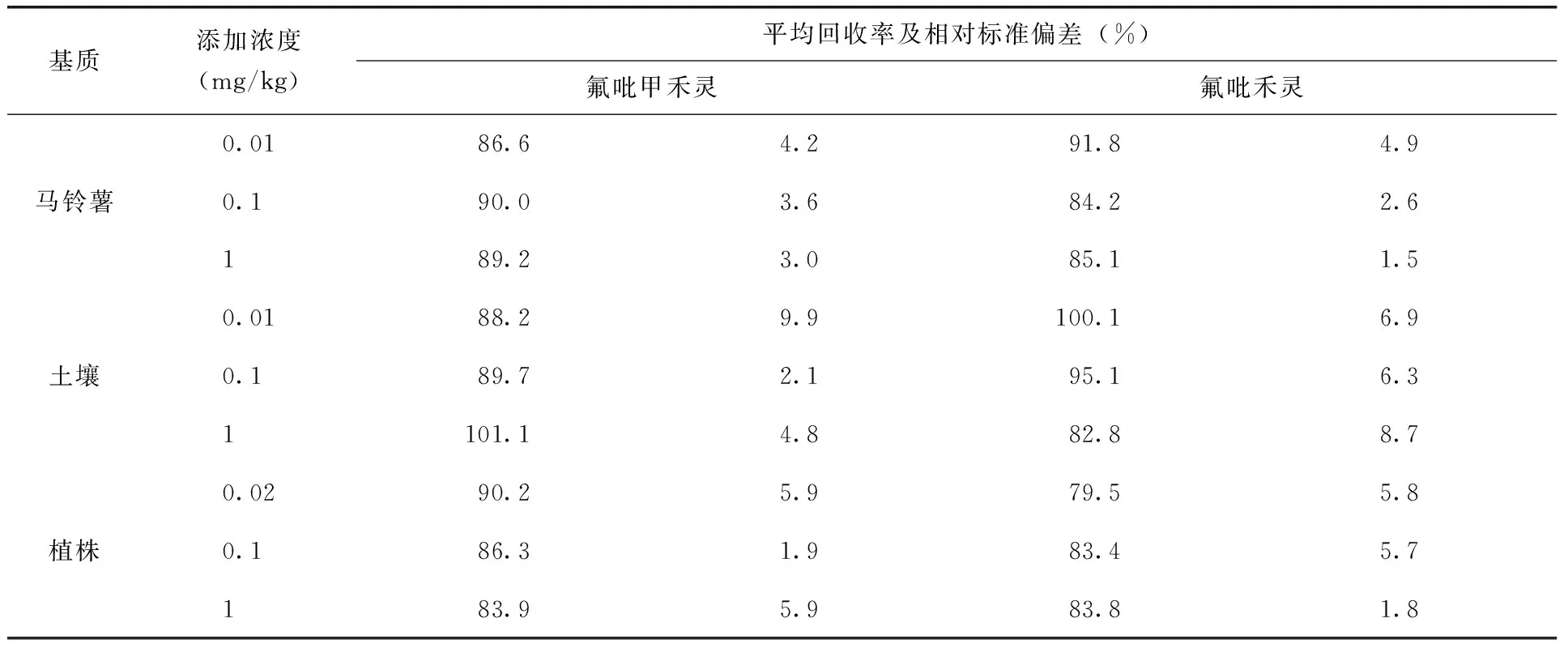
表1 氟吡甲禾靈和氟吡禾靈在馬鈴薯、土壤和植株中添加回收率試驗結果
2.3 高效氟吡甲禾靈在馬鈴薯植株和土壤中的消解動態 消解動態試驗結果表明:高效氟吡甲禾靈在馬鈴薯植株和土壤中降解動態符合一級動力學方程(表2),山東和吉林2年馬鈴薯植株中的半衰期為4.8~8.9 d;土壤中的半衰期為8.3~14.2 d。表明高效氟吡甲禾靈在馬鈴薯植株及其土壤中降解均較快。

表2 高效氟吡甲禾靈在馬鈴薯植株和土壤中的消解動力學方程
2.4 高效氟吡甲禾靈在馬鈴薯和土壤中的最終殘留 高效氟吡甲禾靈最終殘留試驗低劑量按制劑量225 g/hm2(63 g a.i/hm2),高劑量按制劑量337.5 g/hm2(94.5 g a.i/hm2),各施1次藥,收獲期采樣。結果馬鈴薯中高效氟吡甲禾靈殘留量均<最低檢測濃度(0.01mg/kg),土壤中高效氟吡甲禾靈殘留量在<0.01~0.025 9mg/kg之間。
3 結論和討論
本試驗參考JMPR報告用堿性甲醇溶液提取轉化高效氟吡甲禾靈代謝物,凈化后,用甲醇濃硫酸進行甲基化,建立了檢測馬鈴薯和土壤中高效氟吡甲禾靈的殘留分析方法。結果表明:添加質量分數為0.01~1.0 mg/kg時,氟吡甲禾靈和氟吡禾靈在馬鈴薯、馬鈴薯植株和土壤中添加回收率為79.5%~101.1%,相對標準偏差為1.5%~9.9%。本試驗中高效氟吡甲禾靈在馬鈴薯和土壤中的最低檢出質量分數都為0.01 mg/kg,在植株中最低檢出質量分數都為0.02mg/kg。方法的重現性好,準確度、精密度及檢出限均可滿足該農藥的殘留分析要求。
高效氟吡甲禾靈在馬鈴薯植株和土壤中的殘留消解均符合一級動力學方程,其在馬鈴薯植株和土壤中的半衰期分別為4.8~8.9 d和8.3~14.2 d,表明高效氟吡甲禾靈在馬鈴薯植株和土壤中的降解速率均較快。目前,我國食品安全農藥最大殘留限量(GB2763—2016)[11]規定馬鈴薯中高效氟吡甲禾靈的最大殘留限量為0.1mg/kg。試驗結果表明:28%高效氟吡甲禾靈微乳劑在馬鈴薯上防治一年生雜草按照63~94.5 g a.i/hm2劑量施藥1次,收獲期馬鈴薯中高效氟吡甲禾靈殘留量均低于最低檢測濃度(0.01mg/kg)低于我國規定的農藥最高殘留限量值(0.1mg/kg)。所以按推薦劑量使用28%高效氟吡甲禾靈微乳劑防治馬鈴薯田一年生雜草,是安全的。

