中醫病證相符的大鼠瘡瘍模型的建立及其血漿、尿液代謝組學研究
陳德軒,蔡紅蝶,宿樹蘭,朱永康*
(1.南京中醫藥大學附屬醫院,江蘇 南京 210029;2.南京中醫藥大學藥學院,江蘇 南京 210023)
中醫外科學古代稱為“瘍科”,體表感染性疾病在其中占有重要位置,中醫外科的內外治法都是圍繞體表感染類疾病(瘡瘍)展開論述的;中醫現代化進程中,針對很多經典方藥及瘡瘍類疾病的實驗研究必然用到體表感染模型,體表感染模型的建立是相關研究的基礎。
代謝組學是系統生物學研究不可缺少的重要組成,代謝組學被視為生物體整體功能狀態的“生化表型”,能夠即時、靈敏、客觀表征生物在各種外界因素的刺激下體整體功能狀態的應答與調節[1]。目前多成分與多作用靶點藥物顯示出明顯的作用優勢,傳統中醫藥的整體觀也越來越受到更多重視。因而,建立符合傳統中醫藥自身特點、能夠科學表征其整體療效的藥效學評價體系,揭示中醫藥多組分、多靶點協同整合機制,是研究中醫藥的重中之重。近年來,代謝組學越來越多地應用于中醫“證候”本質的揭示[2]、方劑整體療效的作用機制[3]以及中藥安全性評價等等方面,能夠客觀地闡明中醫藥的臨床治療原理。
本文在前人研究基礎上[4],根據病證相符的原則,采用膠帶表皮剝脫加金葡菌菌液注射方法制備大鼠體表感染模型,該模型具有“陽證瘡瘍”成膿期的典型表現,可以用于相關實驗研究。并進一步運用血漿、尿液代謝組學方法揭示體表感染模型大鼠的內源性小分子代謝產物的變化,從體內代謝角度闡明該模型的科學性和合理性。以期為同類研究提供技術方法支撐和參考。
1 材料與方法
1.1 材料
1.1.1 實驗動物
SPF級SD大鼠20只,6~7周齡,體質量200~220 g,雌雄各半,由南京中醫藥大學實驗動物中心提供,許可證號碼SCXK(蘇)2012-0004。飼養及無菌手術在該中心進行,溫度、濕度正常。
1.1.2 試劑與儀器
感染細菌菌種:金黃色葡萄球菌ACTT 25923,濃度1×108個/mL,由江蘇省中醫院細菌室提供。實驗藥物麻醉劑:水合氯醛,江蘇省中醫院制劑中心,批號:2014080。光學顯微鏡( Olympus,日本)江蘇省中醫院病理實驗中心提供。超高效液相色譜與飛行時間質譜儀聯用(UHPLC-Q-TOF/MS)分析條件及工作站等:江蘇省方劑研究重點實驗室提供。
1.2 實驗方法
1.2.1 動物分組及模型制備
20只大鼠隨機分為兩組,每組10只。正常組,表皮剝脫,皮下多點注射生理鹽水;模型組,表皮剝脫,滴注菌液,并皮下多點注射菌液。
體表感染模型:采用膠帶剝脫法[4]加皮下多點注射菌液法復制大鼠體表感染模型。實驗大鼠適應性喂養3 d 后,分別在腹腔內注射10%水合氯酸麻醉(劑量為3 mL/kg),選擇背部皮膚作為實驗區域,使用電動剃毛器剃去背部毛發約3.0 cm×3.0 cm,以寬約2 cm膠帶連續粘扯背部軟毛,約30次左右脫去毛發和表皮層,以潮紅光亮見滲出輕微血滴為度,去除面積約3 cm2左右。滴注菌液組10只大鼠即刻于表皮剝脫處以取樣器滴注5 μL含108金黃色葡萄球菌菌液。放置入飼養籠等待自然蘇醒。以后3 d,每天于剝脫表皮正中注射金黃色葡萄球菌108個/mL×0.5 mL,并在感染區域2 cm2周圍選取多點行皮下注射菌液。約至第4天背部注射部位出現明顯紅腫、皮薄光亮、點壓有軟化,有膿液為造模成功。正常組行相應剝脫、注射,僅注射等量的注射用生理鹽水。
1.2.2 樣本收集與處理
(1)隨機10只大鼠造模前1 d通過眼眶靜脈取血,并通過代謝籠收集10只大鼠的24 h尿液樣本。造模后的第4天,2組再分別取血和收集大鼠的尿液。取樣經離心取血漿后,分組標記后儲存于-70℃的環境中,留待后續分析處理。所有血漿樣品均用3倍量乙腈沉蛋白。將100 μL的血漿,加入到300 μL的乙腈溶液當中,通過渦漩混勻1 min,13 000 r/min高速離心處理10 min后,取上清液過0.22 μm濾膜,各取2 μL濾液進樣UHPLC-Q-TOF/MS。尿液樣品在3 000 rpm離心10 min以除去固體雜質,取上清液按體積比1∶2加入磷酸鹽緩沖液(0.2 mol·L-1Na2HPO4/0.2 mol·L-1NaH2PO4),靜置10 min,再于同樣條件下13 000 rpm,離心10 min,所有尿液樣品過0.22 μm濾膜,各取上層清夜2 μL進樣UPLC-Q-TOF-MS分析。
(2)造模完成后,5只大鼠腹腔內注射麻醉,取背部瘡瘍形成部位靠近中心部的包括皮膚至肌層各層組織約0.5~1 cm2,4%多聚甲醛分組固定,分別行HE染色和革蘭氏染色,制作病理標本。
1.2.3 觀察指標
(1)觀察一般情況: 每日觀察各組大鼠行為活動、糞便性狀、瘡面形態、顏色等。
(2)病理切片檢測:觀察病理切片的急性炎癥反應、中性粒細胞浸潤、單核細胞浸潤、細菌殘留情況等。
(3)造模前后的血漿和尿液代謝輪廓變化。
1.2.4 UHPLC-Q-TOF/MS分析條件
色譜條件:ACQUITF UHPLC BEH-C18色譜柱(2.1 mm×50 mm,1.7 μm,美國Water公司);流動相:A(0.1%甲酸水溶液),B(乙腈);血漿樣品梯度洗脫:0~3 min,B:5%~45%;3~13 min,B:45%~95%;13~14 min,B:95%;14~14.1 min,B:95%~5%。尿液樣品梯度洗脫:0~8 min,B:5%~30%;8~11 min,B:30%~70%;11~13 min,B:70%~95%;13~14 min,B:95%;14~14.1 min,B:95%~5%。
質譜檢測條件:ESI+模式下,源溫度:120℃,脫溶劑氣溫度:400℃,毛細管電壓:4 000 V,錐孔電壓:30 V。錐孔氣流量:50 L/h,脫溶劑流量:900 L/h;掃描時間:0.3 s;質量掃描范圍:100~1 000 m/z。ESI-模式下,源溫度:120℃,脫溶劑氣溫度:350℃,毛細管電壓:3 000 V,錐孔電壓:40 V。錐孔氣流量:50 L/h,脫溶劑流量:600 L/h;掃描時間:0.3 s;質量掃描范圍:100~1 000 m/z。
1.2.5 數據分析
利用Masslynx 4.1工作站進行數據采集,并對所有數據進行主成分分析(PCA)、正交校正的偏最小二乘、判別分析(OPLS-DA)。
2 實驗結果
2.1 大鼠一般情況及創面情況
正常組整體狀態較好,活動靈敏,造模前后均無明顯的蜷縮、少食等現象。模型組隨著菌液注射體質量增長不明顯,逐漸出現蜷縮、少食,尿液深黃、尿少,大便稀溏、腥臭或干結糞便等。正常組的局部創面在連續3 d的注射后見少量的皮膚稍顯潮紅,稍隆起水腫,無明顯的漿液性或膿性分泌物。模型組局部創面在滴、注菌液后的第2天即出現皮膚潮紅、有淺表膿點出現,稍腫脹,至注射后的第4天局部出現隆起,顏色焮紅,表皮剝脫,見漿液性或膿性分泌物,出現膿點,部分按壓后有局部軟化、輕微的波動感覺。根據全身出現的蜷縮、尿黃、糞便干結和局部的焮紅、軟化、膿液形成等現象,此時符合中醫陽證瘡瘍的中期證候表現。直觀上造模成功。
繼續觀察至造模后的1周左右,造模組局部和全身癥狀均明顯減輕或消失,說明大鼠對局部感染的自愈能力較強。兩組均未出現大鼠死亡現象。
2.2 創面肉芽組織病理染色結果
2.2.1 正常組第4天病理切片
由圖1A蘇木素-伊紅染色(100倍)病理切片圖可看出,大鼠表皮局部糜爛,炎性滲出形成,鱗狀上皮灶性脫落,中度急慢性炎細胞浸潤,以中性粒細胞為主。毛囊及脈管周少許炎細胞浸潤。圖1B革蘭氏染色(100倍)顯示,表皮炎性滲出物中見散在革蘭陽性菌。
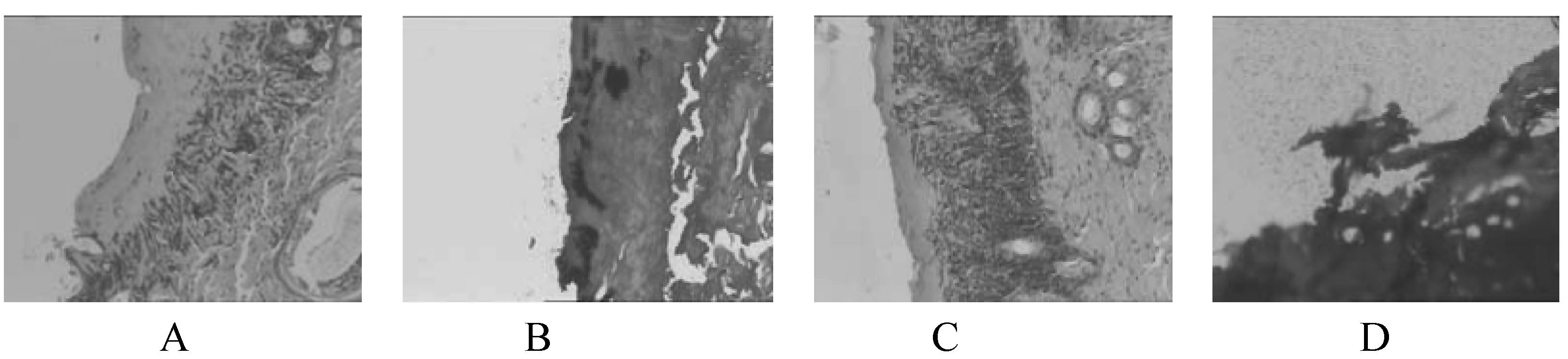
圖1 正常組第4天病理切片
2.2.2 模型組第4天局部組織病理切片
圖1C蘇木素-伊紅染色(100倍)顯示,大鼠表皮局部糜爛,鱗狀上皮灶性脫落,重度急慢性炎細胞浸潤,以中性粒細胞為主。毛囊及脈管周炎細胞浸潤。圖1D革蘭氏染色(100倍)表皮炎性滲出物中見大量革蘭陽性菌,真皮纖維組織中小灶區域見少許革蘭陽性菌浸潤。
2.3 造模前后大鼠血漿代謝輪廓分析
采用UPLC-QTOF/MS在正、負離子模式下采集正常組與模型組大鼠血漿的典型總離子流圖。如圖2所示,血漿中內源性物質均得到良好的分離,且實驗模型大鼠血漿的圖譜與正常組大鼠血漿的圖譜存在一定的差異。為了進一步檢測大鼠體表感染模型的代謝輪廓的變化情況,對正常組和體表感染模型大鼠的血漿代謝譜的數據進行模式識別,如PCA和OPLS-DA,見圖3。PCA圖可以看出正常組與模型組大鼠血漿代謝譜分為兩類,兩者明顯區分。OPLS-DA圖可以看出正常與模型大鼠的血漿生物樣品呈現聚攏狀態,且區分明顯。
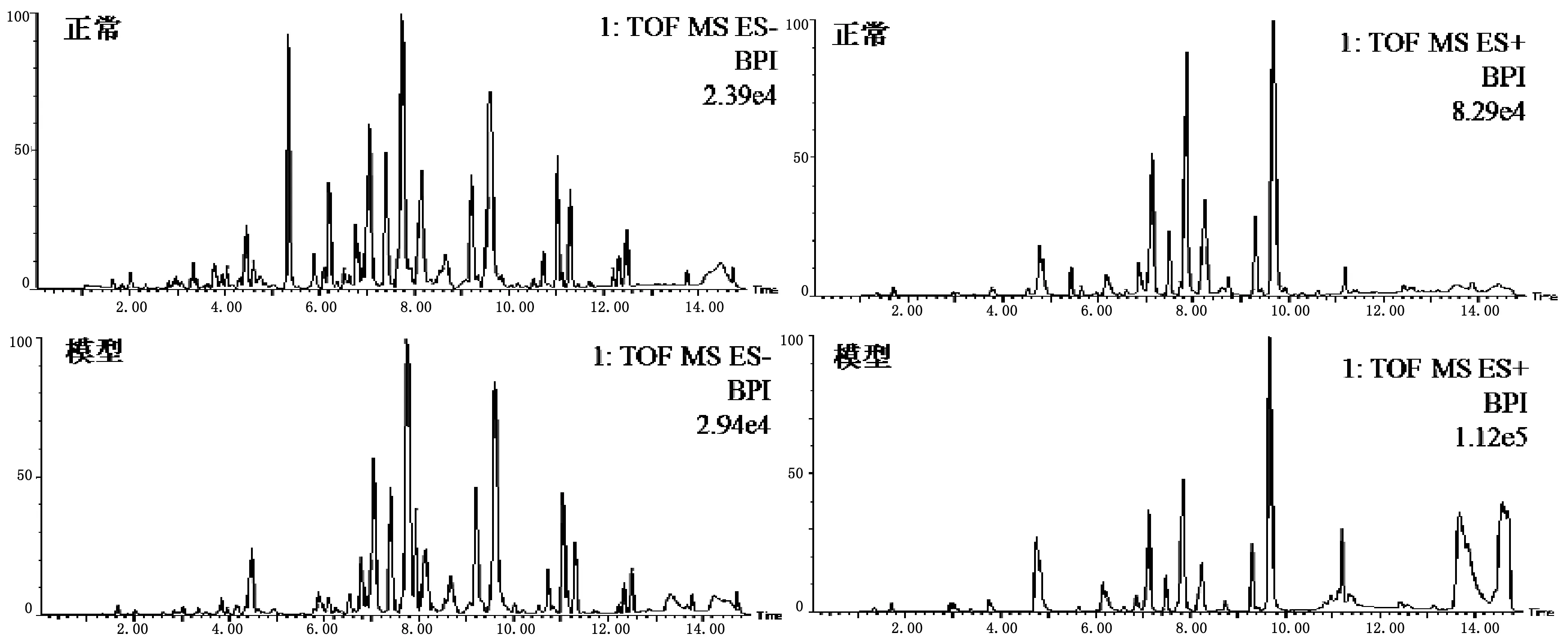
圖2 正常和模型大鼠血漿生物樣品在ESI+/ESI-模式下的色譜圖
2.4 造模前后大鼠尿液代謝輪廓分析
采用UPLC-QTOF/MS在正、負離子模式下采集正常組與模型組大鼠尿液的典型總離子流圖。如圖4所示,尿液中內源性物質均得到良好的分離,且模型大鼠尿液的圖譜與正常大鼠血漿的圖譜存在一定的差異。為了進一步檢測大鼠體表感染模型的代謝輪廓的變化情況,對正常組和體表感染模型大鼠的尿液代謝譜的數據進行模式識別,如PCA和OPLS-DA,見圖5。PCA圖可以看出正常組與模型組大鼠尿液代謝譜分為兩類,兩者明顯區分。OPLS-DA圖可以看出正常與模型大鼠的尿液生物樣品呈現聚攏狀態,且區分明顯。
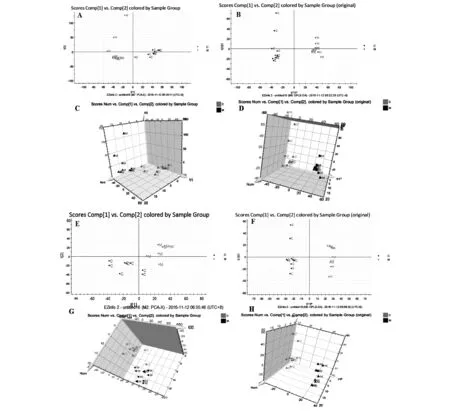
注:A,E.PCA圖(2D圖);B,F.OPLS-DA圖(2D圖);C,G.PCA圖(3D圖);D,H.OPLS-DA圖(3D圖);A,B,C,D為ESI-模式;E,F,G,H為ESI+模式圖3 大鼠血漿生物樣品在ESI+/ESI-模式下的PCA及OPLS-DA圖
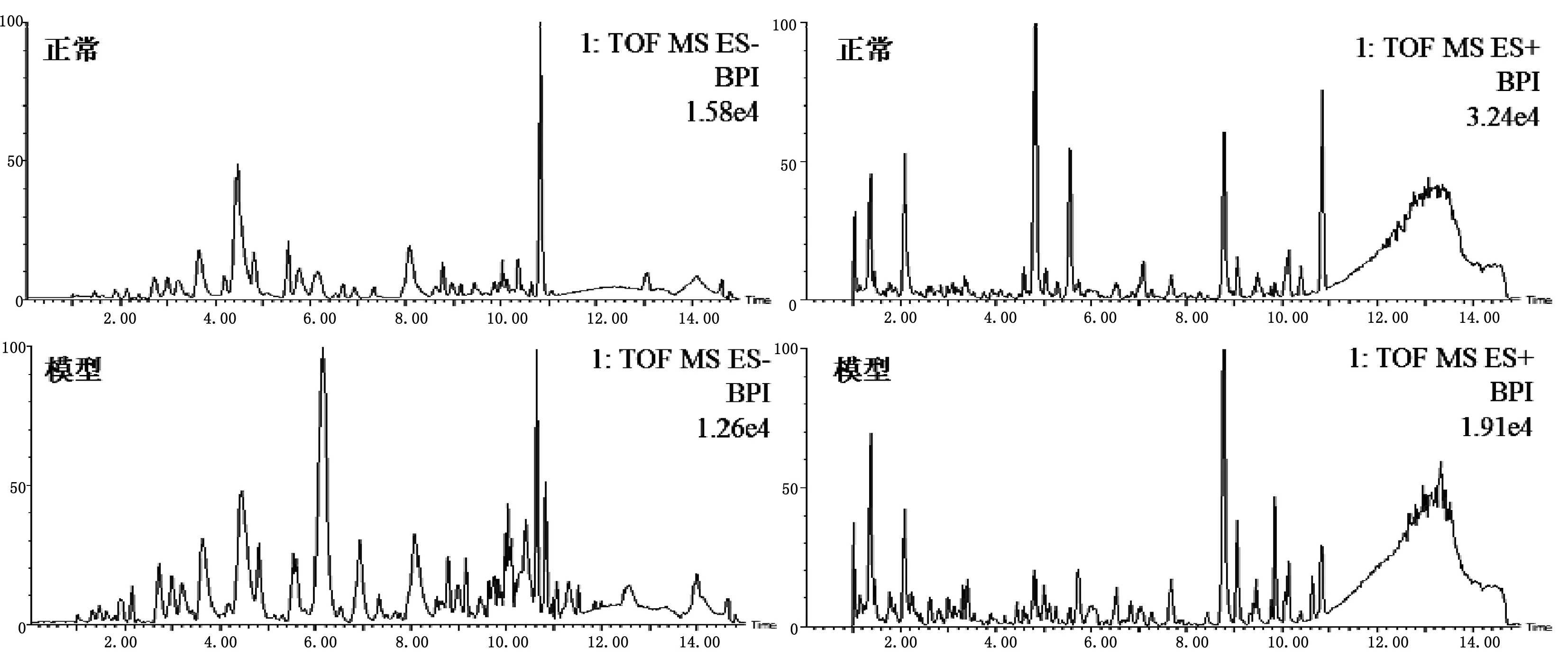
圖4 正常和模型大鼠尿液生物樣品在ESI+/ESI-模式下的色譜圖
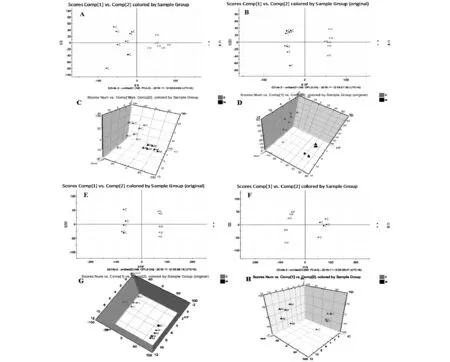
注:A,E.PCA圖(2D圖);B,F.OPLS-DA圖(2D圖);C,G.PCA圖(3D圖);D,H.OPLS-DA圖(3D圖);A,B,C,D為ESI-模式;E,F,G,H為ESI+模式圖5 大鼠尿液生物樣品在ESI+/ESI-模式下的PCA及OPLS-DA圖
3 討論
本研究按照“膠帶剝脫法”加皮下多點注射菌液法完成實驗動物模型的建立。將大鼠腹腔麻醉局部褪毛后以市售透明膠帶紙于大鼠背部大約粘扯30次左右后面積約3 cm2,即可導致大鼠表皮脫落,局部皮膚光亮、潮紅、見滲血點而無廣泛血液滲出,顯露真皮層,滴注菌液約后待麻醉動物蘇醒,菌液基本吸收,予以單籠飼養大鼠,以避免大鼠之間相互舔舐傷口影響藥物的療效。以后每天同一時間局部皮下再注射菌液,連續3 d。造模第4天觀察造模效果整體良好,感染情況明顯,出現較典型的局部紅熱腫脹現象,從全身及局部考察符合中醫外科陽證瘡瘍的特點,局部感染組織經病理切片證實為明顯的炎癥反應。從組織病理切片顯示來看,模型大鼠的皮膚壞死明顯,表面有大量的炎性滲出物及壞死物,大量淋巴細胞、單核細胞及中性粒細胞浸潤,符合體表感染的病理變化。通過代謝組學方法驗證分析發現,模型組的血漿和尿液在OPLS-DA圖上均呈現聚攏狀態且與空白組完全分開,偏離正常狀態,為模型造模成功提供明確的佐證。該造模方法取得成功,并未出現大鼠死亡。
中醫證候動物模型的建立與研究是聯系中醫基礎和臨床的橋梁和紐帶,是有效中藥的篩選、藥物作用機制深入研究的基礎[5],模型制作成功與否,直接影響實驗的過程與結果,一種符合中醫證候特點的瘡瘍中期感染模型的復制顯得必要。目前體表感染模型(瘡瘍)的制作有金葡菌直接注射法[6]、十字切開注射法[7-11]和表皮剝脫菌液滴注法[12]等,均可不同程度地引起局部的感染證候,但由于動物的抗感染能力較強,比較難復制出瘡瘍中期(膿腫期)的模型,經過反復的預實驗,本次研究采用Elisabeth Kugelberg 等[4]設計的膠帶表皮剝脫加皮下連續注射的方法制作模型,目的是造成連續感染,使得感染模型進入瘡瘍中期階段,以滿足實驗需求。后續的實驗研究中,可根據需要減少注射次數和初次菌液滴注量和吸收時間等,可獲得不同感染程度的局部瘡瘍模型,供不同的實驗需要。
中醫證候動物模型的建立與評價經歷了較長時間的發展,現在仍處于探索的階段,也存在著許多的問題和爭議,這主要源于證本質研究尚未完善,臨床診斷信息無法應用于動物模型評價中。學術界公認的較客觀地評價中醫證候的指標并不多,且缺乏特異性等。代謝組學是一種采用系統生物學思路研究代謝小分子組的高通量的分析方法,通過比較不同條件下相關小分子的代謝圖譜,找到具有差別意義的生物標志物[13-14],為客觀評價中醫證候模型提供了不同的思路與依據,代謝組學整體性、動態性、系統性特點與中醫基本理論非常吻合,在中醫證候動物模型研究領域中展現出很重要應用前景,對中醫藥現代化的實現起到有力的推動作用[15]。利用代謝組學對中醫證候動物模型進行研究,具有方法論的高度契合性、學術思想的有效相通性和研究方法的一致性等特點和優點,將會是今后研究的熱點和趨勢。應用代謝組學來研究、評價和指導建立中醫證候動物模型,通過代謝組與生物體功能狀態關系的建立,能夠比較有效地克服目前證候動物模型證候難以判定的難題,同時又可指導中醫證候動物模型的創制,有希望進一步推進中醫證候動物模型的復制以及中醫證候本質標準化和規范化的研究[16]。

