復元醒腦湯對糖尿病腦梗死大鼠BMECs的影響及miRNA-320的調控機制研究*
沈俊逸,趙智明,劉春麗,壯雨雯,徐文俊,蔡 輝
(中國人民解放軍東部戰區總醫院中西醫結合科,南京 210002)
糖尿病并發腦梗死是多因素、多途徑、多方式共同作用的結果[1-2]。近年來,多項研究顯示在糖尿病腦梗死的缺血區可以觀察到血管新生現象,以毛細血管密度增高、微血管形成和側枝循環建立為主要表現,這些新生血管有助于神經缺損功能的修復[3]。糖尿病腦梗死后,基質細胞衍生因子-1(SDF-1)和CXC趨化因子受體4(CXCR4)下調,造成內皮祖細胞(EPCs)的數量減少,黏附、遷移功能的下降,復元醒腦湯能夠有效地促進缺血腦組織血管內皮生長因子(VEGF)的表達,同時增強了EPCs增殖、黏附和遷移的功能[4]。阻斷SDF-1/CXCR4軸信號通路后,梗死組織還有部分血管新生,說明可能有其他機制參與了糖尿病腦梗死后的血管新生。Wang等[5]研究結果顯示在糖尿病大鼠中微小RNA-320(miRNA-320)的表達升高。將miRNA-320的類似物轉染至糖尿病心肌微血管內皮細胞中,細胞的增殖和遷移就會受到抑制;如果轉染miRNA-320的抑制劑則會出現相反的結果,細胞的增殖和遷移能力增強,胰島素樣生長因子-1(IGF-1)的表達上調,從而促進了血管新生[6-8]。miRNA-320負性調控IGF-1及其胰島素樣生長因子-1受體(IGF-1R),對糖尿病誘發的血管病變有重要影響[9-11]。因此,課題組推測復元醒腦湯對糖尿病腦梗死的作用機制可能與miRNA-320基因表達調控因子促進缺血腦組織的血運重建有著重要聯系。本研究以腦皮質微血管內皮細胞(BMECs)為研究對象,觀察miRNA-320基因表達及其基因沉默后的變化,以及復元醒腦湯對其干預前后的變化,以期闡述復元醒腦湯促進糖尿病腦梗死缺血腦組織區域血運重建的分子機制。
1 材料和方法
1.1 主要實驗材料
1.1.1 實驗動物 20只健康雄性SD大鼠,體質量(250±25)g,購自上海SLAC實驗動物有限公司[動物合格證:SCXK(滬)2011-009]。
1.1.2 實驗藥物 復元醒腦湯[人參10 g(單煎),三七 10 g,石菖蒲 12 g,水蛭 10 g,益母草 30 g,生天南星 15 g,制大黃 9 g(后下),濃度 388 g/L]由南京軍區南京總醫院藥劑科制備。
1.1.3 主要試劑及儀器 胎牛血清(FBS),青霉素和鏈霉素溶液(P/S)和DMEM/F12培養基購買于法國Biosera公司;血管內皮細胞培養基(ECM)購買于美國ScienCell公司;RNA抽提試劑,反轉錄試劑盒和SYBR green實時熒光定量PCR試劑盒購自日本 Takara 公司;MiR control inhibitor,LipofectamineTMRNAi MAX Transfection Reagent、rno-miRNA-320 inhibitor購買于Thermo公司;鏈脲佐菌素(STZ)、MTS、結晶紫 和Ⅱ型膠原酶(Type2 Collagenase)購買于美國Sigma公司,Ⅷ因子相關抗原(vwF)抗體購于美國Abcam公司;基質膠Matrigel購買于美國Gibco公司。酶標儀(美國Thermo公司,Multiskan MK3型),實時熒光定量PCR儀(美國Bio-Rad公司,CFX 96型),CO2細胞培養箱(日本三洋,MCO-18AC)。
1.2 BMECs的分離 根據文獻[12]復制糖尿病腦梗死大鼠模型,注射STZ制備糖尿病大鼠模型,線栓法制備腦梗死模型,依照Berderson評分(≥1)[13]確定造模成功。成模后,用10%的水合氯醛(1 mL/kg)腹腔注射麻醉大鼠后,再脫頸處死大鼠。用75%乙醇消毒大鼠,迅速斷頭取出完整的腦組織,放到預冷的磷酸緩沖鹽溶液(PBS)中進行漂洗,將大腦皮質組織剪成1 mm3的小塊,放入1 mL DMEM/F12培養液。離心收集組織,將組織加入到0.1%的Ⅱ型膠原酶,于37℃水浴消化40 min,離心8 min(1 000 r/min),去除上清,加入20%FBS懸浮中和,離心(1 000 r/min)20 min,去除神經和血管組織,收集沉淀。繼續將2 mL的Ⅱ型膠原酶懸浮沉淀,于37℃進行水浴消化,離心 8 min(1 000 r/min),去上清后用 20%FBS混勻,進行離心(1 000 r/min)20 min,底部沉淀為微紅色的微血管段。
1.3 BMECs的培養和鑒定 用ECM培養基(ECM+10%FBS+1%P/S)混懸細胞,接種于10 cm細胞培養皿,培養過夜,于倒置顯微鏡下拍照記錄細胞形態。將2×105細胞接種到24孔板,培養3 d,用PBS漂洗細胞,加入4%的多聚甲醛固定細胞10 min,37℃用抗體 vwF 孵育細胞(1∶200)30 min,用 PBST 漂洗細胞3次,用細胞核染料DPAI染細胞核,并在倒置熒光顯微鏡下拍照。
1.4 對照血清和含藥血清的制備 取健康雄性SD大鼠20只,按照隨機數字表法隨機分為2組,每組10只,SPF級飼養。一組常規飼養,另一組常規飼養的基礎上以復元醒腦湯灌胃,根據臨床經驗每日2次按10.4 g/kg體質量給以復元醒腦湯灌胃(參照陳奇主編《中藥藥理實驗方法學》依實驗動物與人體表面積比計算),連續3 d。于末次給藥1 h后腹主動脈采血,制備對照血清和含藥血清。腹主動脈采血后,血樣室溫放置1 h,離心,無菌分離并混合血清,56℃水浴中滅活補體30 min,-20℃冰箱凍存備用。
1.5 BMECs轉染miRNAinhibitor 當培養的BMECs達到60%~80%貼壁后,以3×105個/孔鋪于6孔板,一半給予對照血清(5%)處理,一半給予含藥血清(5%)處理,培養24 h后用Lipofect RNAi MAX試劑盒分別轉染 miRNA inhibitor control、rno-miRNA-320inhibitor40pmol。共分為4個實驗組:對照血清+control inhibitor組,對照血清+miRNA-320inhibitor組,含藥血清+controlinhibitor組,含藥血清+miRNA-320 inhibitor組。
1.6 BMECs細胞的增殖能力測定 miRNA轉染24h后的BMECs細胞,用胰酶消化離心(1000r/min,5 min)收集細胞,接種入 96孔板(3×103/孔)。于第1、2、3、4、5 天用甲臜化合物(MTS)檢測細胞活性:每孔中加入 20 μL MTS,37 ℃、5%CO2恒溫培養箱中孵育1 h后,用酶標儀檢測490 nm處的吸光度值。
1.7 BMECs細胞的遷移能力測定 miRNA-320轉染BMECs 24 h后,用胰酶消化細胞,將1×106個細胞接種到24孔的Transwell小室的上室中(孔徑8 μm),在下室中加入 500 μL 的 ECM 培養基(含有空白大鼠血清和中藥大鼠血清)。24 h后,將上室取出,用4%的多聚甲醛固定細胞,用0.1%的結晶紫染色,小室的上室用棉簽擦拭干凈,在倒置顯微鏡下拍照觀察細胞遷移。拍照結束后用10%的醋酸洗脫結晶紫,將洗脫后的液體收集在酶標儀下檢測吸光值(560 nm)。
1.8 BMECs細胞的小管形成能力測定 將100 μL Matrigel均勻涂抹到24孔板中,37℃放置30 min,待凝固,加入 500 μL 的細胞懸液(1×106),然后24孔板放置到37℃、5%CO2培養箱12 h,拍照觀察成管能力。
1.9 BMECs miRNA-320、IGF-1 和 IGF-1R mRNA基因表達水平檢測 BMECs細胞轉染miRNAinhibitor control和rno-miRNA-320 inhibitor,并分別用空白血清和中藥血清處理培養48 h后,收集的BMECs細胞樣本,抽提RNA,并反轉錄為cDNA,采用實時熒光定量 PCR(qPCR)檢測 miRNA-320、IGF-1、IGF-1 R的基因表達,以U6作為miRNA內參,GAPDH作為mRNA內參。引物序列如下:MiR-320-F ACACTCCAGCTGGGACTTAAACGTGGTTGTAC;MiR-320-R TGTCGTGGAGTCG GCAATTC;U6-F GCTTCGGCAGCACATATACTAAAAT;U6-RCGCTTCAC GAATTTGCGTGTCAT;IGF-1-F ACTCGATAACTTTGCCAGAAGAG;IGF-1-RTTCTTGTGTGTCGATAGGGGC;IGFR-F TAGTGGGT GTGTTGCCACC;IGFRR TCCACCGTGTTGCAAGA CTAG;GAPDH-F ACTTTGGCATCGTGGAAGGG;GAPDH-R TGCAGGGATGATGTTCTGGG。
1.10 統計學方法 所有實驗數據采用GraphPad軟件進行統計學分析,計量資料以均數±標準差(x±s)表示,P<0.05為差異具有統計學意義。
2 實驗結果
2.1 BMECs的鑒定 白光下分離培養的BMECs細胞形態呈短梭形,見圖1A。Ⅷ因子為BMECs的標志性蛋白,DAPI為核酸染料用于指示細胞核,見圖1B,用免疫熒光的方法檢測BMECs發現細胞漿及細胞核周圍具有綠色熒光,見圖1C,免疫熒光(vwF)鑒定結果顯示分離的細胞為陽性的BMECs,而且純度高,見圖1D。

圖1 分離培養的BMECs細胞形態和Ⅷ因子免疫熒光Fig.1 BMECs morphology and factorⅧimmunofluorescence
2.2 miRNA-320 inhibitor顯著抑制miRNA-320的表達 BMECs轉染miRNA inhibitor control和rnomiRNA-320 inhibitor 48 h后,收取細胞,抽提RNA,反轉錄,做qPCR檢測miRNA-320的表達,用U6作為內參,驗證miRNA inhibitor的效率。結果顯示miRNA-320 inhibitor的相對基因表達量 (0.19±0.03)可以顯著抑制miRNA-320的相對基因表達(miRNA control為 1.02±0.14,P<0.01)。抑制效果可以達到80%以上。
2.3 BMECs細胞的增殖能力 BMECs細胞轉染miRNA control inhibitor和rno-miRNA-320 inhibitor 24 h 后,于第 1、2、3、4、5 天分別用 MTS 法做細胞增殖實驗。如圖2所示,與對照血清+control inhibitor組相比,對照血清+miRNA-320 inhibitor組、含藥血清+control inhibitor組、含藥血清+miRNA-320 inhibitor組 BMECs的細胞增殖能力都顯著增強(P<0.01)。從培養的第2天開始,BMECs的細胞增殖能力出現顯著差異,可見含藥血清和miRNA-320抑制劑都可以促進BMECs的細胞增殖,從培養的第3天開始,中藥血清促進BMECs增殖能力與miRNA-320抑制劑相當,在含藥血清和miRNA-320抑制劑的雙重作用下,BMECs的增殖最為明顯。
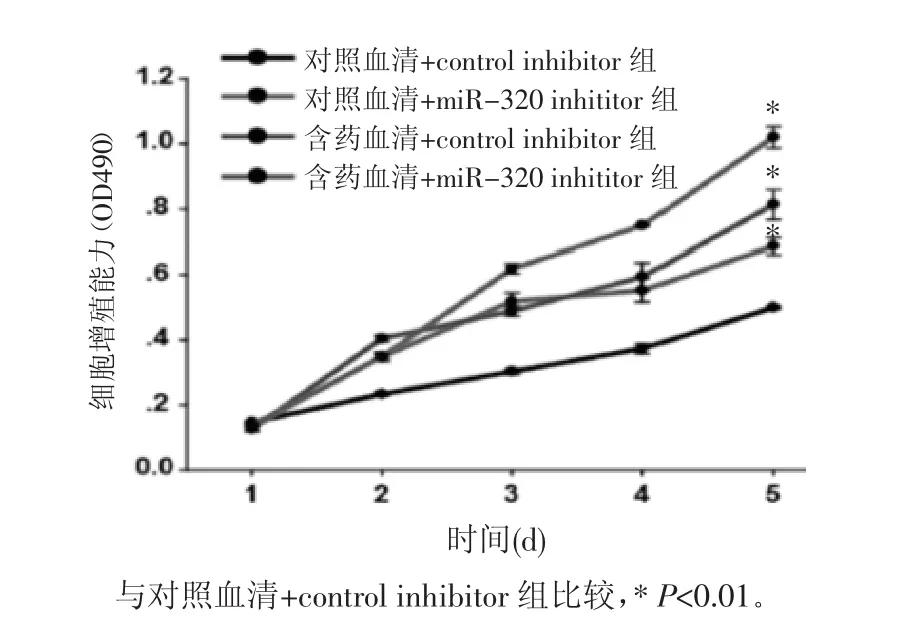
圖2 各組BMECs細胞的增殖能力Fig.2 Proliferative capacity of BMECs cells in each group
2.4 BMECs細胞的遷移能力 見圖3和表1。與對照血清+control inhibitor組相比,對照血清+miRNA-320 inhibitor組、含藥血清+control組和含藥血清+miRNA-320 inhibitor BMECs的細胞遷移能力具有顯著差異(P<0.01),可見含藥血清和抑制 miRNA-320都可以促進BMECs的細胞遷移,miRNA-320抑制劑促進BMECs遷移的能力與中藥血清相類似,沒有統計學差異,在中藥血清和miRNA-320抑制劑的雙重作用下,BMECs的遷移能力增加更明顯。
2.5 BMECs細胞的小管形成能力 取處于對數生長期的BMECs細胞進行小管形成能力的測定。對照血清+control inhibitor組的成管能力最弱。含藥血清和miRNA-320 inhibitor對成管都有一定的促進作用,但含藥血清+miRNA-320 inhibitor組促進成管能力最強。見圖4。說明復元醒腦湯和miRNA-320抑制劑均可以通過促進小管形成修復糖尿病腦梗死的血管損傷。
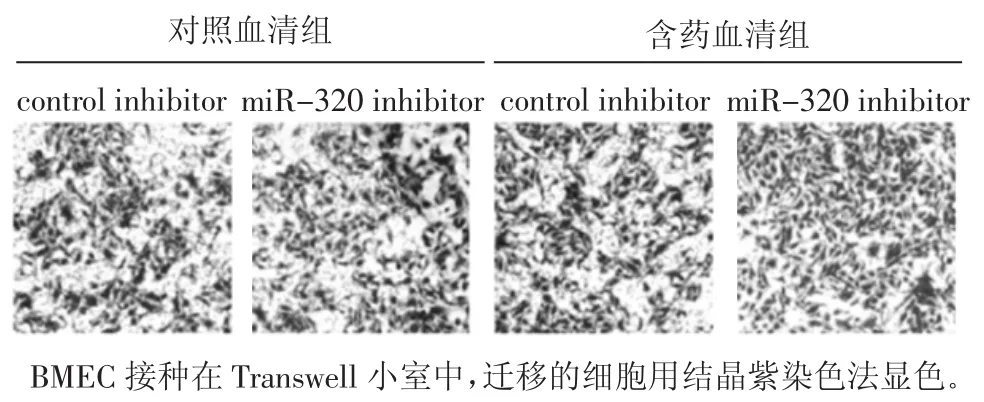
圖3 含藥血清對BMEC遷移能力的影響(×200)Fig.3 Effect of serum containing traditional Chinese medicine on the BMEC mobility(×200)
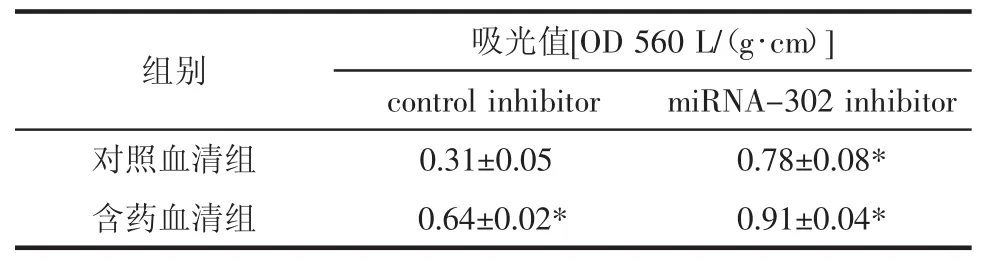
表1 酶標儀檢測含藥血清對BMEC遷移能力的影響Tab.1 The effect of serum containing traditional Chinese medicine on the migration of BMEC was detected by enzyme labeling apparatus
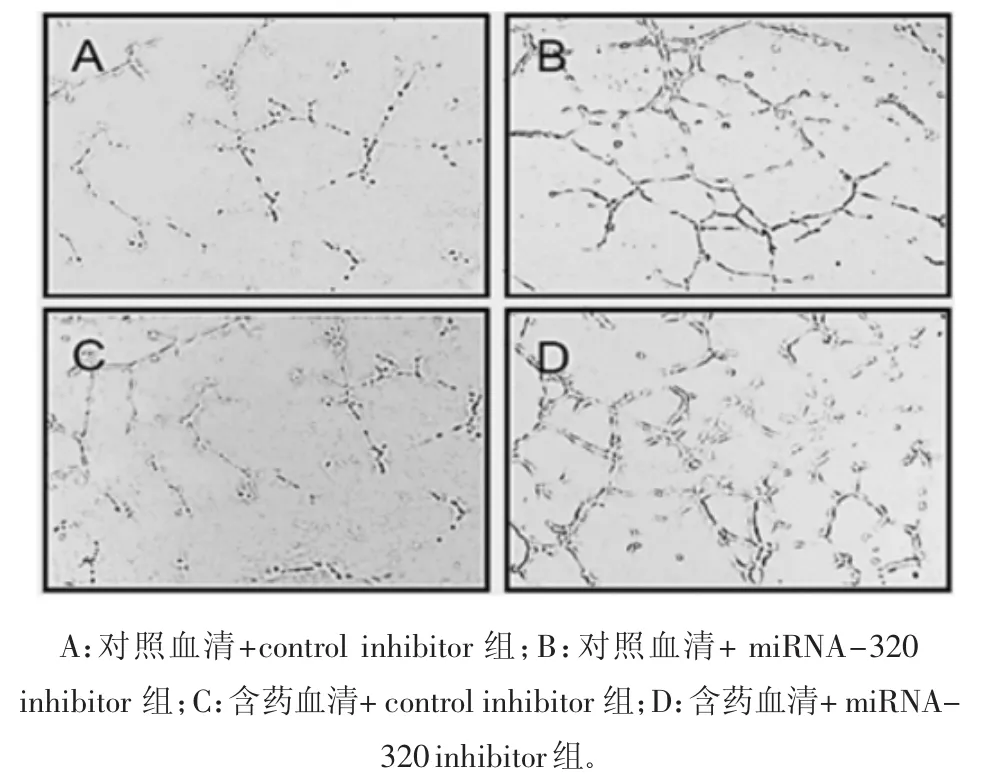
圖4 各組BMECs細胞的成管能力(×40)Fig.4 Tube forming ability of BMECs cells in each group(×40)
2.6 各組BMECs miRNA-320、IGF-1、IGF-1R基因表達水平 如表2所示,與對照血清+control inhibitor組比較,對照血清+miRNA-320 inhibitor組、含藥血清+control inhibitor組和含藥血清+miRNA-320 inhibitor組的miRNA-320和IGF-1的基因表達水平均有統計學差異(P<0.01)。可見含藥血清和抑制miRNA-320都可以抑制miRNA-320的基因表達,并促進IGF-1的基因表達,其中miRNA-320抑制劑的作用強于含藥血清。各組IGF-1R 基因的表達無統計學差異(P>0.05)。

表2 各組BMECs miRNA-320、IGF-1、IGF-1R基因表達水平Tab.2 Expression levels of microRNA-320,IGF-1 and IGFR of BMECs in each group
3 討論
糖尿病腦梗死發生后miRNA-320的表達升高,miRNA-320作為IGF-1的負性調節因子,會降低IGF-1的表達[14-16]。腦缺血發生后,IGF-1及IGF-1R持續內源性消耗,合成減少,IGF-1及其IGF-1R表達下降,血管新生能力受到抑制。同時由于缺血神經組織處于缺氧狀態,會誘發神經組織的凋亡和壞死,IGF-1作為一種神經保護和促進神經再生因子,可以促進神經功能的恢復,同時可以降低神經細胞的凋亡,而IGF-1的缺乏會使神經組織失去自我保護和修復的能力[17-18]。本研究發現復元醒腦湯可以促進BMECs的增殖、遷移及成管能力。BMECS的數量增加和功能增強一方面為腦部神經組織提供了大量的氧氣和營養的供應,同時改善了梗死腦組織內血管內皮細胞與神經元的損害,促進血運重建,有助于神經缺損功能的恢復。
復元醒腦湯能夠發揮良好作用主要是因為其方劑配伍符合中醫的診治思想。中醫認為糖尿病屬于“消渴”,腦梗死為“中風”。“消渴”以燥熱為標,“中風”是經絡瘀血、肝臟和腎臟陰虛以及氣血阻滯造成。治療糖尿病腦梗死要堅持扶正元氣,化痰祛瘀、息風泄熱、醒腦開竅[19-20]。復元醒腦湯方劑由人參、生天南星、石菖蒲、三七、水蛭、益母草、大黃組成,有很好的臨床療效。人參為君補元氣;石菖蒲和生天南星的作用是豁痰瀉濁開竅,水蛭、三七和益母草用于活血化瘀;大黃具有息風泄熱功效。本研究從miRNA-320負性調控IGF-1的表達方向對復元醒腦湯促進糖尿病腦梗死缺血腦組織血運重建的分子機制和作用靶點進行了深入探索,豐富和發展了復元醒腦湯的作用機制。

