煤自燃程序降溫特性參數的實驗研究
王曉東
(陜西陜煤彬長礦業有限公司,陜西咸陽 712000)
0 引言
煤炭是我國的主要能源,在我國一次能源生產和消費結構中占70%左右[1],煤炭在我國能源結構中的這種主體地位未來幾十年不會改變。但我國煤炭開采的自然條件相對較差,各種災害時有發生,嚴重影響了安全生產,煤層自燃災害就是其中之一。
近年來,我國廣泛采用綜采放頂煤開采技術和瓦斯抽放技術,造成采空區遺留殘煤多、漏風嚴重,使得煤自然發火頻繁。我國國有重點煤礦每年因自燃火災而封閉的工作面超過100個[2],大量的煤炭因火區而凍結,合理的開拓部署和開采順序常被打亂,為礦井帶來巨大的經濟損失和重大的事故隱患。
煤自燃不僅燒毀大量的煤炭資源,造成巨大的資源損失和環境污染,而且產生有毒有害氣體,嚴重危及井下人員的生命安全。當前國內外對煤自燃特性的研究大多集中于升溫階段,如王長安[3]研究了煤在低氧氣體積分數條件下的煤燃燒特性,金永飛[4]等對煤自燃高溫貧氧氧化燃燒特性參數進行了試驗研究,鄭學召[5]等研究了水分含量對煤自燃發火特性參數的影響,鄧軍[6]等對不同變質程度煤二次氧化自燃的微觀特性進行了研究,秦榮宏[7]等研究了地溫和濕度對采空區特厚遺煤自燃影響規律,馬礪[8]等研究了粒度對煤自燃極限參數的影響,鮮少有對降溫過程中煤自燃過程特性的研究。文中通過程序升溫和降溫實驗,研究煤自燃耗氧速率、含氧氣體及含氫氣體的變化規律,在一定程度上可以對煤礦現場實施煤自燃滅火有重要的理論依據和指導意義。
1 實驗裝置及實驗條件
采用XK系列煤自燃程序升溫實驗系統,模擬分析煤自燃的升溫和降溫過程。實驗主要有氣路、控溫箱和氣樣采集分析3部分組成,如圖1所示。
選用黃陵二號煤礦煤樣,其煤種為弱粘煤,煤樣的工業分析數據見表1。將原煤破碎成:0~0.9 mm、0.9~3 mm、3~5 mm、5~7 mm 和7~10 mm 的5種粒徑,取5種粒徑煤樣各200 g,組成1 000 g混合煤樣。實驗條件見表2。
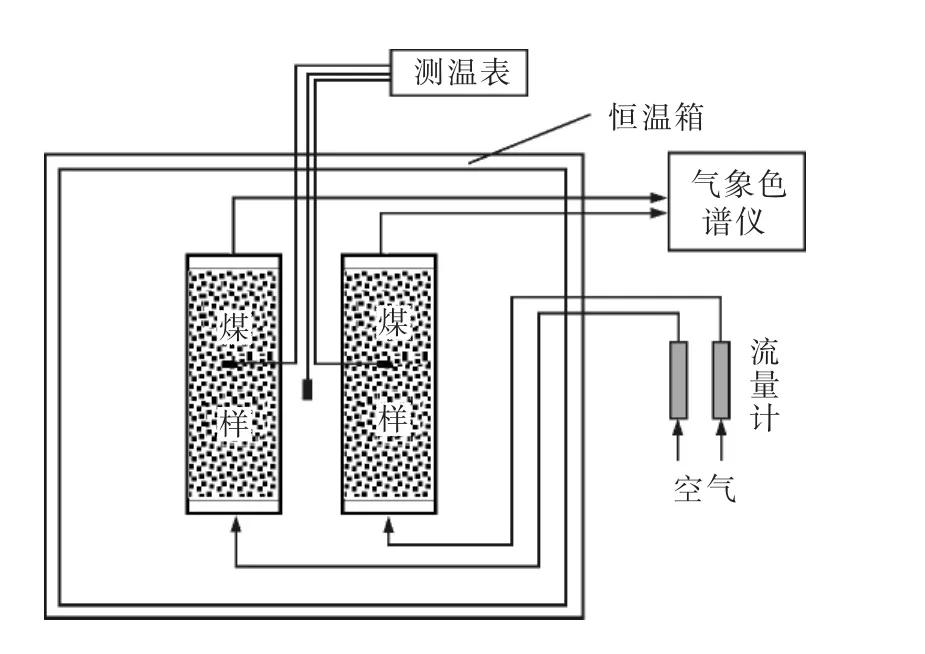
圖1 煤自燃程序升溫實驗示意圖

表1 煤樣的工業分析和元素分析

表2 實驗條件
2 實驗結果及分析
2.1 耗氧速率分析
在程序升溫和程序降溫的實驗中,O2體積分數變化曲線如圖2所示。耗氧速率與煤溫變化曲線,如圖3所示。

圖2 出氣口氧氣體積分數曲線
由圖2、3可知:100℃之前,升溫和降溫的耗氧速率基本一致;100~140℃之間,程序升溫出氣口氧氣體積分數大于程序降溫出氣口氧氣體積分數,降溫過程耗氧速率大于升溫過程耗氧速率;140℃之后,降溫過程耗氧速率略大于升溫過程耗氧速率,變化趨勢相似。
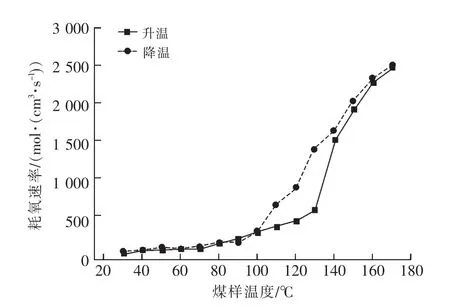
圖3 耗氧速率曲線
70℃之前,煤的耗氧速率特別緩慢;70~90℃之間,耗氧速率逐漸增加;90℃以后耗氧速率迅速增加,氧氣體積分數迅速減小;150℃后,氧氣體積分數降至5%以下,煤氧復合反應維持在較高的耗氧量狀態,且耗氧量繼續增加,導致耗氧速率呈緩慢上升趨勢,氧氣體積分數緩慢降低。這說明在煤體溫度較高時,煤氧復合反應在貧氧條件下可繼續進行。
2.2 含氧氣體產生規律分析
CO產生規律:在程序升溫和程序降溫實驗過程中,隨煤溫的增加CO產生量的變化曲線,如圖4所示。
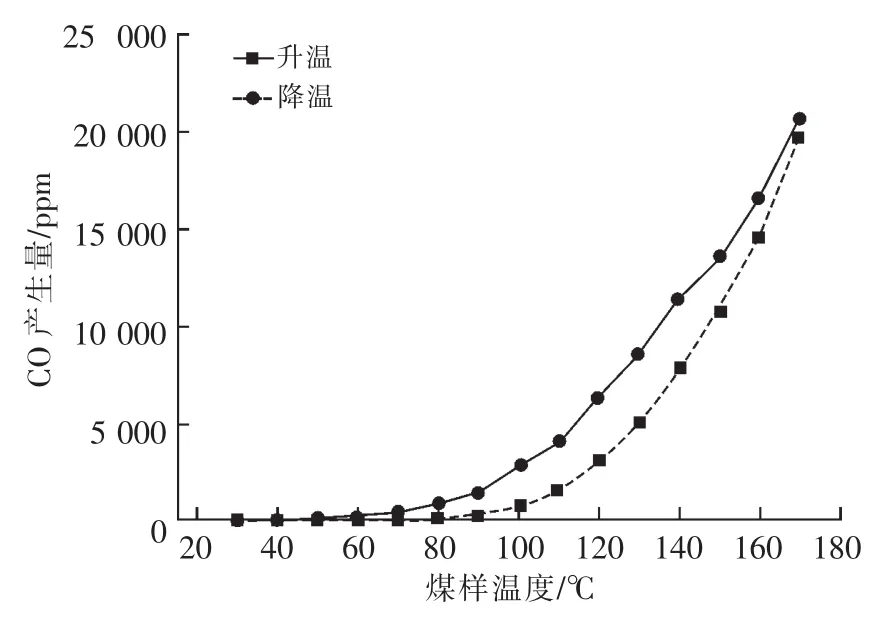
圖4 CO產生量隨煤溫變化曲線
由圖4可知,降溫過程中,隨溫度的降低CO產生量整體呈下降趨勢;90℃之前,下降趨勢較緩;60℃之前,下降趨勢近似水平。說明溫度小于60℃時,煤氧復合反應幾乎不再進行。30~60℃之間,升溫和降溫過程CO產生量基本相同,但主要來源不同。升溫過程CO主要是成煤過程中吸附或游離于煤結構表面和空隙內的CO脫附產生。降溫過程CO主要是高溫段煤氧反應生成的CO吸附或游離于煤結構表面,然后逐漸解析脫附產生。60~170℃之間,降溫過程CO產生量大于升溫過程CO產生量,此溫度區間范圍內CO主要是由煤氧復合反應生成。150℃之后,降溫過程和升溫過程CO產生量之差逐漸減小。
CO2產生規律:在程序升溫和程序降溫實驗過程中,隨煤溫的增加CO2產生量的變化曲線,如圖5所示。
由圖5可知,降溫過程中,CO2產生量整體呈下降趨勢;80℃之前,CO2產生量隨煤溫的降低而減小的趨勢變緩;降溫過程CO2產生量大于升溫過程CO2產生量。因為經過燃燒的煤,其結構發生變化,分子間空隙增大有利于氧氣流動,再次氧化時氧與煤分子接觸更加充分,氧化還原反應更強烈。
2.3 含氫氣體產生規律分析
含氫氣體 CH4、C2H6、C2H4產生量隨煤溫變化曲線如圖6、圖7和圖8所示。
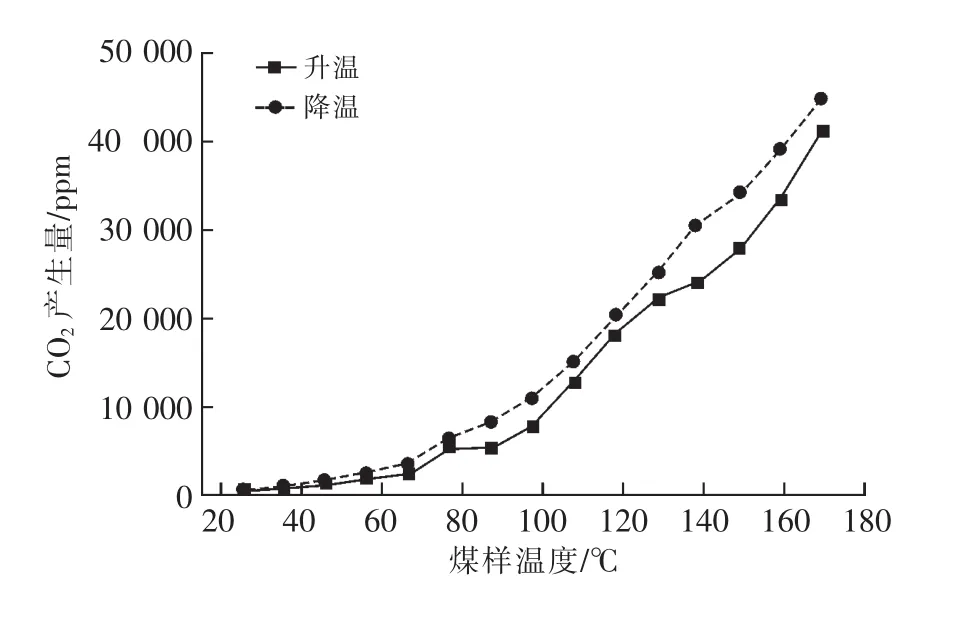
圖5 CO2產生量隨煤溫變化曲線
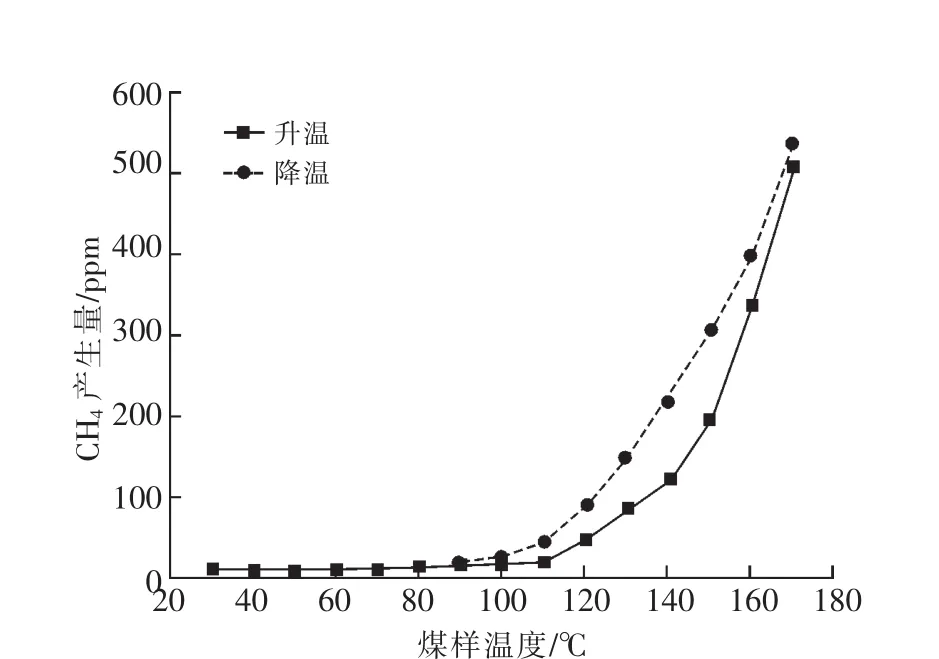
圖6 CH4產生量隨煤溫變化曲線
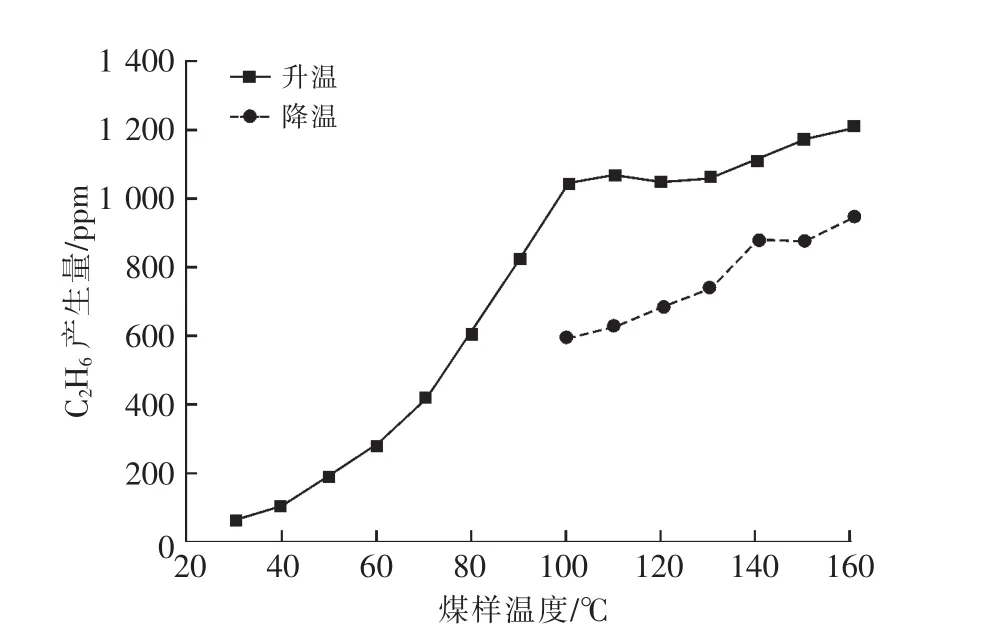
圖7 C2H6產生量隨煤溫變化曲線
由圖6可看出:程序降溫階段,CH4產生量隨溫度的降低而逐漸減少;120~90℃之間,CH4減小速率較緩慢;90℃以后不再產生CH4。降溫階段CH4產生量大于升溫階段CH4產生量。降溫過程中CH4是由煤氧化熱解產生的。升溫過程中低溫階段(30~90℃),CH4來源于煤中CH4的脫附解析,之后隨溫度的升高,煤結構發生熱解反應,煤分子中的側鏈(甲基側鏈、脂肪側鏈)和橋鍵等裂解斷裂生成CH4[9-11]。因為升溫過程中產生的側鏈和橋鍵還沒有完全熱解為CH4,緊接著降溫過程又有新的側鏈和橋鍵產生。所以相同煤溫時,降溫過程中CH4產生量大于升溫過程中CH4產生量。在90℃附近時,煤溫不足以提供側鏈和橋鍵熱解所需的能量,故不再產生CH4。
由圖7可以看出:降溫過程中,C2H6產生量隨煤溫的降低而減小;煤溫降到100℃之后,不再產生C2H6;相同溫度,降溫時C2H6的產生量小于升溫時C2H6的產生量;煤體本身吸附一定量的C2H6;160℃是C2H6產生量的一個突變拐點,與文獻[12]研究結果一致。
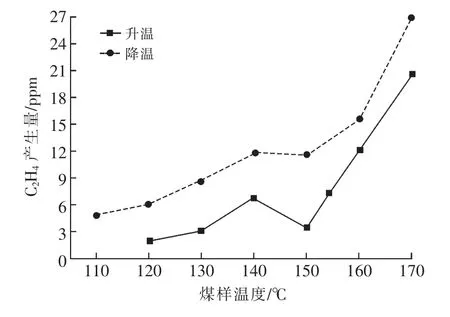
圖8 C2H4產生量隨煤溫變化曲線
由圖8可看出:降溫過程中,C2H4產生規律與C2H6產生規律相似,這是因為兩種氣體產生機理相同,均為煤結構中游離相脂肪烴上自由基裂解和苯環上脂肪烴側鏈斷裂生成[13],因此也解釋了降溫時C2H6產生量低于升溫過程,而C2H4則相反。升溫時C2H4出現溫度為120℃,而降溫時C2H4消失溫度為110℃,可能是因為自燃后煤的微觀結構發生變化,使C2H4的生成較容易。
3 結論
(1)煤樣在降溫過程中,各種氣體產物產生量均隨溫度的降低而減小。
(2)含氫氣體出現和消失時對應的溫度不同。
(3)煤自燃降溫和升溫過程均呈現出明顯的非線性特征,但降溫與升溫階段并不重合,即煤自燃的降溫過程和升溫過程具有非對稱性,這種現象稱之為“滯后”效應。

