阿托伐他汀鈣致糖代謝異常大鼠模型的建立
林燕珊,朱孔博,錢玲林,安麗,慕廣建,任利群,
(東南大學附屬中大醫院1.老年醫學科;2.心血管內科,江蘇 南京 210009)
他汀類藥物即3- 羥基- 3- 甲基- 戊二酰輔酶A還原酶抑制劑,能夠有效降低膽固醇,降低心腦血管疾病死亡率,并已廣泛應用于心腦血管疾病的一級預防和二級預防[1- 2]。然而研究[3]發現,瑞舒伐他汀鈣治療后新發糖尿病風險明顯增加,之后大量研究進一步證實了他汀類藥物致新發糖尿病發生風險增加[4- 5],并且呈劑量依賴性[6]。3項關于阿托伐他汀鈣的大規模隨機試驗即TNI、IDEAL、SPARCL的研究結果提示,強化他汀治療增加新診斷糖尿病的風險[7]。盡管應用他汀類藥物的獲益遠遠超過其致血糖異常風險,但為了使其臨床應用獲益最大化,控制心血管事件殘余風險,深入研究他汀類藥物誘發糖尿病的分子機制十分重要。目前他汀類藥物引起糖代謝異常的研究多局限于體外細胞學研究[8- 10],仍缺乏在體研究的動物模型。本研究建立他汀誘發糖代謝異常的大鼠模型,為進一步研究他汀類藥物致糖代謝異常的分子機制奠定基礎。
1 材料與方法
1.1 藥品與試劑
普通大鼠飼料(含碳水化合物45%、蛋白質40%、脂肪10%、其他5%)購自江蘇省協同醫藥生物工程有限公司;阿托伐他汀鈣粉劑由諾華山德士(中國)制藥有限公司提供(批號:J20130172);血糖儀、血糖試紙購自德國拜耳公司;大鼠胰島素定量分析酶聯免疫檢測試劑盒購于安徽巧伊生物科技有限公司,酶標儀為美國Bio- Rad公司。
1.2 實驗動物及分組
健康雄性8周齡SPF級Wistar大鼠16只,體重(280±5) g,由揚州大學比較醫學中心提供,動物合格證編號(NO.201717658)。所有Wistar大鼠SPF環境飼養,環境溫度控制在22~25 ℃,濕度為(55±5)%,光照黑暗循環(光照時間為7:00~19:00)。大鼠適應性飼養1周后采用隨機數字表方法隨機分為兩組,即對照組及阿托伐他汀鈣組,每組8只。阿托伐他汀鈣組給予阿托伐他汀鈣50 mg·kg-1·d-1灌胃,對照組給予等量去離子水灌胃,兩組均干預24周。
1.3 口服葡萄糖耐量試驗及胰島素釋放試驗
干預大鼠24周后行口服葡萄糖耐量試驗,禁食12 h 后剪尾采血測空腹血糖,并留取血清,隨后以2 g·kg-1葡萄糖灌胃,分別于30、60、90和120 min時間點采血測血糖,并留取血清。采用ELISA法測量血清胰島素,并計算穩態模型評價(homeostasis model assessment,HOMA)指數,即胰島β細胞功能指數(homeostasis model assessment for beta cell function,HOMA- β)=20×空腹胰島素水平/空腹血糖水平-3.5;胰島素抵抗指數(homeostasis model assessment for insulin resistance,HOMA- IR)=空腹血糖水平×空腹 胰島素水平/22.5;胰島素敏感指數(homeostatic model assessment of insulin sensitivity,HOMA- IS)=1/HOMA- IR。
1.4 檢測血生化指標及胰腺組織病理學觀察
干預大鼠24周后予10%水和氯醛腹腔注射麻醉,開胸經左心室采血10 ml,離心取血漿檢測生化指標。迅速分離胰腺,并在4%多聚甲醛溶液中保存固定24 h,經石蠟包埋,層厚3 μm連續切片,行蘇木精- 伊紅染色,觀察對照組及阿托伐他汀鈣組大鼠胰腺組織的組織形態學變化。
1.5 統計學處理
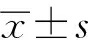
2 結 果
2.1 兩組大鼠體重及生化指標比較
與對照組比較,阿托伐他汀鈣組大鼠體重、甘油三酯(TG)明顯降低(P<0.05),谷氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、肌酐(Cr)有升高趨勢,而總膽固醇(TC)、低密度脂蛋白膽固醇(LDL- C)、高密度脂蛋白膽固醇(HDL- C)均有降低趨勢,但均無統計學意義。見表1。


組 別體重/gALT/IU·mL-1AST/IU·mL-1Cr/μmol·L-1對照組478.0±11.673.1±6.5177.7±11.757.9±4.0阿托伐他汀鈣組423.4±25.178.1±19.0204.9±51.773.7±23.8P值<0.0010.5250.1690.131組 別TC/mmol·L-1TG/mmol·L-1HDL-C/mmol·L-1LDL-C/mmol·L-1對照組3.08±0.421.72±0.180.53±0.061.99±0.42阿托伐他汀鈣組2.77±0.341.37±0.240.47±0.111.76±0.19P值0.1430.0060.2100.194
2.2 兩組口服葡萄糖耐量試驗比較
兩組間空腹血糖比較,差異無統計學意義,但30、60、90和120 min時阿托伐他汀鈣組的血糖明顯高于對照組(P<0.05)。見表2。
2.3 兩組胰島素釋放試驗比較
與對照組比較,阿托伐他汀鈣組空腹、30、60、90和120 min的胰島素分泌水平均明顯降低(P<0.05)。見表3。
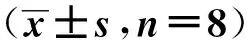
表2 兩組口服葡萄糖耐量試驗比較mmol·L-1
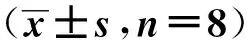
表3 兩組胰島素釋放試驗比較μIU·ml-1
2.4 兩組HOMA- β、HOMA- IR及HOMA- IS比較
與對照組相比,阿托伐他汀鈣組HOMA- β、HOMA- IR降低,而HOMA- IS升高,差異均有統計學意義(P<0.05)。見表4。
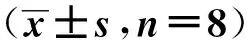

組 別HOMA-βHOMA-IRHOMA-IS對照組137.56±66.211.87±1.200.67±0.27阿托伐他汀鈣組63.96±40.870.89±0.321.27±0.52P值0.0180.0430.011
2.5 兩組胰腺組織病理學變化
與對照組比較,光鏡下阿托伐他汀鈣組胰腺組織形態學未見明顯變化,胰島細胞分布正常,核圓形,胞漿豐富,間質無水腫,無變性壞死。見圖1。
3 討 論
他汀類藥物廣泛應用于心血管和代謝性疾病的預防或治療,自JUPITER研究之后大量研究及薈萃分析證實了他汀類藥物致新發糖尿病發生風險增高,并且強化他汀治療比標準劑量更進一步增加新診斷糖尿病的風險[3- 7]。深入研究他汀類藥物誘發糖代謝異常的分子機制須借助有效的動物模型。本研究選用Wistar大鼠,在普通飲食基礎上采用大劑量阿托伐他汀鈣進行24周的長時程干預發現,雖然空腹血糖阿托伐他汀鈣組與對照組無差異,但口服葡萄糖耐量試驗結果顯示阿托伐他汀鈣組30、60、90和120 min血糖明顯升高,同時空腹和30、60、90、120 min血清胰島素水平阿托伐他汀組均低于對照組。大劑量阿托伐他汀鈣長時程干預后大鼠雖未達到臨床糖尿病的標準,但提示大鼠已經出現明顯的糖代謝異常,故成功建立了大劑量他汀干預誘發糖代謝異常大鼠的模型。

a.對照組;b.阿托伐他汀鈣組
圖1胰腺病理圖片HE×400
既往其他研究中心也已報道過采用不同的方法建立他汀類藥物誘發糖代謝異常的動物模型,但是均存在不同的缺陷。有研究先采用鏈脲佐菌素損傷胰腺功能后再給予阿托伐他汀鈣或普伐他汀6周短時程干預,導致糖耐量受損,但不影響胰島素分泌[11];采用小劑量阿托伐他汀鈣或普伐他汀干預3周,結果顯示阿托伐他汀鈣組胰島素敏感性降低,而普伐他汀并無此現象[12],提示不同的他汀在致糖代謝異常方面可能存在異質性。采用鏈脲佐菌素直接損傷胰腺β細胞,與2型糖尿病的發病機制并不完全相同;不同的他汀類藥物因分子結構、物理學特性、藥代學不同,所以作用存在異質性。阿托伐他汀鈣、瑞舒伐他汀鈣、辛伐他汀、洛伐他汀和氟伐他汀對患者的糖代謝影響較大,而普伐他汀和匹伐他汀的作用結果則不同[13- 14]。強化他汀治療可增加新發糖尿病的風險,但與用藥時間的長短密切相關,同時伴隨其他危險因素可能會發揮增強或抵消的作用。本研究選用臨床研究明確能夠增加新發糖尿病風險的阿托伐他汀鈣,參考之前動物研究[15],劑量采用50 mg·kg-1·d-1,相當于臨床80 mg·d-1的強化他汀治療,干預時間長達24周,且給予普通飲食,避免了高脂飲食本身對糖代謝的影響。本研究方案避免了既往研究的局限性,更接近人體服用阿托伐他汀鈣致糖代謝的異常病理生理過程。胰島素釋放試驗血清胰島素水平阿托伐他汀鈣組均低于對照組,而HOMA- β、HOMA- IR降低,HOMA- IS升高,提示他汀干預后胰島素敏感性增加,改善了胰島素抵抗,出現糖代謝異常的原因主要為他汀致胰島β細胞功能障礙所致,這也與臨床研究[16]的結論相符。但本研究動物模型未達到臨床糖尿病的診斷標準,所以光鏡下胰腺組織病理學未見明顯變化,而僅出現胰島β細胞功能改變。
本研究動物模型亦存在一定的不足:模型血糖升高水平未達到臨床糖尿病的診斷標準;干預時間還不足夠長,胰腺組織病理學未見明顯變化,未進行電鏡檢查,進一步觀察超微結構的變化;干預條件單一,與臨床上患者同時合并多種基礎疾病和危險因素有所不同。
總之,本研究采用大劑量阿托伐他汀鈣進行長時程干預,建立了阿托伐他汀鈣致糖代謝異常的大鼠模型,成功模擬人體服用阿托伐他汀鈣致糖代謝異常的病理生理過程,為深入研究他汀致糖代謝異常的分子機制提供可能性。

