ether-a-go-go相關基因通道在胰島β-細胞中的作用
趙苗妙 元沙沙 李 奇 盧 晶 黃海霞 楊金奎
(1.首都醫科大學附屬北京同仁醫院內分泌科,北京 100730;2. 糖尿病防治研究北京市重點實驗室, 北京 100730;3. 北京市糖尿病研究所,北京 100730;4. 首都醫科大學附屬北京潞河醫院內分泌科,北京 101149;5. 首都醫科大學基礎醫學院生理與病理生理學系,北京 100069;6. 首都醫科大學代謝紊亂相關心血管疾病北京市重點實驗室,北京 100069)
血糖濃度升高可以促進人和嚙齒動物胰島β-細胞分泌胰島素,傳統觀點認為其機制為葡萄糖進入β細胞后,經過三羧酸循環代謝,胞內ATP/ADP比值升高,阻斷了ATP敏感的K+通道(KATP),這個關鍵通道的關閉導致膜去極化,觸發了電壓依賴性Ca2+離子通道開放[1],Ca2+內流進入胞內,胞質Ca2+的上升觸發胰島素分泌[2]。在動作電位后期,胰島β-細胞膜上的電壓門控鉀離子通道(voltage-gated potassium channel, Kv)開放,向胞外排出K+,使細胞膜復極化,致使電壓依賴性Ca2+離子通道關閉,胰島素分泌停止[3-4]。可見,胰島素分泌量與胰島β-細胞的電活動密切相關,對離子通道的調控可調節胰島素的分泌。目前已大量應用于臨床治療糖尿病的磺脲類藥物的作用位點就是KATP通道的磺脲素類受體(sulfonylurea receptor, SUR)亞基[5-6],但是,直接抑制KATP電流的后果是產生不依賴血糖濃度的胰島素釋放,而這也導致了磺脲類藥物在臨床應用中的常見不良反應:低血糖。
胰島β-細胞有眾多電壓門控鉀離子通道(Kv),它們的激活依賴于KATP通道的關閉引起的細胞膜電位去極化,然而胰島β-細胞中的Kv的組成成分尚不清楚。本課題組的研究[7]顯示Kv家族中的ether-a-go-go相關基因(ether-a-go-gorelated gene,ERG)通道在糖尿病的發生中發揮了重要的作用。為揭示ERG對胰島素分泌的影響,本課題組在前期工作中構建了ERG全身基因敲除小鼠,發現血漿胰島素濃度增加。本文通過比較相同背景下的野生型及敲除型小鼠胰島β-細胞的電生理表型,以及小鼠體內糖耐量表型,探究ERG通道在胰島素分泌過程中的作用。
1 材料與方法
1.1 材料與試劑
RPMI-1640培養基(不含L-谷氨酸,不含丙酮酸鈉)、胎牛血清、青-鏈霉素均購自美國Gibco公司。記錄鉀離子電流的電極內液成分包括:KCl 130 mmol/L、NaCl 10 mmol/L、MgCl22 mmol/L、CaCl21.3 mmol/L、HEPES 10 mmol/L、EGTA 10 mmol/L、MgATP 1 mmol/L (用KOH調節pH值至7.3);電極外液成分包括:NaCl 125 mmol/L、KCl 10 mmol/L、MgCl22 mmol/L、CaCl22 mmol/L、HEPES 10 mmol/L、D-glucose 5.6 mmol/L (用NaOH調節pH值至7.4)。記錄動作電位的電極內液成分包括:KCl 138 mmol/L、NaCl 10 mmol/L、MgCl21 mmol/L、HEPES 10 mmol/L、EGTA 10 mmol/L、MgATP 1 mmol/L (用KOH調節pH值至7.3);電極外液成分包括:NaCl 130 mmol/L、KCl 5 mmol/L、MgCl21 mmol/L、CaCl22.5 mmol/L、HEPES 20 mmol/L、D-glucose 2.8 mmol/L (用NaOH調節pH值至7.4)。MgATP、EGTA、HEPES、D-glucose購自美國Sigma公司,膠原酶P購自美國羅氏公司,其余未特殊注明者為國產分析純試劑。
1.2 儀器與設備
EPC-10膜片鉗放大器購自德國HEKA公司;MP-285型三維操縱儀購自美國Sutter 公司;TE2000-U型倒置相差顯微鏡購自日本Nikon公司;Narishige Model PB-7電極拉制儀購自日本Narishige公司;BF150-110-10型玻璃微電極購自美國Sutter公司;Pulse8. 8數據采集軟件購自德國HEKA公司;Minianalysis V6.02數據轉換軟件,pCLAMP9.2數據分析軟件購自美國Axon公司;血糖儀及血糖試紙購自美國強生公司。
1.3 實驗方法
電生理實驗:頸脫臼法處死小鼠,經胰管注入500 U/mL膠原酶P溶液,37 ℃水浴消化25 min,在體視鏡下用口吸管分離胰島至完全培養基中過夜培養。第二天用胰蛋白酶溶液消化胰島至單個細胞,用培養基重懸后接種于多聚賴氨酸處理的35 mm培養皿中。鏡下通過細胞大小選取β-細胞,通過細胞電容值進行驗證[8]。膜片鉗實驗采用全細胞記錄模式。玻璃微電極在充灌電極內液后測得電極電阻2.5~5.0 MΩ,符合全細胞記錄使用條件。高阻封接成功后電阻1~2 GΩ。采用負壓吸引方式破膜,破膜后電阻500~600 MΩ。實驗均在室溫25~28℃條件下完成。
動物實驗:選擇5周齡,性別匹配的野生型(wild type, WT)與ERG基因敲除型(knockout, KO)小鼠,實驗前空腹8 h以上,經腹腔注射2 g/kg葡萄糖溶液,分別在空腹、注射后15、30、60、120 min經尾靜脈取血測量血糖值。
1.4 統計學方法
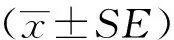
2 結果
2.1 ERG基因敲除鼠胰島β-細胞鉀離子電流減低
將胰島β-細胞膜電位鉗制在-70 mV、時長0.5 s,后予-70~+70 mV、時長0.5 s的系列去極化刺激,階躍為10 mV,最后恢復至靜息電位-70 mV,時長0.5 s,詳見圖1A。可觀察到隨電壓升高呈現先迅速升高后上升延緩的電壓依賴性鉀離子電流(Kv)的總和。各電壓下鉀離子電流的穩態值大小反映了該電壓下鉀離子通道開放的程度,結果顯示所記錄到的Kv電流具有弱的內向整流性特性。在該刺激條件下,KO組胰島β-細胞Kv電流較WT組Kv降低,詳見圖1B、C。為排除細胞大小對實驗的影響,分別以各電壓下Kv電流的密度pA/pF對測試電壓做I-V曲線,詳見圖2A。發現當測試電壓高于0 mV后,KO組電流較WT組有下降趨勢,0 mV: WT組為(34.88±5.263)pA/pF, KO組為(22.1±2.828)pA/pF(P=0.091 7);測試電壓達40 mV后,兩組電流幅度差異有統計學意義, WT組為(103.4±11.95)pA/pF, KO組為(65.94±9.04)pA/pF(P<0.05);70 mV: WT組為(138.1±17.68)pA/pF, KO組為(86.24±13.54)pA/pF(P<0.05),詳見圖2B、C、D。計算各測試電壓下KO組和WT組Kv電流幅度比值可知,ERG鉀通道電流約占全部Kv的37.8%。
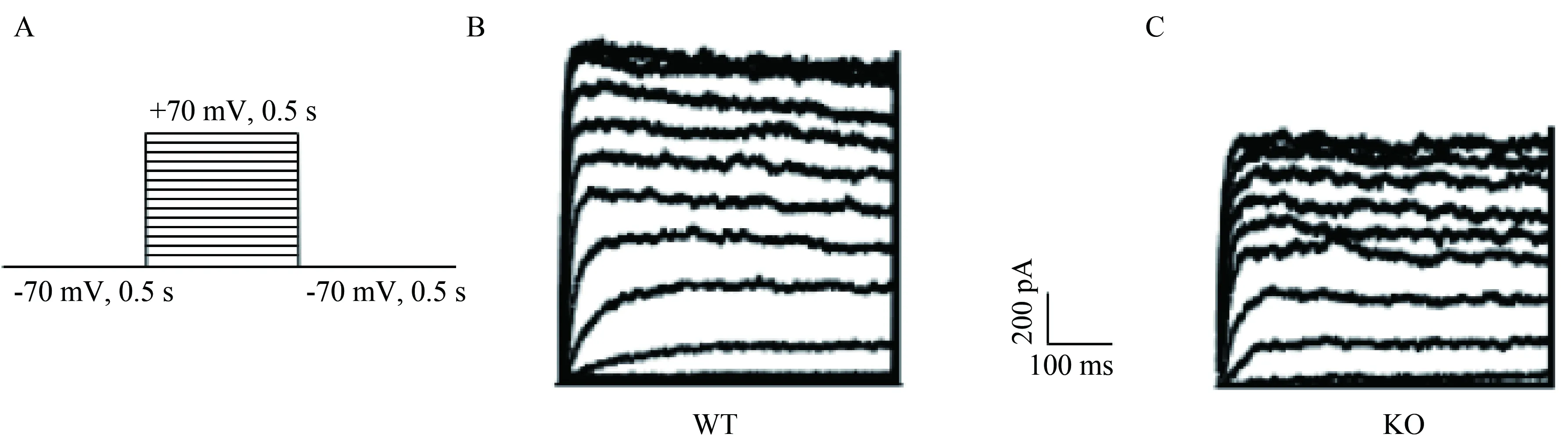
圖1 WT和KO兩組小鼠原代培養胰島β-細胞鉀離子電流的比較Fig.1 Comparison of potassium currents in primary cultured pancreatic β-cells between WT and KO
A: voltage clamp protocol;B: representative voltage-dependent K+(Kv) currents of WT;C: representative Kv currents of KO;WT: wild type;KO: knockout.
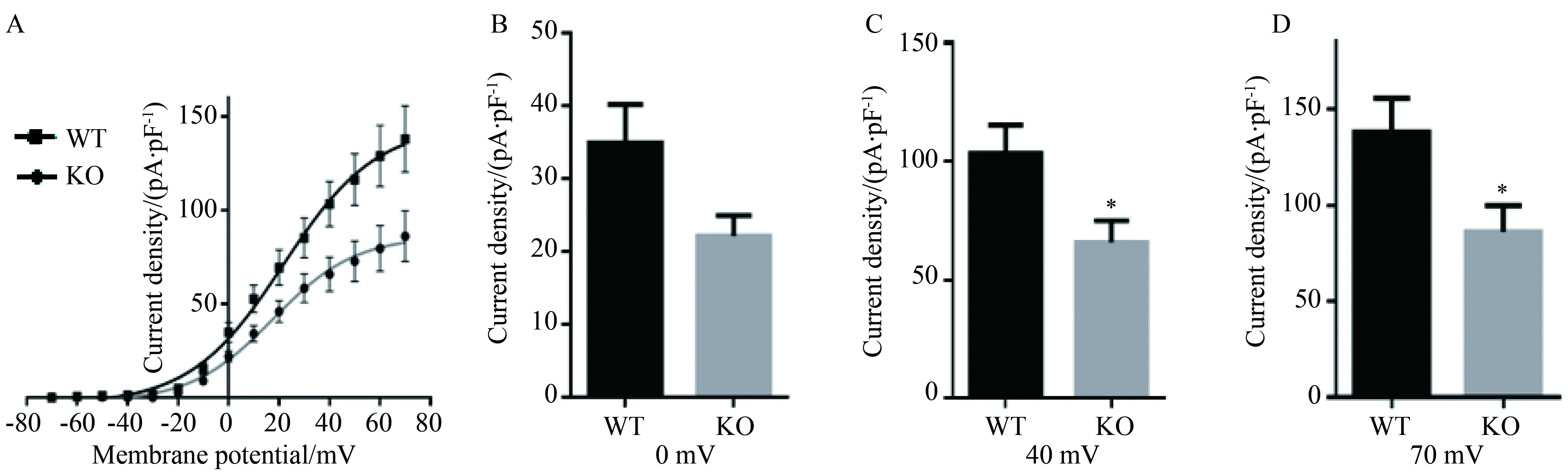
圖2 兩組小鼠胰島β-細胞鉀電流的I-V曲線及相關標化數據比較Fig.2 I-V curve and the normalized data of potassium currents in pancreatic β-cells in the two groups of mice
A: I-V curve of Kv currents of the two groups of mice (8 cells from 3 WT mice; 5 cells from 3 KO mice);B: summary of the mean current density of Kv channels at 0 mV;C: summary of the mean current density of Kv channels at +40 mV;D: summary of the mean current density of Kv channels at +70 mV;*P<0.05vsWT group;WT: wild type;KO: knockout.
2.2 ERG基因敲除鼠胰島β-細胞動作電位時程延長
記錄一過性動作電位,發現KO組動作電位時程較WT組延長,詳見圖3A。計算從電流刺激開始時間點到復極化至90%的時間點距離,作為動作電位時程90(action potential duration 90%,APD90)。KO組(13.96±0.31)ms APD90較WT組(9.50±0.61)ms明顯延長,但兩組靜息電位[(-60.50±2.47)mVvs(-61.00±2.27)mV]及動作電位幅度[(97.00±6.14)mVvs(91.74±6.20)mV]比較差異無統計學意義(P=0.848,0.610),詳見圖3B、C、D。
2.3 ERG基因敲除鼠腹腔注射葡萄糖耐量實驗血糖值更低
高糖刺激后,誘發胰島β-細胞產生動作電位,促使胰島素囊泡分泌。動作電位時程長短與胰島素分泌多少密切相關。筆者在小鼠體內進行腹腔注射葡萄糖耐量實驗,注射葡萄糖后60 min,KO組小鼠血糖較WT組小鼠血糖值降低,至注射后120 min時差異有統計學意義,WT組為(24.00±3.19)mmol/L, KO組為(13.26±4.04)mmol/L(P<0.05),詳見圖4。本結果證實了KO組小鼠擁有更好的糖耐量功能低。
圖3 兩組小鼠胰島β-細胞動作電位及相關標化數據的比較Fig.3 Action potential curve and the normalized data of potassium currents in pancreatic β-cells in the two groups of mice
A: action potential of mouse pancreatic β-cells;B: 90% of action potential duration of WT and KO (6 cells from 3 WT mice; 4 cells from 3 KO mice);C: action potentials magnitude of WT and KO;D: resting membrane potential of WT and KO;* *P<0.01vsWT group;WT: wild type;KO: knockout.
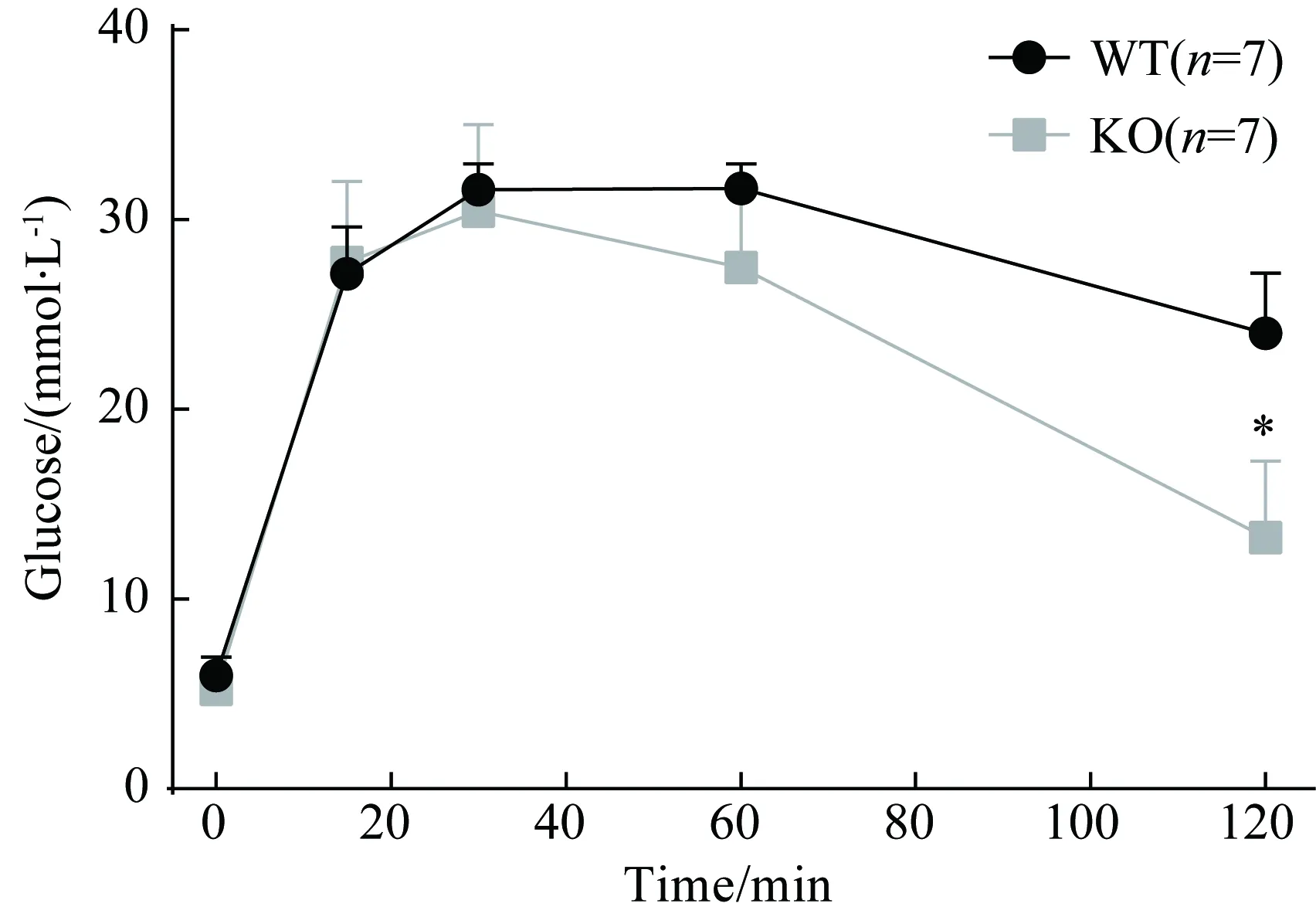
圖4 兩組小鼠胰島腹腔注射葡萄糖耐量實驗Fig.4 Intra-peritoneal glucose tolerant test in the two groups of mice.
*P<0.05vsWT group;WT: wild type;KO: knockout.
3 討論
本研究通過比較KO鼠與WT型小鼠胰島β-細胞電生理特性,證實了ERG敲除鼠電壓門控鉀離子電流顯著減低,說明ERG通道是組成Kv的重要離子通道成分,約占全部Kv的37.8%。電壓門控鉀離子電流在胰島β-細胞復極化過程中發揮主要作用,在電流鉗模式下,給予細胞500 pA,50 ms電流刺激[9],記錄一過性動作電位,發現KO鼠胰島β-細胞動作電位時程明顯延長,但靜息電位及動作電位幅度較WT組無明顯變化,說明ERG通道在調節動作電位時程中發揮重要作用,這同其在其他組織,如心肌細胞中,幫助細胞復極化的作用相一致[10-11]。最后,在腹腔注射葡萄糖耐量實驗中,KO鼠的血糖較WT組血糖降低,間接說明了KO組小鼠胰島素分泌水平更高,因而高糖刺激后,KO組血糖濃度較,電壓門控鉀離子電流在胰島β-細胞復極化過程中發揮主要作用,在電流鉗模式下,給予細胞500 pA,50 ms電流刺激[9],記錄一過性動作電位,發現這說明ERG通道通過影響胰島素分泌,而在調節血糖濃度中發揮了重要的作用。
ERG通道是可興奮細胞膜上內向整流鉀離子通道的重要組成部分,存在于心肌、胰腺、腸道等多種細胞當中,近期的研究[12]表明,ERG通道對于血糖的調節發揮了至關重要的作用,但是其確切的分子機制尚不得而知。本課題組的研究結果表明,β-細胞膜上的ERG通道可引起β-細胞動作電位時程的延長,進而增加胰島素的分泌量[13],這也同本研究中動物體內KO鼠的血糖濃度更低的結果相一致。
值得一提的是,ERG通道的開放發生于KATP通道關閉之后,而KATP的關閉依賴于體外血糖濃度的上升,由此可知,ERG通道的作用間接依賴于體外血糖濃度的上升。
迅速增多的糖尿病患者正在成為一個重要的健康問題,在中國影響了1.144億人,居全球第一[14]。伴隨著肥胖的發病率增加,2型糖尿病在未來很可能變得更加普遍。它嚴重影響生命質量并造成大量患者死亡,同時消耗了過多的公共衛生保健系統資源。經典磺脲類降糖藥的致低血糖不良反應使得臨床醫生在用藥時需要嚴格掌控劑量,而這也有賴于長年的臨床經驗積累。研發新型不產生低血糖風險的口服降糖藥的任務至關重要。而本研究的結果表明,ERG通道可作為一種新型的糖尿病治療靶點,抑制ERG通道鉀離子電流可產生依賴于血糖的降糖作用,不增加低血糖的風險。這為今后研發新型降糖藥物提供了分子機制基礎,也為將電壓門控鉀離子通道(Kv)作為降糖藥物靶點提供了依據,為新藥研發打開了新思路。
感謝首都醫科大學中心實驗室機能學研究平臺在膜片鉗實驗中給予的支持。

