自然發酵酸菜化學成分含量和微生物數量的動態變化及其相關性分析
韓宏嬌,叢 敏,李欣蔚,孔繁華,李瑋軒,梁肖娜,曹雪妍,岳喜慶
(沈陽農業大學食品學院,遼寧沈陽 110161)
酸菜是深受東北人民喜愛的一種傳統的發酵制品。經過發酵后的蔬菜制品,不僅營養價值提升,而且口味獨特。其濃郁酸香的口感得益于發酵過程中微生物代謝的復雜變化。在整個發酵過程中,發酵液中各項化學指標以及微生物數量的變化對酸菜發酵品質、風味和貯藏特性等起著至關重要的作用[1]。要實現酸菜由傳統自然發酵轉變為人工可調控發酵,必須準確掌握發酵過程中的微生物和化學成分的動態變化,這對于形成口感佳、風味好和質量高的產品尤為重要[2-4]。
目前,國內外對于自然發酵酸菜的研究主要是利用高新技術研究微生物區系的動態變化以及乳酸菌的分離和種類鑒定,人工接種發酵酸泡菜在發酵過程中的亞硝酸鹽含量變化和風味成分分析。而對自然發酵酸菜尤其是東北酸白菜及其發酵液的化學成分和微生物數量隨發酵時間的動態變化規律及相關性分析研究還鮮有報道。
本研究擬對東北地區自然發酵第0、3、6、9、12、15、18、21、24、27、30、35、40、50、60 d的酸菜及發酵液中的乳酸菌數、酵母菌數、大腸菌群數和細菌菌落總數、pH、總酸度、亞硝酸鹽含量、可溶性蛋白含量、還原糖含量和氨基酸態氮含量進行了系統分析,并研究各項化學成分含量和微生物數量之間的相關性,以期為酸菜發酵工藝的優化及工業化生產提供理論依據和參考。
1 材料與方法
1.1 材料與儀器
大白菜 沈陽農業大學農貿市場;乙酸鋅、亞鐵氰化鉀、對氨基苯磺酸、鹽酸萘乙二胺、亞硝酸鈉、酒石酸鉀鈉、亞硫酸鈉、3,5-二硝基苯磺酸、結晶酚、考馬斯亮藍G-250 分析純,鼎國生物技術有限公司。
ALC-210.2型電子天平 北京賽多利斯儀器系統有限公司;AL204分析天平 北京賽多利斯儀器系統有限公司;LDZX-50FBS全自動高壓蒸汽滅菌鍋 上海申安醫療器械廠;ZHJH-C1214C超凈工作臺 青島海爾特種電器有限公司;ZHJH-C1213C無菌操作臺 青島海爾特種電器有限公司;DNP型電熱恒溫培養箱 上海精宏實驗儀器設備有限公司;ND-2000型紫外分光光度計 北京中西科技遠大有限公司;DHG-9246A型電熱恒溫鼓風干燥箱 上海精宏實驗儀器設備有限公司;pHS-3C型精密pH計 上海理達儀器;5804R高速冷凍離心機 德國Eppendorf公司。
1.2 實驗方法
1.2.1 酸菜的腌制 采用中國東北地區酸菜腌制的傳統方法。挑選結實飽滿且成熟,無腐爛,無病蟲害的大白菜,將其在通風且陽光充足的室外晾曬數日后(曬蔫、殺菌、去除一定的水分),去除黃葉、老幫并清洗干凈,將整顆大白菜浸入沸水3 min左右后撈出,瀝干水分,整齊擺入5L的發酵罐中裝滿壓實并排出空氣,用質量分數為3.0%淡鹽水將發酵罐填滿密封,不添加任何發酵劑和調味料。用塑料布將發酵罐口扎緊,將酸菜發酵罐放置在溫度20~25 ℃,濕度40~65%且避光陰涼的環境中進行自然發酵,取0、3、6、9、12、15、18、21、24、27、30、35、40、50、60 d的酸菜及發酵液進行如下指標的測定。
1.2.2 化學成分指標的測定 pH:取酸菜發酵罐中多個位置的發酵液進行混合,校準pH計后,將電極浸沒在發酵液中直至數值穩定。連續測定三次取平均值作為最終結果;
總酸度[5]:參考GB/T 12456-2008《食品中總酸的測定》,取酸菜10.00 g研磨成勻漿,蒸餾水定容至100 mL,過濾備用,采用酸堿滴定法對發酵懸濁液進行測定;
亞硝酸鹽含量[6]:取酸菜500 g研磨成漿,參照GB 5009.33-2010《食品中亞硝酸鹽和硝酸鹽的測定》,制備酸菜樣品的亞硝酸鹽提取液,采用鹽酸萘乙二胺法對發酵懸濁液進行測定,以亞硝酸鈉含量為橫坐標,吸光度為縱坐標,繪制標準曲線,得回歸方程:y=0.0162x+0.0053,R2=0.9981,呈線性關系;
可溶性蛋白含量[7]:取酸菜2.00 g研磨成勻漿,與5 mL去離子水混合后在4 ℃,12000 r/min的條件下離心30 min,上清液即為酸菜可溶性蛋白提取液。參照GB 5009.5-2010《食品中蛋白質的測定》,采用考馬斯亮藍染色法對酸菜樣液進行測定,以蛋白質含量為橫坐標,吸光度值為縱坐標,繪制標準曲線,得回歸方程:y=0.0057x+0.0121,R2=0.9983,呈線性關系;
還原糖含量[8]:取酸菜1.00 g研磨成勻漿,定容至25 mL,80℃水浴30 min使還原糖充分溶出,過濾后定容至100 mL即為酸菜還原糖提取液。參照GB/T 5009.7-2008《食品中還原糖的測定》,采用3,5-二硝基水楊酸比色法對酸菜樣液進行測定,以葡萄糖含量為橫坐標,吸光度值為縱坐標,繪制標準曲線,得回歸方程:y=0.3074x-0.0012,R2=0.9992,呈線性關系;
氨基酸態氮含量[9]:甲醛滴定法,取酸菜樣品10 g,研磨成勻漿狀,去離子水定容至100 mL,搖勻后過濾,取濾液20 mL與60 mL蒸餾水混合。用0.05 mol/L的標準堿液調節溶液pH至8.2(V1)。再加入10 mL甲醛溶液,再調節pH至9.2(V2)。用去離子水(V0)作為空白對照,計算如下:
1.2.3 微生物指標的測定 采用純培養法,將發酵第0、3、6、9、12、15、18、21、24、27、30、35、40、50、60 d的發酵液用25 mL離心管收集,經過四層無菌紗布過濾后,取濾液作為研究對象進行微生物指標的測定。細菌菌落總數[10]:參照GB 4789.2-2010,釆用平板計數法測定細菌菌落總數;乳酸菌總數[11]:參照GB 4789.35-2010,釆用平板計數法測定乳酸菌數量;酵母菌數量[12]:參照GB 4789.15-2010,采用平板計數法測定酵母菌數量;大腸菌群數[13]:參照GB 4789.3-2010,采用平板計數法測定大腸菌群數量。
1.3 數據處理
用Excel和SPSS 17.0對試驗數據進行繪圖和統計分析。
2 結果與分析
2.1 酸菜自然發酵過程中pH的動態變化
pH是酸菜發酵過程中的重要指標。pH不僅會影響發酵環境中微生物的種類、數量和生長狀況,還會影響微生物的代謝途徑及其代謝產物的變化,進而影響發酵風味的形成[3]。
自然發酵酸菜pH隨發酵時間的動態變化如圖1所示。在發酵時間為0~35 d時,pH逐漸下降,從初始的6.42下降為3.64。在發酵時間為40~60 d時,pH在3.70左右保持平穩。Xiong等[14]認為,發酵初期乳酸菌的生長處于劣勢,發酵環境中產酸較少。隨著發酵時間的延長,乳酸菌在厭氧環境中利用大白菜中的還原糖發酵,產生大量的乳酸等酸性物質,使pH不斷下降[15]。在酸菜發酵40~60 d,pH變化較小。杜書[16]和馬歡歡等[17]研究表明,pH隨發酵時間的延長而下降,最終穩定在pH3左右,與本文結果類似。
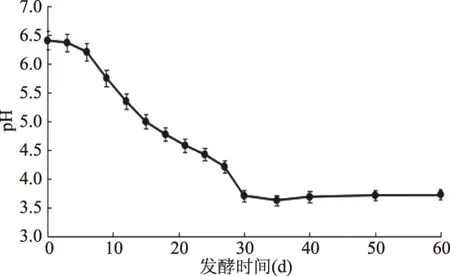
圖1 酸菜自然發酵過程中pH的動態變化Fig.1 Dynamic changes of pH during natural fermentation of sauerkraut
2.2 酸菜自然發酵過程中總酸含量的動態變化
如圖2所示,酸菜發酵環境中的總酸含量呈持續上升趨勢,在發酵時間為50 d時達到最大值6.68 g/kg,在發酵時間為50~60 d時基本保持穩定。Liu等[18]發現,乳酸菌在發酵蔬菜中的作用主要是形成酸性環境和抑制不耐酸有害菌的生長。且乳酸菌是發酵體系中的主體微生物[19]。因此,在酸菜腌制初期,發酵環境中以腸膜明串珠菌的異型發酵為主,產生的CO2、CH3COOH和CH3CH2OH導致發酵液的總酸含量升高[20]。由此創造的酸性環境促進部分抗酸乳酸菌的繁殖,產生大量乳酸,總酸含量持續增加。而在發酵時間為50 d之后,發酵環境中的碳源和氮源因被大量消耗而不足,乳酸菌數量趨于穩定,其產酸作用減弱并逐漸停止,發酵環境中總酸含量趨于穩定。乳酸菌發酵食品的酸味及風味受其總酸度的影響較大[21]。自然發酵酸菜中的適量酸有助于掩蓋白菜味,同時賦予制品獨特的風味。
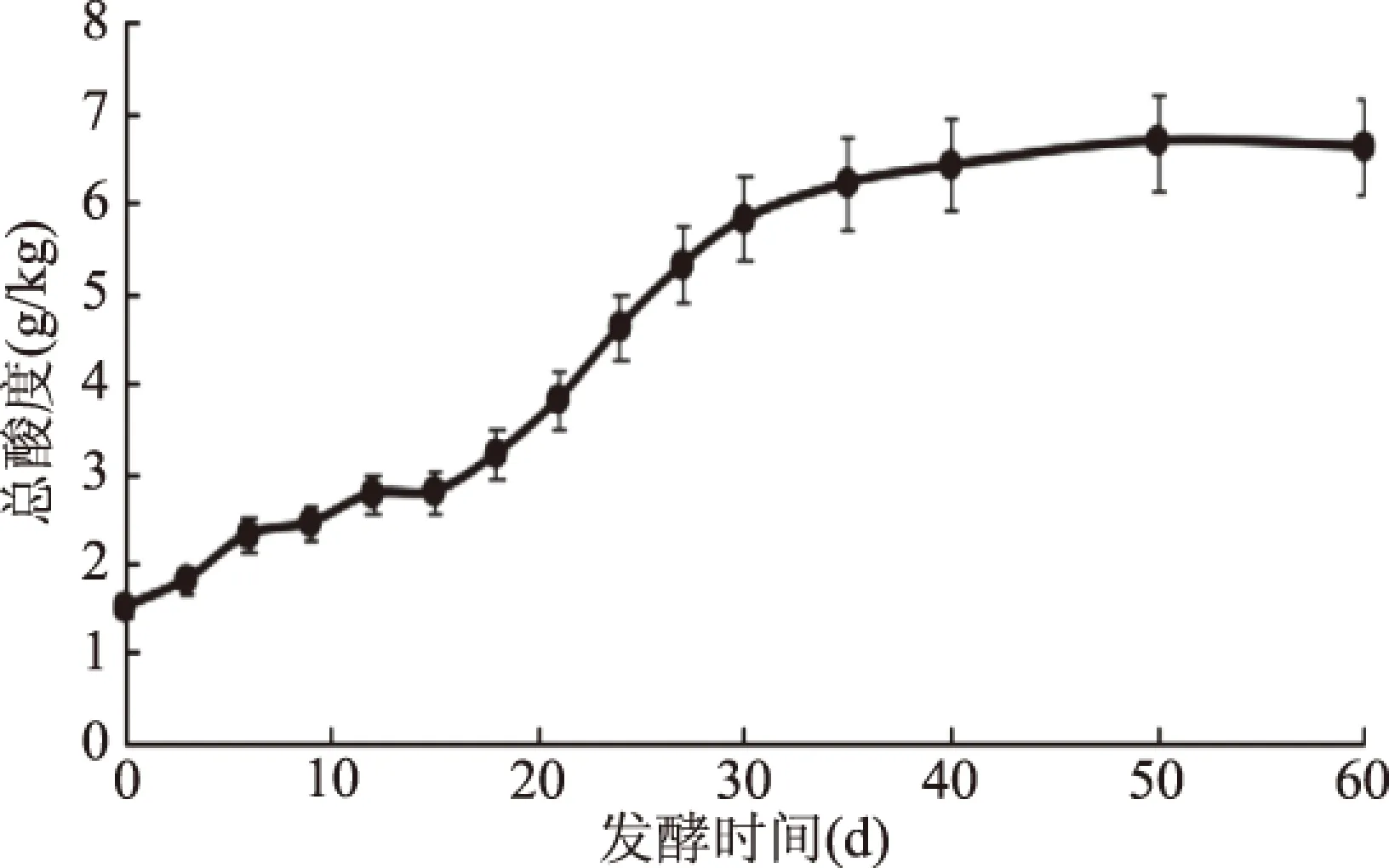
圖2 酸菜自然發酵過程中總酸含量的動態變化Fig.2 Dynamic changes of total acid content during natural fermentation of sauerkraut
2.3 酸菜自然發酵過程中亞硝酸鹽含量的動態變化
在腌制初期,發酵體系內酸度較低,蔬菜本身及發酵器具上攜帶的腸桿菌和黃桿菌屬等革蘭氏陰性菌會分泌硝酸還原酶,蔬菜中的大量硝酸鹽還原為亞硝酸鹽[22]。由圖3所示,酸菜的亞硝酸鹽含量在發酵時間為0~9 d時急劇增加,并在9 d時達到最大值69.76 mg/kg。何淑玲等[23]發現,硝酸還原酶產生作用的臨界點為pH5.0,且硝酸還原酶酶活性對亞硝酸鹽含量變化規律起主要作用。由圖3變化趨勢結合2.1 pH變化規律,亞硝酸鹽含量在發酵第15 d(pH4.99)后逐漸減小并趨于穩定,15 d之后降低到國家標準以下的水平,小于20 mg/kg。

圖3 酸菜自然發酵過程中亞硝酸鹽含量的動態變化Fig.3 Dynamic change of nitrite content during natural fermentation of sauerkraut
2.4 酸菜自然發酵過程中可溶性蛋白含量的動態變化
Do等[24]研究表明,LactobacillusdelbrueckiiUFV H2b20有編碼合成蛋白質水解酶和氨基肽酶的基因,從而提高蛋白質的降解速率和消耗速率。由圖4可知,在酸菜的自然發酵過程中,可溶性蛋白被分解為氨基酸和小肽等物質被微生物生長發育所利用,整體呈現下降趨勢,從發酵時間為0 d時的49.85 mg/100 g下降到60 d的1.34 mg/100 g,下降了約37倍。在40~60 d時,可溶性蛋白含量趨于穩定,蛋白質代謝產物也為酸菜特殊風味和口感的形成提供了保證。
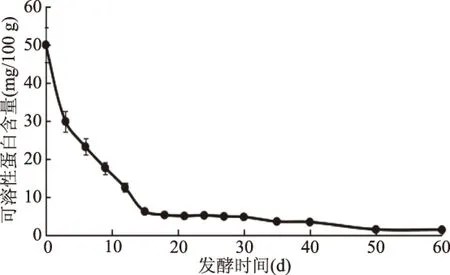
圖4 酸菜自然發酵過程中可溶性蛋白含量的動態變化Fig.4 Dynamic change of soluble protein during natural fermentation of sauerkraut
2.5 酸菜自然發酵過程中還原糖含量的動態變化
由圖5所示,發酵時間為0~9 d時,酸菜發酵體系中還原糖含量逐漸增大并達到最大值,分析原因可能是,隨著發酵時間的不斷延長和鹽水的滲透壓作用,導致大白菜本身的還原糖等營養物質不斷溶出,此時微生物對還原糖的分解速率小于還原糖的生成速率。Dodds等[25]對TS4乳酸桿菌的研究表明還原糖和NADH是發酵環境中酶的主要電子供體。同時,還原糖在發酵后期作為微生物生長繁殖的主要碳源被消耗,其含量逐漸減少并趨于穩定,因此在發酵時間為9~60 d時整體呈現下降趨勢。
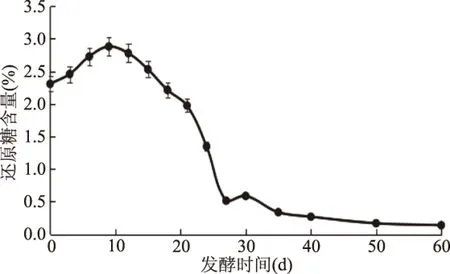
圖5 酸菜自然發酵過程中還原糖含量的動態變化Fig.5 Dynamic change of reducing sugar during natural fermentation of sauerkraut
2.6 酸菜自然發酵過程中氨基酸態氮含量的動態變化
微生物通過代謝活動產生蛋白酶,Lee等[26]研究發現,泡菜中的Lb.sakei能夠分解蛋白質產生大量的必需氨基酸和肽類物質。如圖6所示,酸菜發酵環境中氨基酸態氮含量在0~9 d逐漸增加,并在發酵時間為10 d時,達到最大值11.3 mg/100 g,這是由于初期微生物數量較少,且代謝活動較弱,因此酶解蛋白質作用較弱。在發酵時間為10~60 d時,整體呈現下降趨勢,可能是由于高酸性的發酵環境抑制中性和堿性蛋白酶的活性,同時微生物代謝活動趨于平穩,氨基酸態氮含量趨于穩定。
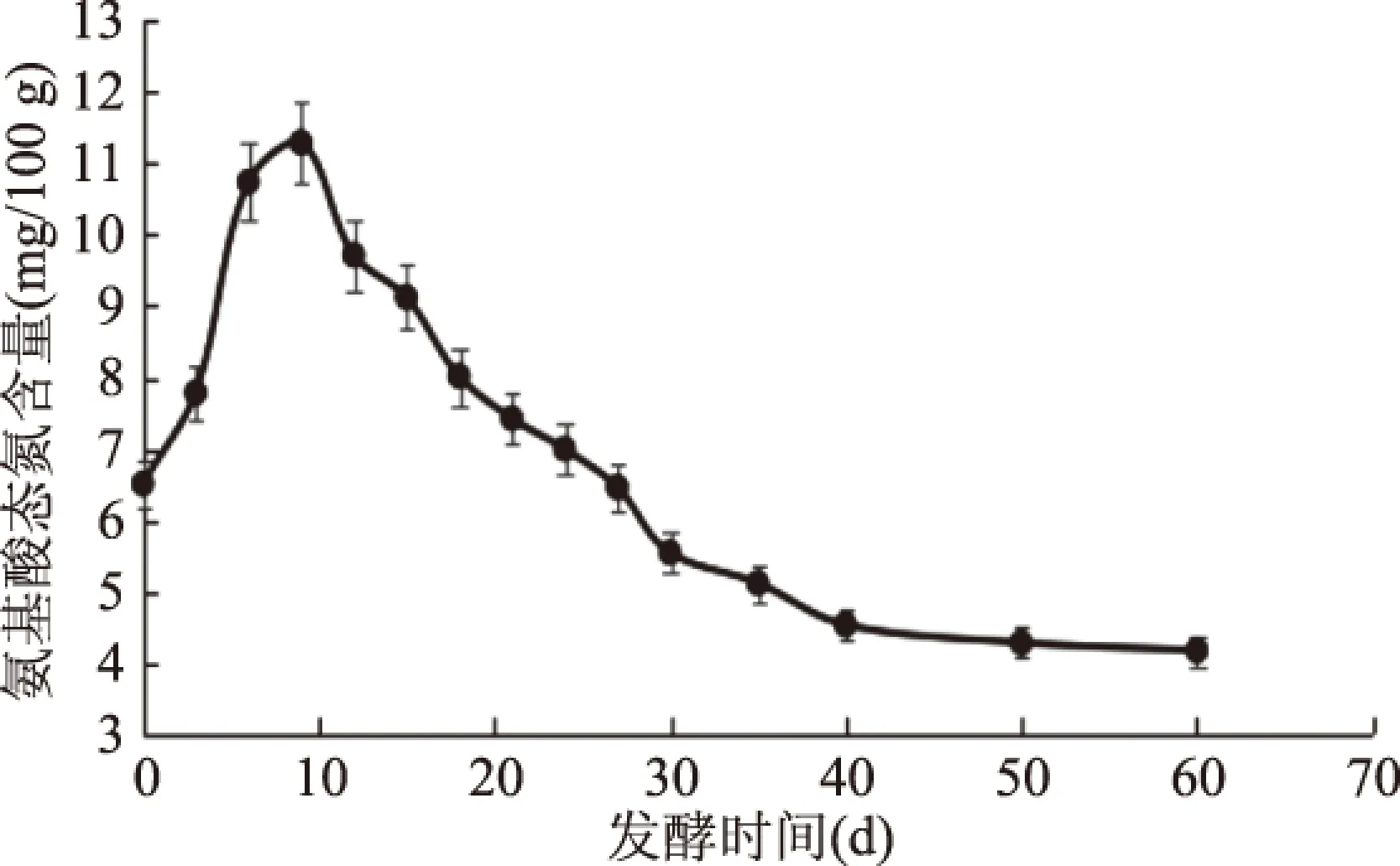
圖6 酸菜自然發酵過程中氨基酸態氮含量的動態變化Fig.6 Change of amino acid nitrogen during natural fermentation of sauerkraut
2.7 酸菜自然發酵過程中微生物數量的動態變化
如圖7所示,自然發酵酸菜中乳酸菌數量、酵母菌數量、大腸桿菌數量和細菌菌落總數的變化趨勢基本一致,細菌菌落總數、乳酸菌數量、酵母菌數量和大腸菌群數量均在發酵前期逐漸增加到峰值,出現峰值的時間分別為15、18、9、6 d,在發酵后期數量逐漸減少并趨于平穩的趨勢,其中酵母菌數量在發酵40~60 d時略有上升,而大腸菌群數量在發酵20 d后變為零。Xiong等[19]對發酵圓白菜的研究表明,發酵過程中的主體微生物為乳酸菌。如圖7所示在發酵第18 d時,乳酸菌數量到達峰值成為優勢菌群。隨后其數量開始減少,這是由于乳酸富集到1.1%~1.3%的濃度時,反而抑制了部分不耐酸乳酸菌的生長[16,27]。Mundt等[21]發現,甘藍發酵初期乳酸菌和細菌總數急劇上升,同時伴隨一定數量的霉菌和酵母菌,在發酵后期乳酸菌和細菌逐漸抑制其他雜菌,與本研究結果相符。分析原因認為,一方面隨著發酵時間的延長,乳酸菌生長并大量產酸,酸性和低氧的發酵環境抑制了酵母菌和大腸菌群的生長[28]。另一方面,發酵環境中微生物生長所需要的營養物質如碳源和氮源不足,使得發酵液中乳酸菌的數量逐漸減少。發酵環境中微生物的交替生長為酸菜產生獨特風味和提高貯藏品質提供了保證。

圖7 酸菜自然發酵過程中微生物數量的動態變化Fig.7 Dynamic changes of microbial quantity during natural fermentation of sauerkraut
2.8 酸菜自然發酵過程中微生物數量變化與化學成分含量變化的相關性分析
將酸菜自然發酵過程中化學成分含量與各類微生物數量進行相關性分析,結果如表1所示。乳酸菌數與pH、大腸菌群數及可溶性蛋白含量呈極顯著負相關(p<0.01),相關系數分別為-0.801、-0.697和-0.811。酵母菌數與亞硝酸鹽含量、還原糖含量及氨基酸態氮含量呈極顯著正相關(p<0.01),相關系數分別為0.934、0.811和0.874。大腸菌群數與pH、還原糖含量、可溶性蛋白含量及氨基酸態氮含量呈極顯著正相關(p<0.01),與總酸含量呈極顯著負相關(p<0.01),相關系數分別為0.869、0.830、0.665、0.813和-0.765。而細菌菌落總數與氨基酸態氮含量呈顯著正相關(p<0.05)。pH與還原糖含量、可溶性蛋白含量和氨基酸態氮含量呈極顯著正相關(p<0.01),與總酸含量呈極顯著負相關(p<0.01),相關系數分別為0.858、0.851、0.773和-0.962。總酸含量與還原糖含量、可溶性蛋白含量和氨基酸態氮含量呈極顯著負相關(p<0.01),相關系數分別為-0.948、-0.742和-0.818。
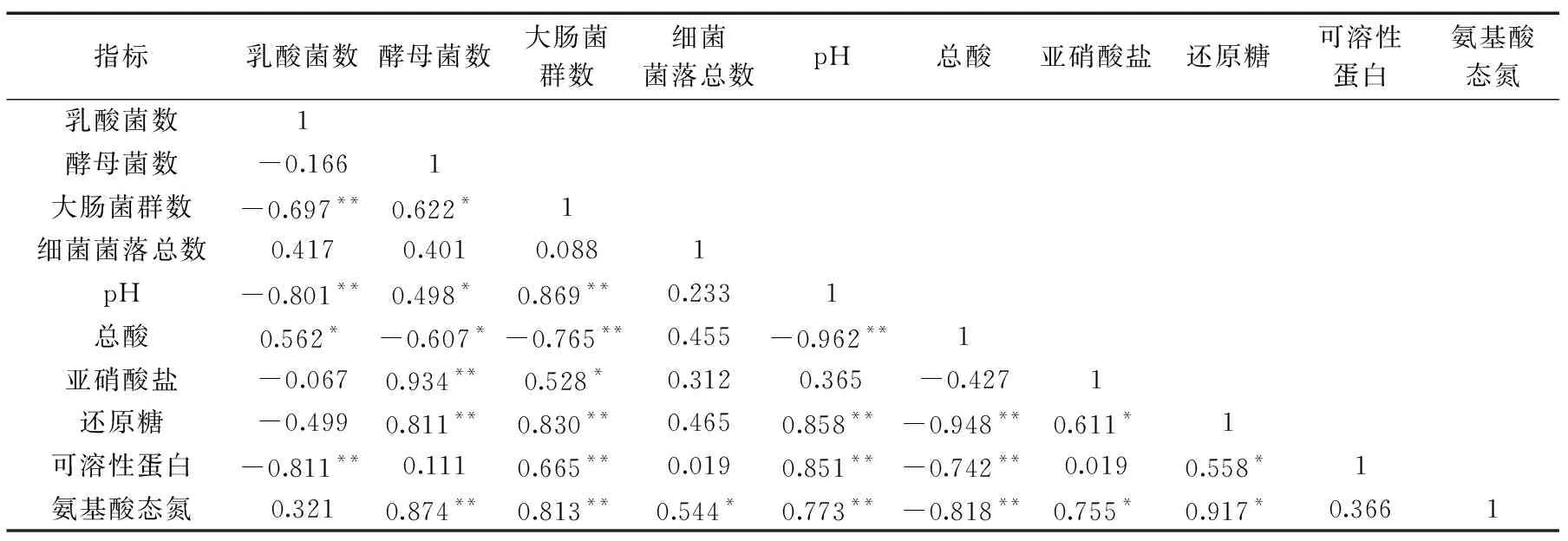
表1 酸菜自然發酵過程中微生物數量變化與化學成分變化的相關性分析Table 1 Correlation Analysis of the changes of chemical composition and microbial quantity in the process of sauerkraut fermentation
3 討論
3.1 酸菜自然發酵過程中微生物數量與化學成分的動態變化
酸菜中乳酸發酵是主要的發酵類型,同時也有少量的乙醇發酵過程和微量的醋酸發酵過程[28]。此外,自然發酵酸菜的總酸含量隨發酵時間的延長呈現上升趨勢,pH隨發酵時間的延長呈現下降趨勢,因此,酸菜會呈現獨特的酸味。在發酵過程中,發酵液中乳酸菌數量呈現先增加后逐漸減小并保持穩定的趨勢,細菌菌落總數和大腸菌群數在發酵前期略有增加,之后逐漸減少,其中大腸菌群數在發酵20 d后數量變為零。酵母菌數量呈現先增加后降低在略上升的趨勢。這些微生物數量的變化顯著影響著發酵液中營養物質還原糖、可溶性蛋白和氨基酸態氮含量的變化,可溶性蛋白含量隨著發酵時間的延長呈現不斷下降的趨勢,而還原糖和氨基酸態氮含量隨著發酵時間的延長則略有上升后下降。在發酵過程中,亞硝酸鹽含量的變化趨勢為先增加后下降,最終在一定范圍內波動并保持穩定,且發酵21 d后的酸菜產品已經符合國家標準。
3.2 酸菜自然發酵過程中微生物數量與化學成分含量之間的關系
酸菜發酵環境中的乳酸菌數與pH及可溶性蛋白含量極顯著負相關(p<0.01)。Liu等[29]研究表明Lb.Plantarum能夠合成蛋白水解酶基因的前體物質,可水解發酵體系中的蛋白質產生氨基酸。因此可溶性蛋白為乳酸菌的生長提供氮源。乳酸菌是發酵過程的優勢微生物和產酸的主要微生物[19],且發酵體系中的酸度直接影響pH的變化。同時還發現,乳酸菌對大腸桿菌數量的消長規律有極顯著影響且呈反向相關關系,這與楊麗等[30]的研究結果一致。
酵母菌數量與氨基酸態氮含量的相互關系與Beltran等[31]和Vilanova等[32]的研究結果相似,可同化氮是酵母菌生長的必需營養物質,其含量變化的消長規律與酵母菌數量保持同步。酵母菌數量與酸菜發酵體系中的還原糖具有極顯著的正相關關系,可能是由于發酵環境中的其他營養物質限制了酵母菌對還原糖的消耗速率,也可能是酵母菌發酵需要一定濃度的還原糖存在。國內外均有研究表明,發酵蔬菜中亞硝酸鹽的產生是由于腸桿細菌和黃桿菌屬分泌的硝酸還原酶作用[22-33]。但亞硝酸鹽含量與酵母菌數量呈極顯著正相關的作用機理尚無定論,有待在后續研究中開展。
相關性分析發現大腸菌群的生長受到發酵體系中多種因素的影響,pH、還原糖含量、可溶性蛋白含量、氨基酸態氮含量及總酸含量對大腸菌群數的影響極顯著。其中可溶性蛋白和氨基酸態氮作為發酵體系中的主要氮源促進大腸桿菌的生長發育。程立坤等[34]證明了葡萄糖濃度對大腸桿菌TRJTH0709的菌體生物量、菌體比生長速率等具有顯著影響,與本文結果一致。但是pH及總酸含量與大腸菌群的關系與楊麗等[30]的研究存在一定的差異,這可能與發酵過程中是否添加調味料以及發酵液的鹽濃度有關。
比較細菌菌落總數與其他指標的變化發現,細菌菌落數量僅與氨基酸態氮含量有顯著的正向相關關系。因此,除乳酸菌外,氨基酸態氮含量是發酵酸菜中其他微生物生長的關鍵因子。
4 結論
東北酸菜自然發酵過程中的氨基酸態氮含量是影響發酵體系內微生物生長的主要營養物質。隨發酵時間的延長,pH和可溶性蛋白的含量下降,總酸含量上升,還原糖、亞硝酸鹽和氨基酸態氮含量均先增加后減小。細菌菌落總數、大腸菌群數和乳酸菌數量先增加后減少,大腸菌群數最后為零。酵母菌數量先增加后降低,最后略有上升。發酵體系中化學成分含量和微生物數量相關性顯著(p<0.05)。乳酸菌則受到大腸桿菌和可溶性蛋白含的極顯著影響(p<0.01)。而大腸菌群數則受諸多化學成分含量的影響,在發酵20 d后數量變為零。酵母菌數量極顯著地影響還原糖、氨基酸態氮和亞硝酸的含量(p<0.01),其與亞硝酸鹽的關系可以進一步研究,為解決發酵蔬菜中亞硝酸鹽的積累問題提供理論依據。

