槲皮素誘導腫瘤細胞P53非依賴的G2/M周期阻滯和凋亡
王梓萱,周 靜,唐 玥,石 歡,黃曉薇,鄧敬桓,胡曉曉,陳攀紅,李忠杰,戴惠淇,馮 吉,Sayantan CHATTERJEE,盧國棟
(廣西醫科大學1.公共衛生學院衛生毒理學教研室,3.基礎醫學院生理學教研室,4.國際教育學院,廣西南寧 530021;2.廣西高校高發疾病預防與控制研究重點實驗室,廣西南寧 530021)
細胞凋亡是指為維持內環境穩定,由基因控制的細胞自主有序的死亡,機體通過細胞增殖和凋亡維持動態平衡,一旦平衡被打破則會引發一系列疾病,如腫瘤[1]。流行病學資料表明,世界范圍內惡性腫瘤總體發病率呈現持續升高趨勢,腫瘤已成為全球主要死因[2]。誘導細胞凋亡是藥物執行抗腫瘤效應的主要作用方式之一[3],P53蛋白的失活使細胞無法感知刺激細胞凋亡的DNA損傷,突變型p53不僅失去了其抗腫瘤轉錄活性,而且還促進腫瘤增殖侵襲,以及提高耐藥性等促癌功能[4]。尋找可作用于p53突變或缺失的腫瘤、且靶點明確以及毒副作用少的新分子意義深遠。
槲皮素(quercetin)是一種天然存在的多酚類黃酮[5],具有抗炎、抗氧化等生物活性和藥理作用[6]。已知它在腫瘤細胞中介導內在(線粒體)和外在(Fas/FasL)凋亡性細胞死亡[7],通過調節FoXo3a活性誘導細胞周期阻滯[8],對順鉑誘導的線粒體功能障礙具有改善作用[9]。然而槲皮素對腫瘤細胞的作用機制尚未闡明,尤其是槲皮素對于p53突變或缺失的腫瘤細胞的作用尚缺乏詳細而系統的闡述,因此,本實驗以體外腫瘤細胞為研究對象(其中Hep3B和MDA-MB-231細胞缺乏正常功能的p53),探討槲皮素對具有不同狀態p53的腫瘤細胞增殖和凋亡的影響,以期為槲皮素應用于不同腫瘤的臨床治療提供實驗依據。
1 材料與方法
1.1 細胞
人肝癌HepG2和Hep3B(自然狀態下p53缺失)細胞購自中國科學院上海細胞生物學研究所細胞庫,人乳腺癌MDA-MB-231(自然狀態下p53突變)細胞來源于美國模式培養物集存庫(ATCC),人結直腸癌細胞HCT116p53野生型(HCT116 p53WT)和p53敲除型(HCT116 p53KO)由約翰霍普金斯大學Dr.Vogelstein惠贈。
1.2 試劑和儀器
槲皮素(質量分數>95%,貨號Q4951)(美國Sigma公司);DMEM培養基(貨號C11995500BT)和胎牛血清(貨號10099141,美國Life Sciences公司);二甲亞砜(DMSO,貨號:0219605580,美國MP Biomedicals公司);甲基噻唑基四唑(methyl?thiazolyldiphenyl-tetrazolium bromide,MTT,貨號:C0009,上海碧云天生物技術有限公司)、碘化丙啶(propidium iodide,PI,貨號:P4170)、辣根過氧化酶(horseradish peroxidase,HRP)標記α-微管蛋白單克隆小鼠抗體(貨號:T-5168)和Hoechst33258(貨號:94403,美國Sigma公司);HRP標記胱天蛋白酶3單克隆小鼠抗體(貨號:9668S)、HRP標記聚ADP核糖聚合酶〔poly(ADP-ribose)polymerase,PARP〕單克隆兔抗體(貨號:9532)、山羊抗兔IgG二抗(貨號:7074)、山羊抗小鼠IgG二抗(貨號:7076,美國Cell Signaling Technology公司);HRP標記P53單克隆小鼠抗體(貨號:sc-126,美國Santa Cruz公司);細胞生物安全柜、細胞培養箱、MuLTI?SKAN GO型全自動酶標儀(美國Thermo公司);FluorChem HD2凝膠成像系統(美國Proteinsimple公司);倒置顯微鏡(日本Olympus公司);cence TDZ5-WS離心機(湘儀離心機儀器有限公司);FB124電子分析天平(上海舜宇恒平科學儀器有限公司)。
1.3 細胞培養
選取腫瘤細胞于DMEM高糖培養基或MEM培養基(含10%胎牛血清)37℃,5%CO2及飽和濕度的細胞培養箱中培養,2~3 d傳代1次,取對數生長期的細胞實驗。
1.4 光學顯微鏡觀察細胞形態
將處于對數生長期的細胞以17×104L-1細胞接種于6孔板,分成5組處理,分別為空白對照組(只加培養液)、槲皮素12.5,25,50和100 μmol·L-1處理組,24 h后于倒置光學顯微鏡下觀察細胞形態的改變。
1.5 MTT法檢測細胞存活
取對數生長期的細胞,調整每孔細胞密度為6×103(100 μL),接種于96孔板中,設空白對照組(加入等體積細胞培養液)、細胞對照組(未加槲皮素)和實驗組(加入槲皮素12.5~100 μmol·L-1),每組5復孔,分別培養24 h,每孔加入10 μL MTT,繼續孵育2 h后棄去孔內液體,加入100 μL DMSO,37℃孵育10 min,使用酶標儀檢測490 nm處吸光度(A490nm)值,實驗重復3次,計算細胞增殖抑制率。細胞存活率(%)=(實驗組A490nm-空白組A490nm)/(細胞對照組A490nm-空白組A490nm)×100%
1.6 流式細胞術檢測細胞周期和凋亡
制備細胞懸液,調整細胞數為17×104L-1,加入6孔板內,每孔2 mL。貼壁后加入不同濃度的槲皮素(12.5,25,50和100 μmol·L-1),同時設置細胞對照組(未加槲皮素),將藥物處理24 h的細胞收集培養液,PBS 0.01 mol·L-1清洗 1 次,加入 0.3 mL 0.25%胰蛋白酶消化3 min,終止消化后收集至15 mL離心管中,1171×g離心5 min,棄去上清液;用PBS 0.01 mol·L-1500 μL重懸細胞,在混勻機上加入4℃預冷的75%乙醇4.5 mL固定細胞,-20℃過夜,加入RNase A和PI后37℃水浴避光孵育30 min,上機檢測,實驗重復3次。
1.7 Hoechst33258染色檢測細胞凋亡
制備細胞懸液,調整細胞數為17×104L-1,加入6孔板內,每孔2 mL。待細胞貼壁后加入不同濃度的槲皮素(12.5,25,50和100 μmol·L-1),同時設置細胞對照組(未加槲皮素),處理24 h后終止培養,用PBS 0.01 mol·L-1漂洗3次,每孔加入0.9 mL培養液和Hoechst33258工作液100 μmol·L-1100 μL,室溫染色30~45 min,熒光顯微鏡觀察。
1.8 Western印跡法檢測胱天蛋白酶3、活化的胱天蛋白酶3、PARP和活化的PARP蛋白表達水平
制備細胞懸液,調整細胞數為26×104L-1,加入60 mm培養皿,每孔4 mL。貼壁后加入不同濃度的槲皮素(12.5,25和50 μmol·L-1),同時設置細胞對照組(未加槲皮素),處理24 h后終止培養,收集細胞,并加入SDS裂解緩沖液于冰上裂解15 min。BCA法測定蛋白濃度并配平至濃度體積一致的樣品,上樣量30 μg,電泳后轉膜至 0.2 μm PVDF膜。封閉液封閉1 h,孵育一抗4℃過夜,一抗濃度分別為胱天蛋白酶3(1∶1000)、PARP(1∶5000)、α-微管蛋白(1∶5000)和P53蛋白(1∶5000)。洗膜后加 HRP標記的對應的二抗(1∶5000),室溫搖床孵育1 h,TBST 0.01 mol·L-1洗膜后用ECL顯影,以目標蛋白與內參蛋白積分吸光度比值表示蛋白的相對表達。
1.9 統計學分析
2 結果
2.1 槲皮素對多種腫瘤細胞形態的影響
光學顯微鏡下觀察,細胞對照組細胞貼壁良好,大小均一,形態規則,生長旺盛。隨著槲皮素濃度的增加,24 h后腫瘤細胞出現細胞體積縮小,連接消失,細胞變圓,生長遲緩,細胞空泡化,部分細胞脫落(圖1)。
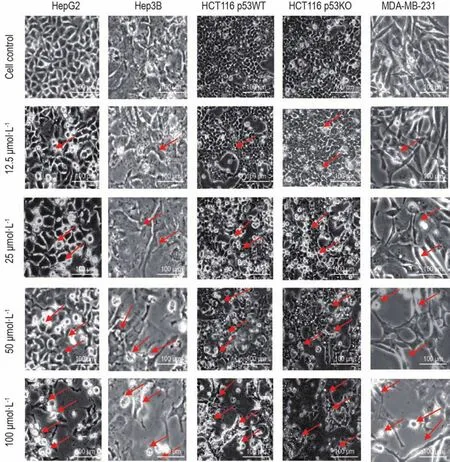
Fig.1 Effect of quercetin on cancer cell morphology.The cells were treated with quercetin 12.5-100 μmol·L-1for 24 h.Arrows show typical morphological changes,where cells beceme oblate or even vacuolated.
2.2 槲皮素對多種腫瘤細胞存活的影響
MTT結果顯示,槲皮素對腫瘤細胞的存活率呈濃度(rHepG2=0.972,P<0.01;rHep3B=0.959,P<0.01;rMDA-MB-231=0.979,P<0.01;rHCT116p53WT=0.983,P<0.01;rHCT116p53KO=0.980,P<0.01圖2A)和時間(rHepG2=0.974,P<0.01;rHep3B=0.956,P<0.01;rMDA-MB-231=0.959,P<0.01;rHCT116p53WT=0.971,P<0.01;rHCT116p53KO=0.988,P<0.01圖2B)依賴性。槲皮素作用48 h對腫瘤細胞HepG2,Hep3B,MDA-MB-231,HCT116 p53WT和HCT116 p53KO細胞存活的IC50分別為61.51,70.23,73.65,50.75 和 47.86 μmol·L-1。表明槲皮素隨濃度的增加和作用時間的延長,對腫瘤細胞的殺傷作用愈明顯。
2.3 槲皮素對HCT116 p53WT和HCT116 p53KO細胞周期和凋亡的影響
HCT16 p53WT細胞中有P53蛋白表達,而在HCT116 p53KO細胞中無P53蛋白表達,說明敲除成功(圖3A)。Hoechst33258染色結果表明(圖3B),HCT116 p53KO和HCT116 p53WT細胞中,細胞對照組均可見均質、淡藍色的熒光,少見或未見明顯的核染色質改變,槲皮素50 μmol·L-1作用細胞24 h后,細胞均出現核染色質固縮、碎裂和溶解等典型的凋亡現象,在加入泛胱天蛋白酶抑制劑Z-VAD-FMK后,逆轉了核染色質的改變。流式細胞術分析細胞周期結果(圖3C,表1)顯示,2種細胞生長狀態良好,而不同濃度的槲皮素處理后的HCT116 p53WT細胞其周期和凋亡率發生改變。主要表現為在低濃度(0~25 μmol·L-1)作用下,G0/G1期細胞減少,G2/M期細胞增多(P<0.01);在高濃度(50~100 μmol·L-1)作用下,槲皮素對腫瘤細胞的主要作用表現為顯著促進凋亡(P<0.01)。相應濃度的槲皮素作用于HCT116 p53KO細胞后也有類似變化。

Fig.2 Effect of quercetin on cell viability of different cancer cells by MTT assay.A:the cells were treated with dif?ferent concentrations of quercetin for 24 h;B:the cells were treated with quercetin 50 μmol·L-1for the indicated time.±s,n=3.
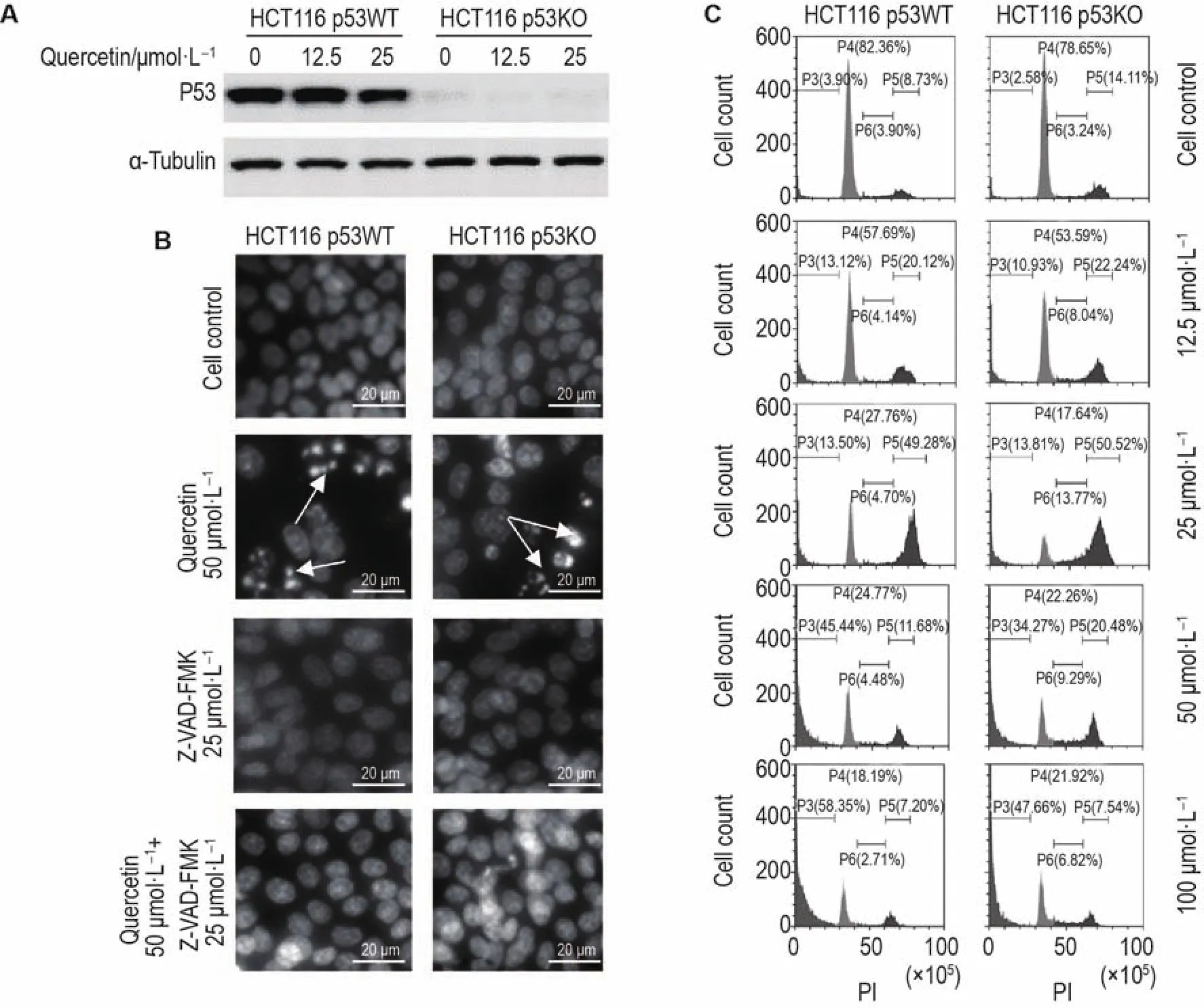
Fig.3 Effect of quercetin on cell cycle and apoptosis of cancer cells.A:the knockout effect of p53 was verified;B:cells were treated with indicated concentrations of quercetin for 24 h in the absence or presence of Z-VAD-FMK while Hoechst33258 stain?ing for nuclear chromatin changes;C:cells were treated with quercetin for 24 h,followed by incubation with PI for 30 min,the cell cycle phase distribution as described.Data was analyzed by Modfit software in Tab.1.
2.4 槲皮素對HCT116 p53WT和HCT116 p53KO細胞胱天蛋白酶3、活化的胱天蛋白酶3、PARP和活化的PARP蛋白表達的影響
Western印跡檢測結果顯示(圖4A),與細胞對照組相比,隨著槲皮素濃度升高,HCT116 p53WT和HCT116 p53KO細胞胱天蛋白酶3顯著下降(P<0.05,P<0.01),活化的胱天蛋白酶3無顯著變化;PARP明顯降低(P<0.01),活化的PARP明顯增多(P<0.01),提示PARP被切割發生活化(圖4A2和4B2)。與細胞對照組比較,槲皮素50 μmol·L-1處理的HCT116 p53WT和HCT116 p53KO細胞,胱天蛋白酶3明顯下降(P<0.01),活化的胱天蛋白酶3無顯著變化,PARP 顯著降低(P<0.01),活化的PARP增加(P<0.01)。與同濃度槲皮素(50 μmol·L-1)單獨作用相比,聯合泛胱天蛋白酶抑制劑Z-VADFMK作用細胞24 h,顯著抑制槲皮素誘導的細胞死亡,并逆轉了胱天蛋白酶3、PARP和活化的PARP蛋白的改變(P<0.05,P<0.01,P<0.05)(圖4A3和4B3)。
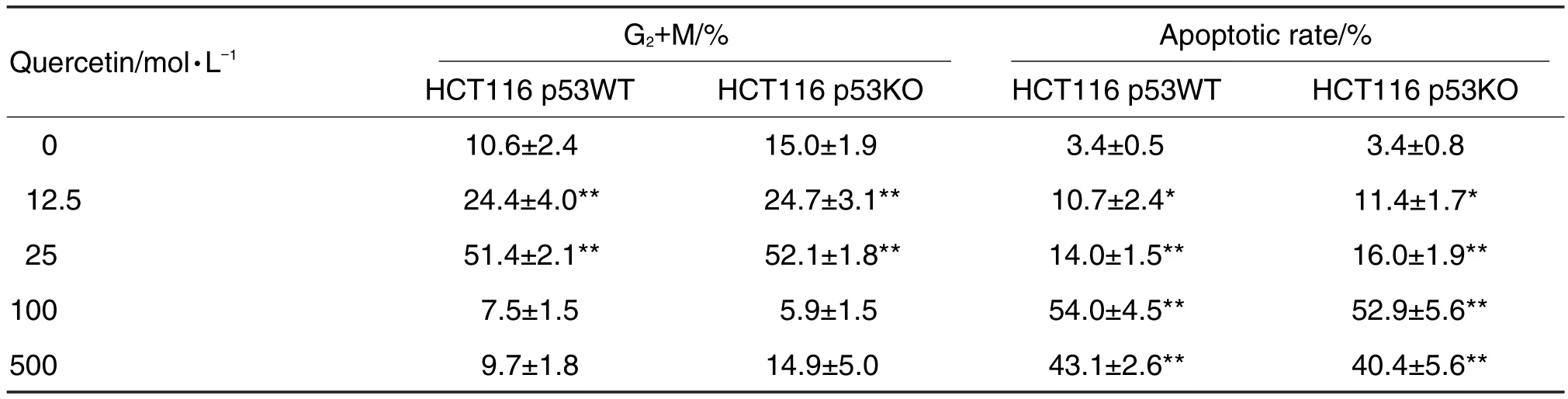
Tab.1 Effect of quercetin on cell cycle and apoptotic rate of HCT116 p53WT and HCT116 p53KO cells
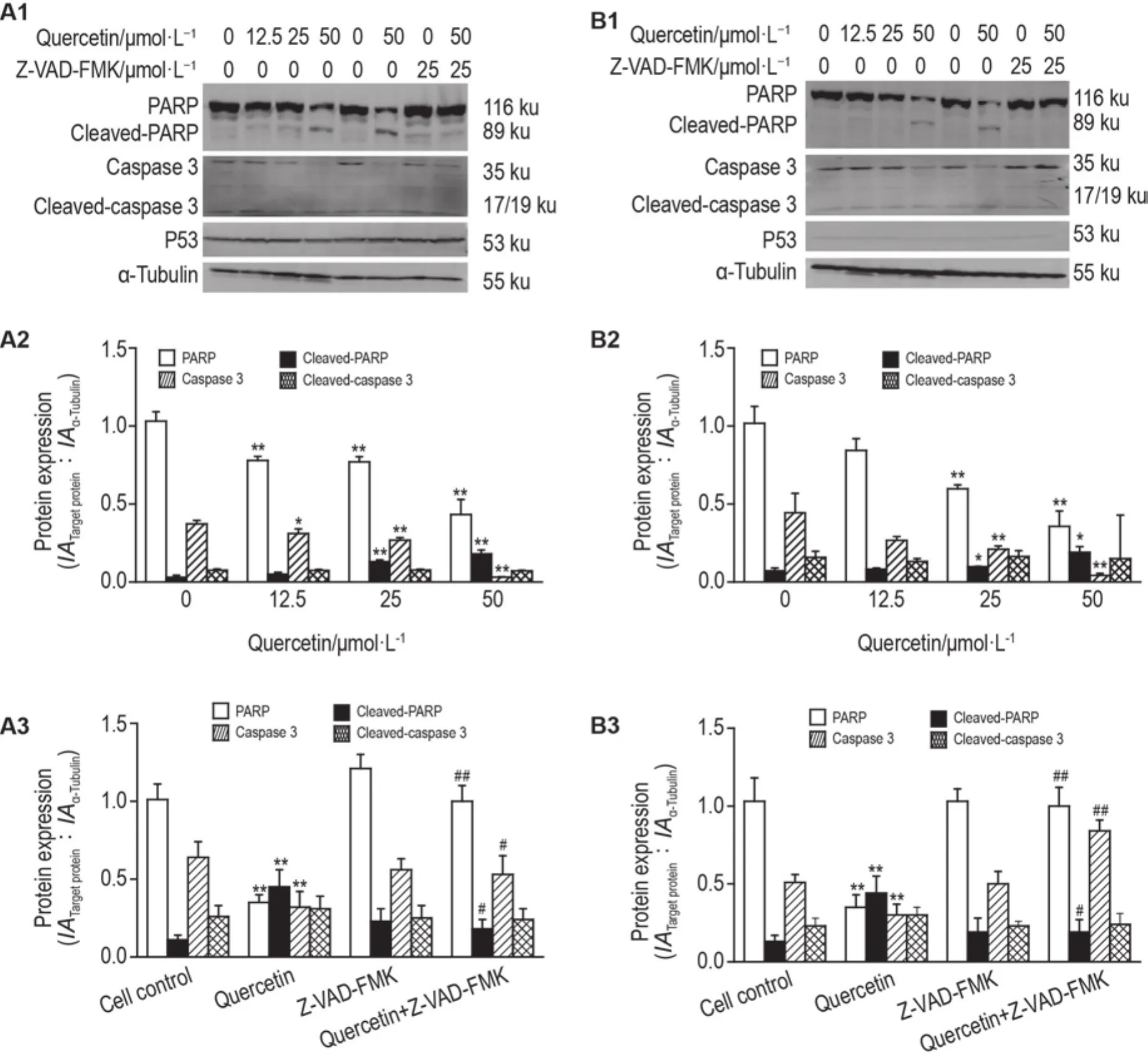
Fig.4 Effect of quercetin on expressions of poly(ADP-ribose)polymerase(PARP),cleaved-PARP,caspase 3 and cleaved-caspase 3 protein in HCT116 p53WT(A1,A2,A3)and HCT116 p53KO(B1,B2,B3)cells by Western blotting.The cells were pretreated with Z-VAD-FMK 25 μmol·L-1for 1 h,followed by treatment with quercetin 50 μmol·L-1for another 24 h.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with quercetin 50 μmol·L-1group.
3 討論
本研究發現,槲皮素處理腫瘤細胞24 h后細胞表現形態扁圓,胞膜皺縮等明顯變化,細胞存活率明顯下降。流式分析提示,槲皮素在低濃度下細胞周期阻滯于G2/M期,在高濃度下細胞凋亡率顯著升高。提示槲皮素對腫瘤細胞有一定的細胞毒作用,且這種毒性作用可能通過激活細胞凋亡通路實現。
胱天蛋白酶3是細胞凋亡通路的關鍵酶,作為執行者之一激活下游級聯反應誘導凋亡[10]。PARP作為細胞凋亡核心成員胱天蛋白酶的底物,它在DNA損傷修復與細胞凋亡中發揮著重要作用[11]。本研究結果表明,隨槲皮素濃度的增加,胱天蛋白酶3表達水平顯著降低,活化的胱天蛋白酶3無明顯變化,提示胱天蛋白酶3被激活,PARP被切割部分明顯增加。在加入泛胱天蛋白酶抑制劑后,反轉了胱天蛋白酶3和PARP蛋白表達水平的改變。結合流式分析和Hoechst33258染色結果推測,槲皮素可誘導腫瘤細胞凋亡,且該促凋亡作用是胱天蛋白酶依賴的而非P53依賴的。Ong等[12]在鼻咽癌細胞HK1和CNE2中發現,槲皮素通過P53非依賴的線粒體誘導途徑細胞凋亡。而Gong等[13]發現,槲皮素聯合輻射作用加重乳腺癌細胞OV2008和A2780的DNA損傷并引起典型的凋亡效應,而在敲除p53后幾乎逆轉了此類聯合反應,提示槲皮素的輻射增敏性依賴于P53。不同腫瘤細胞中P53作用的差異性可能受細胞來源的影響,今后將對其分子作用機制做進一步的探討。

