檸檬桉內生真菌的分離及其提取物的抗細菌活性
單體江 馮皓 謝銀燕 邵陳 王軍 毛子翎


摘要 :采用組織塊分離法分離檸檬桉中的內生真菌,通過菌落觀察和分子生物學相結合的方法對分離到的內生真菌進行鑒定;進一步采用薄層層析生物自顯影法測定了檸檬桉內生真菌次生代謝產物的抗細菌活性。從檸檬桉中共分離鑒定得到10株內生真菌,主要分布于附球菌屬Epicoccum、鐮刀菌屬Fusarium、炭疽菌屬Colletotrichum、Rhytidhysteron、半殼霉屬 Leptostroma、Campylocarpon、Neofusicoccum、白腐菌屬Phlebia和Dinemasporium等9個屬中。抗細菌活性的測定結果表明,內生真菌Ecf?4(Rhytidhysteron sp.,MK211261)和Ecf?1(Epicoccum sp.,MK211258)表現出最強的抑菌活性,兩菌對桉樹青枯病菌的抑菌斑最大直徑均大于10 mm; 依據其Rf值的范圍和抑菌斑的最大直徑,內生真菌Ecf?4的抗菌活性高于Ecf?1,表現出更強的抗細菌活性,可作為候選菌株,進一步分離和鑒定其中的活性成分。
關鍵詞 :檸檬桉;?內生真菌;?次生代謝產物;?抗細菌活性
中圖分類號:
S 763.1
文獻標識碼:?A
DOI:?10.16688/j.zwbh.2018497
Endophytic fungi isolated from Eucalyptus citriodora Hook. f. and the
antibacterial activity of their crude extracts
SHAN Tijiang,?FENG Hao,?XIE Yinyan,?SHAO Chen,?WANG Jun,?MAO Ziling
(Guangdong Provincial Key Laboratory for Innovative Development and Utilization of Forest Plant Germplasm, College
of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou?510642, China)
Abstract
The tissue block separation method was used for the isolation of endophytic fungi in Eucalyptus citriodora. Colony observation associated with molecular assay was performed to identify the endophytic fungi isolated from E.citriodora. The antibacterial activities of the crude extracts produced by endophytic fungi were determined by thin layer chromatography?bioautography assay. Ten strains in total were identified from E.citriodora. The endophytic fungi mainly belonged to nine different genera, including Epicoccum, Fusarium, Colletotrichum, Rhytidhysteron, Leptostroma, Campylocarpon, Neofusicoccum, Phlebia and Dinemasporium. Endophytic fungi Ecf?4 (Rhytidhysteron sp., MK211261) and Ecf?1 (Epicoccum sp., MK211258) displayed the strongest antibacterial activities, and the maximum diameter of the inhibition zones against Ralstonia solanacearum was greater than 10 mm. According to the range of Rf value and the maximum diameter of inhibition zones, the antibacterial activity of endophytic fungi Ecf?4 was stronger than that of Ecf?1. Endophytic fungus Ecf?4 exhibited the strongest antibacterial activity, which could be used as a candidate strain for further isolation and identification of the active components.
Key words
Eucalyptus citriodora;?endophytic fungi;?secondary metabolites;?antibacterial activity
桉樹Eucalyptus spp.是桃金娘科Myrtaceae桉樹屬Eucalyptus植物的總稱,天然分布于大洋洲的澳大利亞大陸以及華萊士線以東各島嶼,是目前世界重要的三大速生經濟樹種之一[12]。桉樹是我國林業史上引種最為成功的樹種之一,至今已有超過120年的歷史,具有重要的經濟價值、社會價值和生態價值[24]。近年來隨著桉樹無性系栽培數量的不斷增多以及人工林面積的不斷擴大,桉樹病蟲害的發生也越來越嚴重[5],其中桉樹青枯病是發病面積最大的病害,目前已成為災難性的流行病[6]。桉樹青枯病的病原是茄勞爾氏菌Ralstonia solanacearum (Smith) Yabuuchi,是一種系統性的維管束病害,也是危害桉樹生產的一種毀滅性病害,被稱為桉樹的“絕癥”[7]。目前該病害已在華南地區普遍發生,成為當前桉樹林發展的重大障礙,嚴重威脅著桉樹產業的可持續發展[8]。
植物內生真菌能夠產生多種結構新穎的次生代謝產物,具有抗細菌、抗真菌、抗氧化、抗腫瘤以及促進植物生長和提高植物抗病性等多種生物活性,是一種新型的天然活性物質資源寶庫,從植物內生真菌中尋找具有開發潛能的生物活性物質是近年來的研究熱點[911]。而目前對于檸檬桉和桉樹內生真菌及其次生代謝產物的報道較少,Kharwar等[12]從檸檬桉中分離得到的曲霉屬和毛殼菌屬內生真菌表現出較強的抗真菌和抗細菌活性,且抗真菌活性要強于抗細菌活性。格希格圖等[13]從不同桉樹根部分離到的內生真菌對桉樹青枯病菌有不同程度的拮抗作用,其中以大葉桉內生真菌的抗菌活性最為顯著。近年來,內生真菌在誘導宿主抗病性方面的研究也越來越受到人們的重視,
能否利用檸檬桉內生真菌及其次生代謝產物來預防和控制桉樹青枯病值得進一步研究和探討。本研究以健康的檸檬桉枝條為研究對象,分離和鑒定其內生真菌,通過大米固體發酵制備其次生代謝產物,并測定次生代謝產物對7種供試細菌的抑制活性,從中篩選出活性菌株,為后續桉樹青枯病的防治以及檸檬桉內生真菌資源的綜合開發和利用奠定基礎。
1?材料與方法
1.1?植物材料
健康的檸檬桉枝條(兩年生)采自廣州市天河區華南農業大學樹木園。標本的鑒定由華南農業大學林學與風景園林學院鄭明軒老師完成。
1.2?儀器與試劑
LRH系列生化培養箱(上海一恒科學儀器有限公司);DSX?280KB30手提式壓力蒸汽滅菌器(上海申安醫療器械廠); SW?CJ?2G型超凈工作臺(蘇州凈化設備有限公司);旋轉蒸發器OSB?2100(東京理化器械株式會社);SHZ?D3循環水式多用真空泵(廣州市臻勝儀器設備有限公司); HQ45恒溫搖床(中國科學院武漢科學儀器廠);ZF?2型三用紫外儀(上海安亭電子儀器廠);JA2003N分析天平(上海精密科學儀器有限公司)。
真菌DNA提取試劑盒(生工生物工程(上海)股份有限公司);GF254薄層層析硅膠(青島海洋化工廠);硫酸鏈霉素(美國Sigma公司,99%);噻唑藍(MTT)生物顯色劑(美國Amresco公司);羧甲基纖維素鈉(國藥集團化學試劑有限公司);石油醚、乙酸乙酯、丙酮、甲醇、二氯甲烷等均為國產分析純(天津富宇精細化工廠)。
1.3?內生真菌的分離、純化和保存
內生真菌的分離采用Shan等[14]的方法。將檸檬桉枝條用清水洗凈,先用75%乙醇處理30 s后,再用0.2%升汞處理20 min,最后用無菌水沖洗3次,每次5 min,以確保殘余的乙醇和升汞清洗干凈。將表面消毒后的檸檬桉枝條置于無菌濾紙上晾干后,用解剖刀去除表皮并切割成約0.5 cm大小的塊段,放置在含500 μg/mL硫酸鏈霉素的PDA平板上(d = 90 mm),3塊/皿,28℃下暗培養,待內生真菌長出后從每個菌落的邊緣挑取一小段菌絲接種到新的PDA培養基上,連續純化多次,直至獲得純培養的菌株。純化后的菌株于4℃保存,備用。
1.4?內生真菌的鑒定
采用形態學和分子生物學相結合的方法對分離到的內生真菌進行鑒定,形態學的鑒定主要是觀察、記錄菌落形態并拍照,在光學顯微鏡下觀察菌絲形態特征和產孢情況。分子生物學鑒定采用宋慧云等[15]的方法。通過PDB液體發酵獲得內生真菌菌絲,用液氮將菌絲充分研磨至粉末狀,采用試劑盒法提取內生真菌DNA,采用真菌的通用引物ITS4(5′?TCCTCCGCTTATTGATATGC?3′)和ITS5(5′?GGAAGTAAAAGTCGTAACAAGG?3′)擴增其ITS序列,PCR反應體系為:2×Taq PCR MasterMix(含染料)25 μL,10 μmol/L ITS 4 和 ITS 5 各1 μL,10 ng/μL模板 DNA 3 μL,雙蒸水補足到 50 μL。PCR擴增程序:先在94℃下預變性3 min,然后94℃變性30 s,52℃退火30 s,72℃延伸1 min,共30個循環;最后72℃延伸8 min, 4℃ 保存。ITS序列的拼接采用DNAMAN 軟件,采用最大似然法用MEGA 7.0.26軟件構建系統發育樹,將最終的鑒定結果和所得的 rDNA?ITS 序列提交到 GenBank 數據庫,獲得內生真菌菌株的登錄號。
1.5?檸檬桉內生真菌次生代謝產物的制備
內生真菌次生代謝產物的制備參照單體江等[16]的方法,發酵培養基為大米固體培養基,培養溫度為28℃,培養時間為60 d。采用溶劑冷浸提取法提取內生真菌的次生代謝產物,所用溶劑為乙酸乙酯和丙酮(1∶1),冷浸提取3次,每次7 d,將提取液減壓濃縮后即得到其次生代謝產物,4℃保存備用。
1.6?抗細菌活性的測定
采用TLC?MTT?生物自顯影法測定內生真菌提取物對不同供試細菌的抑制活性[17]。供試細菌包括4種革蘭氏陰性菌和3種革蘭氏陽性菌,4種革蘭氏陰性菌分別為桉樹青枯病菌Ralstonia solanacearum、黃瓜角斑病菌Pseudomonas lachrymans、大腸桿菌Escherichia coli和番茄瘡痂病菌Xanthomonas vesicatoria;3種革蘭氏陽性菌分別為溶血葡萄球菌Staphylococcus haemolyticus、金黃色葡萄球菌Staphylococcus aureus和枯草芽胞桿菌Bacillus subtilis。通過抑菌斑的遷移率(即Rf值)來初步評價樣品中抗菌化合物的極性,根據抑菌斑的大小來初步評價化合物的活性。Rf值計算公式如下:
Rf值=斑點與點樣處之間的距離展開劑前沿與點樣處之間的距離。
2?結果與分析
2.1?檸檬桉內生真菌的分離和純化
采用組織塊分離法從檸檬桉中分離內生真菌,共分離出內生真菌25株,通過菌落形態觀察初步合并相同的菌株,最終分離得到10株形態各異的檸檬桉內生真菌,分別命名為Ecf?1~ Ecf?10,其菌落形態如圖1所示。檸檬桉內生真菌菌落大多為規則圓形,氣生菌絲發達,多為白色,其中Ecf?4為灰色;Ecf?6邊緣新長出菌絲為白色,后期變為黃棕色;除Ecf?4外,其他內生真菌生長迅速,7 d左右即可長滿培養皿(直徑7.5 cm)。通過光學生物顯微鏡觀察發現,從檸檬桉枝條中分離到的所有內生真菌的菌絲均為有隔菌絲,但多數內生真菌未見產孢,通過形態學很難進行準確鑒定,因此采用分子生物學方法對篩選出的檸檬桉內生真菌進行進一步鑒定。
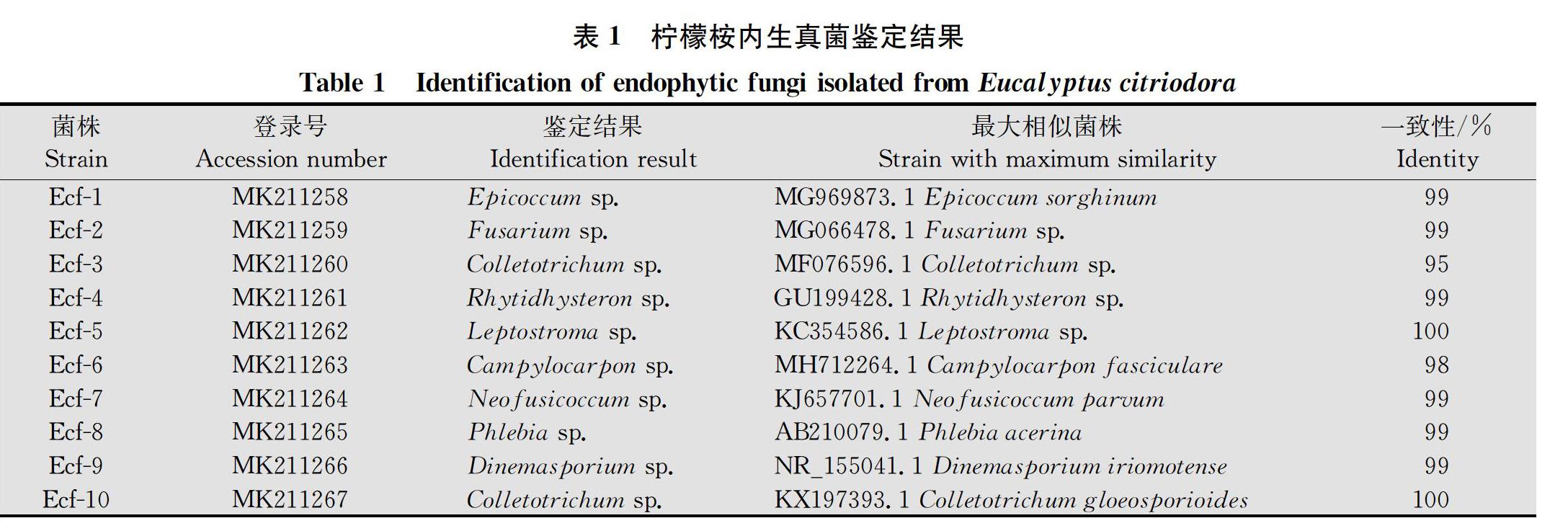
通過PCR擴增、測序后,使用DNAMAN軟件進行拼接,將拼接完整的ITS序列提交至GenBank,獲得其登錄號,并采用最大似然法構建系統發育樹(圖2),結合菌落形態和顯微觀察以及構建的系統發育樹,檸檬桉內生真菌最終鑒定結果如表1所示。從檸檬桉中共鑒定出10株不同的內生真菌,主要分布于附球菌屬Epicoccum、鐮刀菌屬Fusarium、炭疽菌屬Colletotrichum、Rhytidhysteron、半殼霉屬Leptostroma、Campylocarpon、Neofusicoccum、白腐菌屬Phlebia和Dinemasporium等9個不同的屬中。其中Ecf?3和Ecf?10屬于炭疽菌屬,但從系統樹可以看出,Ecf?3和Ecf?10并沒有聚類在同一枝上,說明Ecf?3和Ecf?10分屬于炭疽菌屬的不同種。
2.2?檸檬桉內生真菌次生代謝產物的抗細菌活性
檸檬桉內生真菌次生代謝產物對桉樹青枯病菌和另外6種供試細菌的抑制活性如表2所示。結果表明,所有內生真菌次生代謝產物對桉樹青枯病菌均表現出一定的抑制活性,但不同內生真菌的活性強弱存在一定差異。綜合抑菌斑的Rf值和最大直徑,結果發現內生真菌Ecf?4對桉樹青枯病菌表現出最強的抑制活性,其次是內生真菌Ecf?1和Ecf?5,三者抑菌斑的最大直徑均大于10 mm。內生真菌Ecf?4的Rf值為0.0~0.74,Rf值主要與化合物的極性有關,Rf值越大,說明化合物的極性越小;此外,Rf值的范圍與抗菌化合物的數量有關,Rf值的范圍越大,說明抗菌化合物的數量越多,通過Rf值可以看出內生真菌Ecf?4含有的抗菌活性化合物最多,且化合物的極性為中等偏大。內生真菌Ecf?2、Ecf?6和Ecf?9對桉樹青枯病菌也表現出一定的抑制活性,抑菌斑的最大直徑在5~10 mm;其余菌株表現出微弱的抑制活性,抑菌斑的最大直徑均小于5 mm,Rf值的范圍也更小。
通過對其他供試細菌的抑制活性測定結果可以看出,不同內生真菌次生代謝產物對革蘭氏陰性菌和陽性菌的抑制活性存在一定的差異,對革蘭氏陰性細菌的活性要明顯強于革蘭氏陽性細菌,僅有3株內生真菌的次生代謝產物對溶血葡萄球菌表現出抑制活性。其中內生真菌Ecf?4、Ecf?1和Ecf?6對6種供試細菌均表現出抑制活性,依據其Rf值的范圍和抑菌斑的最大直徑可以發現,內生真菌Ecf?4的抗菌活性明顯強于Ecf?1和Ecf?6。Ecf?2、Ecf?5、Ecf?9和Ecf?10對除溶血葡萄球菌之外的5種細菌表現出抑制活性,特別說明的是內生真菌Ecf?2對這5種細菌表現出較強的抑制活性,抑菌斑的最大直徑均大于10 mm,Rf值的范圍甚至大于內生真菌Ecf?4。內生真菌Ecf?3和Ecf?8僅對3種供試細菌表現出抑制活性,Ecf?7的抑制活性最弱,僅對番茄瘡痂病菌和大腸桿菌表現出抑制活性,且抑菌斑的最大直徑均小于5 mm。綜上所述,內生真菌Ecf?4對桉樹青枯病菌和其他供試細菌表現出最強的抑制活性,其次是菌株Ecf?1,內生真菌Ecf?4和Ecf?1可作為進一步開發抗菌活性物質的候選菌株。
3?討論
內生真菌廣泛存在于植物的各個部位,但不同植物以及同一植物不同部位內生真菌的種類和數量均存在較大差異[18]。內生真菌的種類還與植株的生長年齡、所處季節以及組織和器官的相對位置等因素有關[19]。本研究從檸檬桉枝條中僅分離、鑒定得到10株不同的內生真菌,可能與寄主植物及其所處的生存環境有關。此外,多數內生真菌并不能在人工培養基上培養,且PDA培養基也不一定是最適培養基,因此本研究中分離到的這10株內生真菌只是檸檬桉內生真菌的一部分。在后續的研究中可以嘗試采用不同的培養基并結合高通量測序,分離得到盡可能多的內生真菌,并比較不同培養基內生真菌的分布和生長情況。此外,本研究在制備內生真菌提取物時采用大米固體培養基,發酵時間為60 d,雖然已將大米培養基完全消耗分解掉,且目前尚未見大米培養基中含有抗細菌活性成分,但仍不能排除部分抗菌活性成分來源于培養基的可能性。因此,在以后的研究中應以大米培養基的提取物為空白對照。
內生真菌與其宿主植物在長期的協同進化過程中形成了互利共生的關系,內生真菌不僅可以給植物提供所需的營養物質,還參與植物的防衛機制,增強植物抗逆境、抗病蟲害的能力[20]。內生真菌是支撐農林生產的重要的推手,在提高作物產量增強植物抗病性的同時可降低化學農藥的使用,從而有利于保護環境和人類健康[21]。部分內生真菌產生的生物活性物質在植物病害生物防治和藥物研發等方面表現出了巨大的經濟價值和應用前景[22],本研究從檸檬桉枝條中分離到的內生真菌Ecf?4(Rhytidhysteron sp.,MK211261)和Ecf?1(Epicoccum sp.,MK211258)對桉樹青枯病菌R.solanacearum表現出較強的抑制活性,同時對其他供試細菌也表現出一定的抑制活性。目前與Ecf?4和Ecf?1同屬的菌株作為內生真菌在多種植物中被報道。Chokpaiboon等[23]研究發現紅樹林內生真菌Rhytidhysteron rufulum能夠產生含有高度氧化側鏈的色酮類化合物rhytidchromones A?E,該類化合物具有很好的細胞毒活性。Pudhom等[24]發現紅樹林內生真菌Rhytidhysteron sp. AS21B能夠產生一系列的螺二萘類化合物,并測定了對兩種癌細胞的細胞毒活性。El Amrani等[25]從蘋果薄荷Mentha suaveolens內生真菌Epicoccum nigrum中分離到5個新的聚酮類化合物,部分化合物對蛋白激酶和脫乙酰化酶具有抑制活性。Dzoyem等[26]從榼藤子Entada abyssinica內生真菌Epicoccum nigrum中分離到具有抗氧化、細胞毒活性和抗細菌活性的白僵菌素、對羥基苯甲醛、吲哚?3?羧酸和醌茜等4個化合物。檸檬桉內生真菌Ecf?4和Ecf?1可作為抗細菌活性物質開發的候選菌株,進一步分離和鑒定其中的活性成分,闡明其抗菌機理,為生物農藥的大規模開發應用和病害的生物防治奠定基礎。
參考文獻
[1]?KNAPIC S, PIRRALHO M, LOUZADA J L, et al. Early assessment of density features for 19 Eucalyptus species using X?ray microdensitometry in a perspective of potential biomass production [J]. Wood Science and Technology, 2014, 48(1): 3749.
[2]?謝耀堅.中國桉樹育種研究進展及宏觀策略[J].世界林業研究,2011,24(4):5054.
[3]?侯學會,牛錚,黃妮,等.廣東省桉樹碳儲量和碳匯價值估算[J].東北林業大學學報,2012,40(8):1317.
[4]?陳德引.桉樹常見病害及其防治措施探討[J].現代園藝,2015(4):95.
[5]?劉杰鋒.我國桉樹研究現狀與發展態勢[J].桉樹科技,2009,26(2):5061.
[6]?崔寧寧,廖紹波,王勝坤,等.林木青枯病研究進展[J].植物保護,2009,35(6):2229.
[7]?韋春義,馬英玲.桉樹青枯病的風險評估[J].廣東農業科學,2010(3):147149.
[8]?李波,王軍,孫思,等.桉樹青枯病的生物防治研究進展[J].廣東林業科技,2012,28(1):7781.
[9]?SHAN Tijiang, TIAN Jin, WANG Xiaohan, et al. Bioactive spirobisnaphthalenes from the endophytic fungus Berkleasmium sp.[J]. Journal of Natural Products, 2014, 77(10): 21512160.
[10]LI Shoujie, ZHANG Xuan, WANG Xianghua, et al. Novel natural compounds from endophytic fungi with anticancer activity [J]. European Journal of Medicinal Chemistry, 2018, 156: 316343.
[11]WANG Dongmei, WANG Huan, LI Jing, et al. Investigating the role of endophytic fungi in Gentiana scabra Bge. by cross?growth period inoculation [J]. Indian Journal of Microbiology, 2018, 58(3): 319325.
[12]KHARWAR R N, GOND S K, KUMAR A, et al. A comparative study of endophytic and epiphytic fungal association with leaf of Eucalyptus citriodora Hook., and their antimicrobial activity [J]. World Journal of Microbiology & Biotechnology, 2010, 26(11): 19411948.
[13]格希格圖, 胡鳶雷, 慈忠玲, 等. 桉樹根部內生菌與青枯病相關關系研究[J]. 林業實用技術, 2009(8): 4243.
[14]SHAN Tijiang, LOU Jingfeng, GAO Shan, et al. Antibacterial activity of the endophytic fungi from a traditional Chinese herb Paris polyphylla var. chinensis [J].African Journal of Microbiology Research, 2012, 6(14): 34403446.
[15]宋慧云, 段志豪, 張偉豪, 等. 宮粉羊蹄甲炭疽病病原鑒定及其藥劑篩選[J]. 南方農業學報, 2018, 49(10): 19751981.
[16]XIA Ye,SAHIB M R,AMNA A.Culturable endophytic fungal communities associated with plants in organic and conventional farming systems and their effects on plant growth [J/OL]. Scientific Reports, 2019, 9(1): 16691679.
[17]張偉豪,翁道玥,宋慧云,等.9種夾竹桃科和大戟科植物抗菌和抗氧化活性測定[J].南方農業學報,2018,49(1):8590.
[18]LUPO S, TISCORNIA S, BETTUCCI L. Endophytic fungi from flowers, capsules and seeds of Eucalyptus globulus[J]. Revista Iberoamericana de Micologia, 2001, 18(1): 3841.
[19]MIGUEL P S B, DELVAUX J C, OLIVEIRA M N V, et al. Diversity and distribution of the endophytic fungal community in eucalyptus leaves [J]. African Journal of Microbiology Research, 2017, 11(3): 92105.
[20]宋薇薇, 朱輝, 余鳳玉, 等. 植物內生菌及其對植物病害的防治作用綜述[J]. 江蘇農業科學, 2018, 46(6): 1216.
[21]單體江, 秦楷, 謝銀燕, 等. 木麻黃內生真菌次生代謝產物及生物活性[J]. 華南農業大學學報, 2019, 40(3): 6774.
[22]郭順星. 藥用植物內生真菌研究現狀和發展趨勢[J]. 菌物學報, 2018, 37(1): 113.
[23]CHOKPAIBOON S, CHOODEJ S, BOONYUEN N, et al. Highly oxygenated chromones from mangrove?derived endophytic fungus Rhytidhysteron rufulum[J]. Phytochemistry, 2016, 122: 172177.
[24]PUDHOM K,TEERAWATANANOND T,CHOOKPAIBOON S.
Spirobisnaphthalenes from the mangrove?derived fungus Rhytidhysteron sp. AS21B [J].Marine Drugs,2014,12(3):12711280.
[25]EL AMRANI M, LAI D, DEBBAB A, et al. Protein kinase and HDAC inhibitors from the endophytic fungus Epicoccum nigrum [J].Journal of Natural Products, 2014, 77(1): 4956.
[26]DZOYEM J P, MELONG R, TSAMO A T, et al. Cytotoxicity, antioxidant and antibacterial activity of four compounds produced by an endophytic fungus Epicoccum nigrum associated with Entada abyssinica[J]. Revista Brasileira de Farmacognosia, 2017, 27(2): 251253.
(責任編輯:田?喆)

