江蘇省揚州市水仙病毒檢測鑒定與序列分析
張坤 陳雯 甘海峰 羅云建 陳夕軍 賀振


摘要 :水仙屬于石蒜科水仙屬,是重要的觀賞花卉之一。2016年-2017年,在江蘇省揚州市采集的水仙上發現典型的花葉、條斑等病毒病癥狀。利用已報道的水仙病毒通用引物對疑似病樣進行RT?PCR檢測,結果表明,揚州采集到的3份病樣上均能擴增到與預期大小相同的DNA片段。經克隆測序和序列分析發現,所得序列包含3種不同的類型,分別與水仙普通潛隱病毒 Narcissus common latent virus (NCLV)、水仙退化病毒 Narcissus degeneration virus (NDV)和水仙黃條病毒Narcissus yellow stripe virus (NYSV)有93%、98%和99%的相似性,表明江蘇水仙受到了NCLV、NDV、NYSV 3種病毒侵染。這是江蘇水仙上第一次發現NCLV、NDV、NYSV。在系統樹中,NCLV可分為兩個組,本研究所得NCLV?YZ與上海分離物位于同一組中;NDV也可分為兩個組,本研究所得NDV與其他中國分離物均位于第二組;而NYSV具有很高的多樣性,可分為4個組,本研究所得NYSV與其他部分中國分離物和日本分離物位于第一組。NCLV和NDV分組具有清晰的地理差異性,而NYSV受到地理隔離的影響不明顯。
關鍵詞 :水仙病毒;?檢測;?序列分析
中圖分類號:
S 436.81
文獻標識碼:?A
DOI:?10.16688/j.zwbh.2018448
Detection, identification and sequence analysis of narcissus viruses in
Yangzhou city,Jiangsu province
ZHANG Kun,?CHEN Wen,?GAN Haifeng,?LUO Yunjian,?CHEN Xijun,?HE Zhen
(School of Horticulture and Plant Protection, Yangzhou University, Yangzhou?225009, China)
Abstract
Narcissus is an important ornamental flower, which belongs to the family Amaryllidaceae. In 2016-2017, typical viral infection symptoms, such as mosaic, and streak, appeared on Narcissus in Yangzhou, Jiangsu province. The previously reported narcissus virus universal pair of primers were used to perform the RT?PCR, and the results showed that the expected DNA fragments could be amplified from three samples collected from Yangzhou. Cloning, sequencing and analysis showed that the amplified sequence contained three different types, with 93%, 98% and 99% identities with the Narcissus common latent virus (NCLV), Narcissus degeneration virus (NDV) and Narcissus yellow stripe virus (NYSV), respectively. These results suggested that narcissus was infected by three viruses, NCLV, NDV and NYSV. This is the first report that the narcissus was infected by NCLV, NDV and NYSV in Jiangsu province. In the phylogenetic tree, all NCLV isolates were divided into two groups, while NCLV?YZ clustered with Shanghai isolates as one group; all NDV isolates were divided into two groups, and NDV?YZ clustered into group Ⅱ together with other Chinese isolates; all NYSV isolates were divided into four groups with highest diversity, and NYSV?YZ clustered into group Ⅰ together with some Chinese and Japanese isolates. The phylogenetic tree constructed with both NCLV and NDV rather than NYSV reflected obvious geographical specificity.
Key words
narcissus viruses;?detection;?sequence analysis
水仙Narcissus tazetta為多年生草本植物,屬于石蒜科Amaryllidaceae水仙屬Narcissus,是重要的觀賞花卉之一。中國水仙N. tazetta var. chinensis是水仙屬中觀賞價值極高的一類,也是化工和制藥業中的重要資源植物[1]。由于水仙長期無性繁殖,致使病毒在體內不斷積累,嚴重影響水仙產品的外觀和品質,成為水仙生產的重要制約因素之一[2]。目前,在水仙上發現的病毒有20余種,主要以馬鈴薯病毒科Potyviridae、線性病毒科Flexiviridae和豇豆花葉病毒科Secoviridae病毒為主[3]。
水仙普通潛隱病毒Narcissus common latent virus (NCLV) 屬于乙型線狀病毒科Betaflexiviridae香石竹潛隱病毒屬Carlavirus,病毒粒體線狀,其基因組是一條正義單鏈RNA,全長8 539個核苷酸 (nucleotide,nt),含有6個開放閱讀框[4]。基因組序列比對和系統進化樹分析表明與其親緣關系最近的是馬鈴薯M病毒Potato virus M (PVM)、啤酒花潛隱病毒Hop latent virus (HpLV)和烏頭潛隱病毒Aconitum latent virus (AcLV)[5]。NCLV侵染水仙后,常常無明顯癥狀。
水仙退化病毒Narcissus degeneration virus (NDV) 屬于馬鈴薯病毒科Potyviridae馬鈴薯Y病毒屬Potyvirus,在中國主要分布于上海崇明[6]和福建漳州[7];在新西蘭[8]和澳大利亞[9]也有報道。NDV侵染水仙后在葉片上表現褪綠條紋、斑駁、畸形等癥狀。
水仙黃條病毒Narcissus yellow stripe virus (NYSV) 也屬于馬鈴薯Y病毒屬Potyvirus。NYSV感染植株的典型癥狀是葉脈呈黃色條斑,病情嚴重時植株瘦小、矮化,和其他病毒復合侵染時癥狀更為嚴重。有報道其與水仙遲黃病毒Narcissus late season yellows virus (NLSYV)復合侵染能夠引起葉片變黃,花朵的質量下降[10]。
為明確江蘇省水仙病毒的發生情況,2016年-2017年,我們收集了水仙上表現花葉、黃色條斑等典型的病毒病害癥狀樣品,提取總RNA,采用RT?PCR序列測定和比對分析,結果鑒定到3種病毒,分別為NDV、NCLV和NYSV,并對這3種病毒進行了序列和系統發育分析。
1?材料與方法
1.1?材料
供試植物:2016年-2017年度,在江蘇省揚州市開心農場、花卉市場、高郵市花卉市場采集到表現黃化、花葉和斑駁等疑似病毒病癥狀(圖1)的樣品共9株。
培養基:LB培養基 (Luria?Bertani):胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,使用前加入終濃度為50 μg/mL氨芐青霉素。
試劑:TaKaRa MiniBEST Plant RNA Extraction Kit、5×M?MLV Buffer、dNTPs、RNA酶抑制劑、反轉錄酶M?MLV、Marker、pMD19?T載體,寶生物工程 (大連) 有限公司;AxyPrep DNA凝膠回收試劑盒,康寧生命科學 (吳江) 有限公司;煙草脆裂病毒ELISA試劑盒,上海橋杜生物科技有限公司;2×Taq Master Mix,南京諾唯贊生物科技有限公司。
儀器:Eppendorf AG 22331 PCR儀,德國Eppendorf公司;培清JS?680B凝膠成像系統,上海培清公司;XW?80A型漩渦振蕩器,上海青浦滬西儀器廠;DYCP?28A、DYCP?31A型電泳槽,北京市六一儀器廠;Thermo Scientific MicroCL 17微量離心機,Thermo Fisher Scientific公司。
1.2?方法
1.2.1?葉片總RNA提取
取0.1 g水仙葉片,參照TaKaRa MiniBEST Plant RNA Extraction Kit試劑盒說明書,提取總RNA。最終將RNA溶解于40 μL無核酸酶水中。
1.2.2?cDNA合成及PCR擴增、克隆和序列測定
利用反轉錄酶M?MLV (Promega),通過水仙病毒反向通用引物Tu3T9M (5′?AAAAAAAAAA?AAAAAGAGCTCGGA?3′) [1113]將總RNA反轉錄成第1鏈cDNA。在PCR管中依次加入下列試劑:20 μmol/L下游引物Tu3T9M 1 μL、700 ng/μL總RNA 1 μL、無核酸酶水4 μL。混勻離心后,于70℃孵育10 min,然后迅速置于冰上冷卻2 min。離心5 s后再加入下列試劑:5×M?MLV Buffer 2 μL、dNTPs (10 mmol/L) 0.5 μL、40 U/μL RNA酶抑制劑(RNase inhibitor) 0.25 μL、200 U/μL反轉錄酶M?MLV 0.25 μL、無核酸酶水1 μL。混勻后離心5 s,于42℃孵育1 h,70℃孵育15 min,冰上冷卻2 min。得到的cDNA溶液保存于-20℃待用。
以獲得的cDNA為模板。50 μL PCR反應體系:cDNA 2 μL、水仙病毒通用引物Tu3T9M和POTYNIbNOT4P(5′?GGGGCGGCCGCATATGG?GGTGAGAGAGGTNTGYGTNGAYGAYTTYAAY?AA?3′) 各2 μL、5 U/μL 2×Taq Master Mix 25 μL、超純水19 μL。PCR反應條件:94℃變性1 min,按下列條件進行30個循環:94℃變性30 s,60℃退火30 s,72℃延伸1 min 30 s,最后72℃延伸10 min。全部PCR產物經1%瓊脂糖凝膠電泳分離后,切取大小為1 000~1 500 bp左右的目的條帶,用凝膠回收試劑盒回收純化后,克隆到pMD19?T載體,轉化大腸桿菌Escherichia coli DH5α。經菌液PCR驗證陽性克隆后,隨機選取20個克隆由生工生物工程 (上海) 股份有限公司進行測序,所得序列利用BLASTn和BioEdit軟件進行序列比對和分析。
1.2.3?多樣性比對和系統發育分析
分別以馬鈴薯M病毒 (KY364848)、蕪菁花葉病毒Turnip mosaic virus (AB701690)和蕪菁花葉病毒TuMV (KT934662) 作為NCLV、NDV和NYSV比對分析的外組。將GenBank中已登錄的4個NCLV分離物,18個NDV分離物,38個NYSV分離物與本研究中獲得的序列,通過DNAMAN、Clustal X2和transAlign (由Georg Weiller教授惠贈) 進行核苷酸序列和氨基酸序列的比對,以確定比對后的核苷酸序列能正確編譯出氨基酸。
用軟件MEGA 7.0對上述3組序列通過鄰接法 (neighbor?joining,NJ) 進行系統發育分析,用自舉法 (bootstrap) 進行1 000次模擬復制計算檢驗。
2?結果與分析
2.1?水仙樣品RT?PCR檢測
利用水仙病毒通用引物Tu3T9M和POTYNIbNOT4P進行RT?PCR擴增,在YZ7、YZ8、YZ15三個樣品中有與預期大小相同的特異片段,長度在1 000~1 500 bp之間,健康的水仙樣品中未擴增出任何片段。
2.2?序列鑒定
將檢測出來的YZ7、YZ8、YZ15進行克隆測序,發現了3個不同的序列。BLASTn比對結果顯示這3個序列分別與上海崇明水仙上分離的NCLV (EU200454)和NDV (AJ311374)具有93%和98%的相似性,與福建漳州水仙上分離的NYSV (AM158908) 有99%的相似性。表明江蘇水仙受到了NCLV、NDV、NYSV 3種病毒侵染。其中,NCLV測定獲得長1 445 nt 基因組C端序列,包括部分的三聯體運動蛋白2 (triple?gene block 2, TGB2) 序列 (132 nt),完整的外殼蛋白 (coat protein, CP) 序列 (906 nt)和核酸結合蛋白 (nucleic acid?binding protein, NABP) 序列 (327 nt),完整的3′端非編碼區 (3′?untranslated region, 3′?UTR) 序列 (75 nt);獲得NDV的片段長度為 (1 177 nt),包括243 nt的核內含體b蛋白 (nuclear inclusion b protein, NIb) 片段,全部的CP序列 (786 nt)和3′?UTR序列 (148 nt);NYSV的片段長1 276 nt,包括240 nt的NIb片段,完整的CP序列 (825 nt)和3′?UTR序列 (211 nt)。將這3個分離物序列提交到GenBank數據庫中,所得NCLV、NDV和NYSV揚州分離物 (YZ) 序列的登錄號分別為MH182708、MH1824726和MH582714。
2.3?多樣性分析和系統發育分析結果
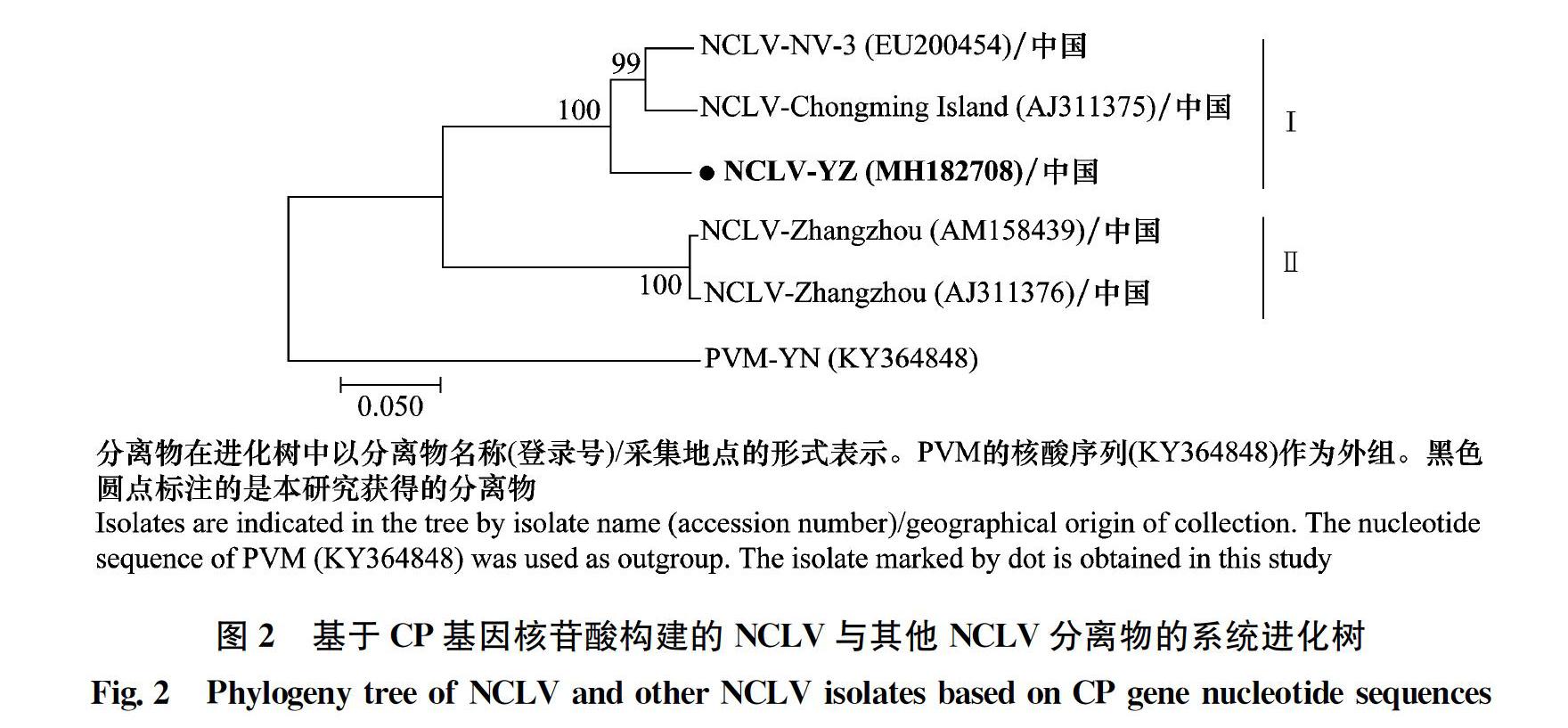
將得到的分離物序列與GenBank登錄的NCLV、NDV和NYSV的CP和3′?UTR核苷酸序列通過DNAMAN和Clustal X2進行相似性比對。結果顯示,NCLV?YZ CP序列和福建分離物 (AM158439和AJ311376) 的同源性為77.4%;與上海分離物 (EU200454和AJ311375) 的序列同源性約92.1%。而在3′?UTR序列上,NCLV?YZ與福建分離物 (AM158439、AJ311376)、上海分離物 (EU200454、AJ311375) 的序列同源性在94.7%~97.3% (表1)。序列分析表明,NCLV?YZ與上海分離物遺傳關系較近,而與福建分離物存在較大的遺傳差異。系統發育分析結果與之類似,依據CP基因序列,NCLV分為兩個組,NCLV?YZ與上海分離物位于同一組中,福建分離物位于另外一個組中 (圖2)。這表明在國內,NCLV具有較為明顯的地理差異性。
NDV?YZ的CP序列與已經報道的福建、上海、澳大利亞和日本分離物的同源性都在96%以上。并且3′?UTR序列與已經報道的序列同源性都在97%以上 (表2)。序列分析表明,NDV?YZ與已報道的分離物遺傳關系都較近。系統發育分析表明,日本、澳大利亞的分離物聚成一組,中國分離物聚為第二組 (圖3)。該結果表明,盡管NDV不同來源分離物間具有較低的遺傳分化,但仍受到較為清晰的地理隔離的影響。
NYSV?YZ的CP序列與GenBank上已報道的分離物一致率為77.3%~99.5%(表3),其中與福建分離物(AM158908、NC011541、AJ311372)序列同源性最高(99.5%);與澳大利亞分離物(JQ395042)和日本分離物(LC314394)的序列同源性最低(77.3%)。NYSV?YZ的3′?UTR序列與已報道報道的分離物一致率為70.0%~100%(表3)。根據CP系統發育分析結果,可將來自中國、日本、印度的NYSV分為4個組(圖4),NYSV?YZ與部分中國和日本分離物聚為一組(第一組),各組間沒有明顯的地理特異性。
3?討論
目前,病毒病是水仙上經常暴發的一類病害,并且經常多種病毒復合侵染[1]。水仙大多以無性繁殖為主,種球一旦帶毒,病毒將在種球內不斷積累,導致種性退化并影響子代[14]。水仙病毒可汁液傳播,寄主廣泛,病毒介體主要是蚜蟲和線蟲[15]。水仙病毒病的防治極其困難,現主要的防治手段仍是加強病毒檢疫來預防病毒病的暴發[2]。已經報道的水仙病毒病在中國主要分布在福建、上海、浙江等地區,國外主要分布在日本、澳大利亞、英國等。
本研究利用水仙病毒通用引物,從江蘇省揚州市采集的水仙上鑒定到3種病毒,其中,NCLV主要分布在中國,且在國內其分布也具有明顯的地理差異性,NCLV?YZ與上海分離物聚為一組,而福建漳州分離物聚為另一組,可能是由于目前國內水仙種球生產南北集中在福建省漳州市和江蘇省宿遷市,而江蘇和上海地區水仙可能來源于宿遷造成的。目前已報道的NDV集中在中國和日本,且不同來源的分離物間具有極高的相似性,但系統發育分析結果表明NDV在中國和日本間仍具有清晰的地理差異性。NYSV在這3個病毒中具有最高的遺傳差異,來自于中國、日本、印度的NYSV在不同組間相互交叉,沒有明顯的地理差異性,這表明NYSV不同株系都能在中國、日本、印度等地區侵染擴散。NYSV可通過多種蚜蟲以非持久性方式傳播,包括甜菜蚜Aphis fabae、豌豆蚜Acyrthosiphon pisum和大戟長管蚜Macrosiphum euphorbiae等[16]。NYSV如此多樣的遺傳差異,可能正是由于上述多樣的傳播介體決定的。這與已報道的黃瓜花葉病毒Cucumber mosaic virus (CMV)、蕪菁花葉病毒Turnip mosaic virus (TuMV)、馬鈴薯Y病毒Potato virus Y (PVY)和花椰菜花葉病毒Cauliflower mosaic virus (CaMV) 等相似[1720]。
本研究在江蘇省揚州市水仙上鑒定到NCLV、NDV和NYSV,并且對這3種病毒分別進行了序列多樣性的系統發育分析,明確了NCLV、NDV和NYSV揚州分離物與已報道的其他分離物遺傳差異、聚類分布和地理特異性特征,為水仙病毒病的合理防控提供了理論依據。
參考文獻
[1]?陳段芬,高健,彭鎮華.水仙屬植物研究進展[J].林業科學,2008,44(3):140146.
[2]?鄭紅英,魯宇文,沈嘉樂,等.侵染水仙的虎眼萬年青花葉病毒外殼蛋白的原核表達、抗血清制備及應用[J].浙江農業學報,2009,21(3):198201.
[3]?鄭紅英,林林,魯宇文,等.水仙普通潛隱病毒基因組全序列及其與香石竹潛隱病毒屬病毒的關系[C].彭友良.中國植物病理學會2006年學術年會論文集.北京:中國農業科學技術出版社,2006.
[4]?臧穎,嚴純,戴凱新,等.水仙病毒病研究進展[J].北方園藝,2019(5):153160.
[5]?ZHENG H Y, CHEN J, ADAMS M J, et al. Complete nucleotide sequence and affinities of the genomic RNA of Narcissus common latent virus (genus Carlavirus)[J]. Archives of Virology, 2006, 151(8):16671672.
[6]?梁艷,宋榮浩,楊翠云,等.上海崇明水仙病毒病病原種類鑒定[J].植物病理學報,2008,38(5):456461.
[7]?林雙慶.福建漳州水仙病毒病的病原鑒定及兩病毒基因組全序列分析[D].福州:福建農林大學,2012.
[8]?WARD L I, VEERAKONE S, TANG J, et al. First report of Narcissus degeneration virus, Narcissus late season yellows virus, and Narcissus symptomless virus on Narcissus in New Zealand [J]. Plant Disease, 2009, 93(9): 964.
[9]?CHEN J, CHEN J P, LANGEVELD S A, et al. Molecular characterization of Carla?and Potyviruses from Narcissus in China [J]. Journal of Phytopathology, 2010, 151(1): 2629.
[10]WYLIE S J, JONES M G. Complete genome sequences of seven carlavirus and potyvirus isolates from Narcissus and Hippeastrum plants in Australia, and proposals to clarify their naming [J]. Archives of Virology, 2012, 157(8):14711480.
[11]WYLIE S J, LI Hua, SIVASITHAMPARAM K, et al. Complete genome analysis of three isolates of Narcissus late season yellows virus and two of Narcissus yellow stripe virus: three species or one?[J]. Archives of Virology, 2014, 159(6):1521.
[12]ZHENG L, RODONI B C, GIBBS M J, et al. A novel pair of universal primers for the detection of potyviruses [J]. Plant Pathology, 2010, 59(2):211220.
[13]OHSHIMA K, MURAOKA S, YASAKA R, et al. First report of Scallion mosaic virus, on wild Japanese garlic (Allium macrostemon) in Japan [J]. Journal of General Plant Pathology, 2015, 82(1):14.
[14]OHSHIMA K, NOMIYAMA R, MITOMA S, et al. Evolutionary rates and genetic diversities of mixed potyviruses in Narcissus [J].Infection Genetics & Evolution,2016,45:213223.
[15]林含新, 林奇英. 水仙病毒病及其研究進展[J]. 植物檢疫, 1996(4): 227229.
[16]沈建國, 高芳鑾, 蔡偉, 等. 進境歐洲水仙種球上病毒的檢測與鑒定[J]. 植物保護學報, 2017, 44(2): 283289.
[17]沈建國, 高芳鑾, 林雙慶, 等. 一步RT?PCR檢測水仙黃條病毒[J]. 生物技術, 2014(1): 4448.
[18]RYOSUKE Y, NGUYEN H D, HO S Y W, et al. The temporal evolution and global spread of Cauliflower mosaic virus, a plant pararetrovirus [J/OL]. PLoS ONE, 2014, 9(1):e85641.
[19]OHSHIMA K, YAMAGUCHI Y, HIROTA R, et al. Molecular evolution of Turnip mosaic virus: evidence of host adaptation, genetic recombination and geographical spread [J]. Journal of General Virology, 2002, 83(6):15111521.
[20]OHSHIMA K, MATSUMOTO K, YASAKA R, et al. Temporal analysis of reassortment and molecular evolution of Cucumber mosaic virus: Extra clues from its segmented genome[J]. Virology, 2015, 487: 188.
[21]CUEVAS J M, DELAUNAY A, RUPAR M, et al. Molecular evolution and phylogeography of Potato virus Y based on the CP gene [J].Journal of General Virology,2012,93(11):24962501.
(責任編輯:張文蔚)

