卡氏肺孢子菌肺炎大鼠中的LAMP檢測方法及1,3-β-D葡聚糖變化的研究*
帕提古麗·那吾爾,劉媛媛,烏蘭·同巴依爾,牛曉琳,朱 輝
(新疆醫科大學第一附屬醫院消毒配送中心次供應室一部,新疆烏魯木齊 830054)
肺孢子菌肺炎(PCP)是獲得性免疫缺陷綜合征(AIDS)患者最常見的機會性感染疾病,也是該類患者致死的重要原因[1]。PCP是由卡式肺孢子菌(PC)感染引發的一種疾病。目前臨床上診斷PCP的主要方法是病原學檢測、免疫學診斷和分子學診斷[2]。病原學檢測是最常用的方法,被稱為“金標準”,此方法特異度高,但是較繁瑣、檢出率低。免疫學診斷具有特異度好,檢出率高的優點,但是成本較高[3]。分子學診斷方法主要是聚合酶鏈式反應(PCR),特異度好,但是需要專門的試劑和貴重儀器。環介導恒溫擴增法(LAMP)指在等溫環境下,30~60 min內進行核酸擴增,擴增過程中出現焦磷酸鎂沉淀,肉眼可判斷結果[4]。LAMP法靈敏度高,最低檢測限為10個拷貝。張楠等[5]發現LAMP方法特異度高,靈敏度高于PCR方法,反應時間較短,臨床使用時不需要特殊儀器,操作較簡單。1,3-β-D葡聚糖(BDG)是真菌細胞壁的主要成分之一。研究發現BDG與深部真菌感染關系密切[6]。本研究通過構建卡式PCP大鼠模型,建立LAMP法檢測模型大鼠體內PC,同時測定BDG,旨在探討LAMP檢測方法在卡式PCP大鼠中的可行性及BDG水平的變化。
1 材料與方法
1.1材料
1.1.1實驗動物 Wister大鼠,SPF級,雌性,200~220 g左右,購自上海斯萊克動物中心。生產許可證為SCXK(滬)2017-0005,實驗動物許可證為SYXK2015-009。
1.1.2主要試劑 地塞米松磷酸鈉注射液(金耀,天津金耀藥業有限公司,國藥準字H2020514);四環素片(華南,廣東華南藥業集團有限公司,國藥準字H44020690);無內毒素質粒小提中量試劑盒[天根,貨號DP118,天根生化科技(北京)有限公司];PMD18-T Vector試劑盒[寶生物,貨號6011,寶生物工程(大連)有限公司];Bst DNA聚合酶(KALANG,貨號KL-D7887,上海康朗生物科技有限公司);瓊脂糖(Spain,貨號A8201,北京索萊寶生物科技有限公司);大鼠1,3-β-D葡聚糖ELISA試劑盒購自基爾頓生物科技(上海)有限公司;SYBR GreenⅠ核酸染料購自上海美季生物技術有限公司;引物由英濰捷基(上海)貿易有限公司合成。
1.1.3主要儀器 DNA電泳儀購自孚光精儀(中國)有限公司;DKT200-2恒溫金屬浴購自廣州華韻生物科技有限公司;臺式高速離心機購自北京泰澤瑞達科技有限公司;KEFS-1高速組織勻漿機購自上海艾黎化學科技有限公司。
1.2方法
1.2.1PCP模型構建 40只Wister大鼠分成肺炎感染組和對照組,每組各20只。對肺炎感染組大鼠進行腹腔注射地塞米松磷酸鈉注射液3.5 mg/只,2次/周,期間為防止細菌感染,給予肺感染大鼠含四環素的飲水(1 g/L),對照組大鼠腹腔注射同等劑量無菌生理鹽水,連續注射8周,8周后停止注射。期間隨時觀察兩組大鼠的活動、飲水和飲食情況,記錄大鼠存活數,每2周稱量體質量。停止地塞米松磷酸鈉注射液后,取肺炎感染組大鼠右肺中葉制成肺印片進行GMS染色,油鏡下觀察并發現肺組織中存在典型的肺孢子菌包囊,則認為PCP模型構建成功。
1.2.2實驗樣本的采集 構建模型前,每組各取6只大鼠稱重,使用乙醚進行麻醉后心臟取血1 mL,離心后取血清備用。解剖各組大鼠,取肝臟、腸系膜淋巴結及完整的肺組織并稱重,計算肺重/體質量比。參照相關文獻[7]的方法,對大鼠進行支氣管肺泡灌洗,采用離心管收集灌洗液,離心收集上清備用。到第8周時兩組各處死10只大鼠,麻醉后心臟取1 mL血,離心后取血清備用。解剖大鼠取肝臟、腸系膜淋巴結及完整的肺并稱重,計算肺重/體質量比。收集灌洗液,方法同上。
1.2.3引物設計 從 GeneBank獲得卡式肺孢子菌核內核糖體小亞基16s rRNA的基因序列(X12708),使用DNA man軟件與人肺孢子菌(AB266392)、念株菌屬(E15168)、酵母菌屬(Z75578)和小鼠肺孢子菌(AY532651)等的16s rRNA進行比對,選擇一段保守性好的基因片段。利用Primer5軟件設計16s rRNA 特異度 LAMP引物。見表1。
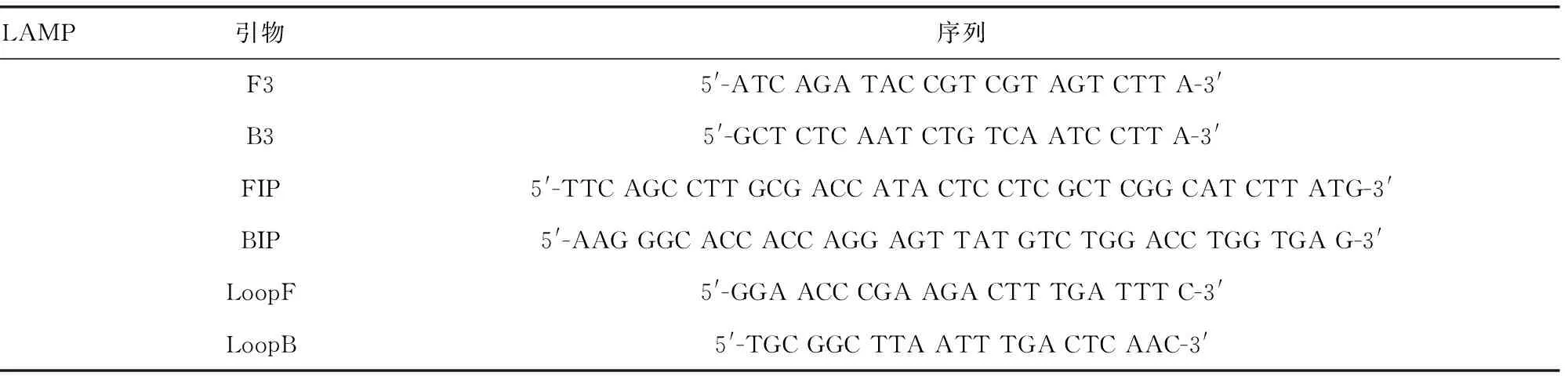
表1 LAMP 引物及堿基序列
1.2.4質粒構建 使用引物F3、B3進行PCR擴增,PCR產物與PMD18-T載體連接后轉化至感受態細胞中,提取重組質粒PMD18-T-16s rRNA。
1.2.5LAMP反應體系 本實驗采用25 μL反應體系,包括10×buffer 2.5 μL,dNTPs 2 μL,MgCl23.2 μL,LoopF和LoopB引物各0.16 μL,FIP和BIP引物各0.32 μL,F3和B3引物各0.04 μL,BST DNA 聚合酶0.8 μL,將反應混合物混勻后,再分別加入模板(質粒模板或者組織DNA)2 μL,SYBR GREENⅠ0.5 μL,加雙蒸水至25 μL,混勻后點離,放置于63 ℃恒溫水浴1 h。取5 μL進行2%瓊脂糖凝膠電泳,觀察電泳和顏色變化結果。
1.2.6酶聯免疫吸附試驗(ELISA)法檢測血清和肺灌洗液中BDG 嚴格按照1,3-β-D葡聚糖ELISA試劑盒說明書步驟進行檢測。
2 結 果
2.1兩組大鼠的一般情況比較 構建大鼠過程中發現肺炎感染組大鼠出現飲食飲水減少、反應變遲鈍、斑塊狀脫毛、眼球顏色變暗、眼睛和鼻子炎性分泌物增多等現象。注射地塞米松8周后,肺炎感染組大鼠死亡4只,死亡率為28.57%。與對照組比較,肺炎感染組大鼠體質量從第6周開始明顯下降,持續到第8周,差異具有統計學意義(P<0.05)。見圖1。
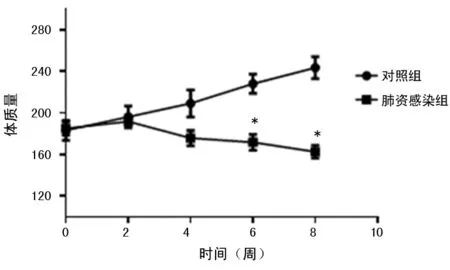
注:與對照組比較,*P<0.05
圖1兩組大鼠的體質量比較
2.2兩組大鼠肺重及肺重/體質量比比較 注射地塞米松前兩組大鼠肺重和肺重/體質量比差異無統計學意義(P>0.05)。與注射地塞米松前比較,注射地塞米松8周后肺炎感染組肺重和肺重/體質量比明顯上升,且觀察組注射地塞米松8周后肺重和肺重/體質量比高于對照組,差異有統計學意義(P<0.05),具體結果見表2。
表2 兩組大鼠肺重及肺重/體質量比比較
注:與對照組比較,*P<0.05;與同組注射地塞米松前比較,#P<0.05

表3 兩組大鼠各組織卡式肺孢子菌LAMP檢測結果[n/n(%)]
注:與對照組比較,*P<0.05;與肺組織比較,#P<0.05
2.3兩組大鼠各組織卡式肺孢子菌LAMP檢測結果 注射地塞米松前,對兩組大鼠(n=6)肺組織、肝組織和腸系膜淋巴結進行LAMP檢測,熒光為棕黃色,判定PC感染為陰性。注射地塞米松8周后,對照組大鼠3種組織LAMP熒光為棕黃色,判定PC感染為陰性;肺炎感染組大鼠均有組織DNA LAMP熒光為綠色,判定PC感染為陽性,其中肝組織和腸系膜淋巴結PC檢出率低于肺組織,差異有統計學意義(P<0.05),與對照組比較,肺炎感染組肺組織檢出率升高,差異有統計學意義(P<0.05),肝和腸系膜淋巴結檢出率比較,差異無統計學意義(P>0.05),具體結果見表3。
2.4兩組大鼠外周血和肺灌洗液BDG水平比較 注射地塞米松前兩組大鼠外周血和灌洗液的BDG水平差異無統計學意義(P>0.05)。注射地塞米松8周后肺炎感染組外周血和肺灌洗液BDG水平表達均上升,均高于對照組,且肺灌洗液BDG水平高于外周血,差異有統計學意義(P<0.05),具體結果見表4。
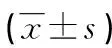
表4 兩組大鼠外周血和肺灌洗液BDG水平比較
注:與對照組比較,*P<0.05;與注射地塞米松前比較,#P<0.05;與外周血比較,△P<0.05
3 討 論
肺炎主要是病原體所引發的疾病,如:真菌、細菌、支原體、衣原體和病毒等[8]。PC屬于機會性致病真菌的一種,可導致PCP的發生。近些年來隨著艾滋病、腫瘤和自身免疫性疾病患者人數的增加,PCP的致死率也逐年增加[9]。研究報道,PCP與慢性阻塞性肺病(COPD)發生存在關系[10]。目前臨床上PC的檢測方法主要為病原學檢查,該方法具有良好的特異度,但是耗費時間較長[11]。LAMP是一種等溫核酸擴增方法,敏感性高。研究發現,LAMP靈敏度、特異度和檢出率與巢氏PCR和實時定量熒光PCR無明顯差異[12]。因此將LAMP檢測方法運用于PCP檢測,對于該疾病的早期診斷和預后都具有重要的意義。
本研究采用腹腔注射地塞米松的方法構建PCP模型,建模過程中發現肺炎感染組大鼠出現飲食飲水減少、反應變遲鈍、斑塊狀脫毛、眼球顏色變暗、眼睛和鼻子炎性分泌物增多等現象。注射地塞米松8周后,肺炎感染組大鼠死亡4只,死亡率為28.57%。與對照組比較,肺炎感染組大鼠體質量從第6周開始明顯下降,持續到第8周,差異有統計學意義(P<0.05)。結果提示了模型大鼠病情隨建模時間延長而加重,也側面驗證了模型構建成功。孫艷等[13]也發現卡氏PCP模型大鼠隨著建模時間病情會加重,出現體質量減輕、反應遲鈍等情況。目前國外已經開展LAMP檢測肺孢子菌,但是國內還在構建LAMP檢測方法階段[14]。本研究在PCP大鼠模型上運用LAMP技術檢測到PC感染,檢出率為100%,而對照組各組織均未檢測到PC感染。結果提示此方法具有高特異度,結果可靠,不存在假陽性。值得一提的是,PCP組10只大鼠肺組織均檢測到PC感染,各有1只肝臟組織和腸系黏膜組織也檢測到PC感染,其原因可能是PC在PCP疾病后期發生了轉移擴散,這需要后期大量實驗驗證。
BDG檢測主要用于系統性念珠菌病和肺曲霉病的檢測,在PC的檢測中應用較少[15-16]。本研究結果顯示,注射地塞米松前兩組大鼠外周血和灌洗液的BDG水平差異無統計學意義(P>0.05)。注射地塞米松8周后肺炎感染組外周血和肺灌洗液BDG水平表達均上升,均高于對照組,且肺灌洗液BDG水平高于外周血(P<0.05)。結果提示了BGD與PCP有一定相關性,可作為PCP的早期輔助診斷指標。吳歡歡等[17]也發現BGD與PCP具有一定相關性,是可靠的PCP輔助診斷的指標。肺灌洗液中BGD高于血清BGD,原因是肺部是PC的易感部位,且肺泡中含有大量吞噬細胞,吞噬病原菌后可釋放更多BDG[18]。
4 結 論
本研究成功建立PCP大鼠PC基因的LAMP檢測方法,可將此方法與臨床常用的PCP診斷方法結合并進行優化,對簡捷高效的新型診斷技術開發具有一定的潛在價值。同時,本研究發現BGD與PCP有一定相關性,可作為PCP的早期輔助診斷指標。

