外周血T淋巴細胞亞群在白血病病情監測及療效判定中的檢測價值
王 韌,劉佩佳,閆永毅
(哈爾濱醫科大學附屬第二醫院檢驗科,黑龍江哈爾濱 150001)
白血病是造血干細胞的惡性疾病,以骨髓造血抑制為特征,呈現慢性進展。白血病的發病機制至今尚未完全清楚,可能與化學毒物、藥物、遺傳因素、放射、機體免疫功能異常等因素有關[1]。其中免疫功能異常是影響白血病發生和發展的重要因素,尤其是細胞免疫異常。在抗腫瘤免疫效應中,細胞免疫往往比體液免疫起著更為重要的作用。T淋巴細胞是執行免疫功能的細胞,在機體免疫效應中發揮重要的作用,在腫瘤環境中能夠抑制抗腫瘤免疫[2]。以往有研究報道,急性髓細胞性白血病(AML)中監測T淋巴細胞水平對其免疫異常實質及臨床治療有重要意義[3]。但在不同類型的白血病患者中T淋巴細胞介導的細胞免疫是否存在差異還有待進一步研究。本研究探討外周血T淋巴細胞亞群在白血病病情檢測及預后判定中的檢測價值,現報道如下。
1 資料與方法
1.1一般資料 納入本院2015年1月至2016年12月收治的190例白血病患者,納入標準:(1)均經骨髓穿刺及骨髓切片確診;(2)均符合白血病的診斷標準。排除進行外周血T淋巴細胞檢測時最近2個月接受免疫抑制治療患者。其中急性白血病(AL)患者125例,慢性白血病(CL)患者65例。AL患者中男72例,女53例;年齡9~75歲,平均(56.5±21.2)歲;其中急性淋巴細胞性白血病(ALL)患者74例,AML患者51例。CL患者中男44例,女21例;年齡8~78歲,平均(55.2±23.1)歲;其中慢性淋巴細胞性白血病(CLL)患者45例,慢性髓細胞性白血病(CML)患者20例。另選取190例志愿者為對照組,均來自本院體檢,無心、肝、腎等臟器的疾病;排除血液系統和免疫系統疾病、近期發熱和輸血史以及近期有感染的病例;其中男82例,女68例;年齡10~75歲,平均(54.6±21.7)歲。白血病組患者的年齡、性別組成與對照組比較,差異無統計學意義(P>0.05),具有可比性。
1.2主要儀器與試劑 BECKMAN-COULTER型流式細胞儀及相關試劑,水平離心機,鼠抗人單克隆抗體,磷酸鹽緩沖液,溶血素,旋窩振蕩器等。
1.3方法
1.3.1檢驗方法 采集白血病組及對照組的外周靜脈血2 mL,置入乙二胺四乙酸(EDTA)抗凝,放入離心機中以1 500 r/min離心5 min。采用移液管將標本上層血漿吸除后用免疫熒光法直接測定外周血T淋巴細胞亞群。每一個標本取1支加入10 μL單克隆熒光抗體及100 μL細胞懸濁液,渦旋混勻,室溫避光放置15 min。之后取出加入450 μL 1×FACS溶血素混勻,待紅細胞完全溶解后,BS洗滌2次,24 h內上機,每管收集2 000個淋巴細胞。
1.3.2隨訪 根據AL及CL患者病情的不同以及疾病類型的不同給予相應的化療方案,對190例白血病患者進行6~18個月的隨訪,平均隨訪(12.5±3.5)個月,隨訪患者的預后情況。分為預后良好組以及預后不良組,預后良好的判定參照謝平[4]的相關標準:(1)貧血消失,皮膚、肝、脾淋巴結正常;(2)白細胞總數低于10×109/L,外周血檢測未發現幼稚細胞,血小板總數、血紅蛋白水平恢復正常;(3)原始細胞+早幼細胞低于5%。
2 結 果
2.1不同類型白血病患者外周血T淋巴細胞亞群分布情況 CL組的CD3+、CD4+水平低于AL組和對照組,AL組的CD3+水平高于對照組,差異有統計學意義(P<0.05)。AL組的CD8+水平高于對照組和CL組,AL組和CL組的CD4+/CD8+低于對照組,差異有統計學意義(P<0.05)。AL組的CD4+水平與對照組之間,CL組的CD8+水平與對照組之間,AL組與CL組的CD4+/CD8+之間,差異無統計學意義(P>0.05)。見表1。
2.2AL各亞組之間外周血T淋巴細胞亞群分布情況 ALL、AML組的CD3+水平高于對照組,ALL組的CD4+水平低于AML組和對照組,ALL組、AML組的CD8+水平高于對照組,ALL組、AML組的CD4+/CD8+低于對照組,差異有統計學意義(P<0.05)。ALL組的CD3+、CD8+水平、CD4+/CD8+與AML組之間,AML組的CD4+水平與對照組之間,差異無統計學意義(P>0.05)。見表2。
2.3CL各亞組之間外周血T淋巴細胞亞群分布情況 CLL組的CD3+水平低于CML組和對照組,CLL組和CML組的CD4+水平低于對照組,CML組的CD8+水平高于對照組和CLL組,CLL組和CML組的CD4+/CD8+低于對照組,差異有統計學意義(P<0.05)。CLL組的CD8+水平與對照組之間,CLL組CD4+/CD8+與CML組之間,差異無統計學意義(P>0.05)。見表3。
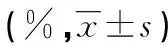
表1 不同類型白血病患者外周血T臨床細胞亞群分布情況
2.4外周血T淋巴細胞亞群在不同預后白血病患者中的分布情況 AL組預后良好組的CD3+、CD8+水平低于預后不良組,CD4+/CD8+高于預后不良組,差異有統計學意義(P<0.05)。見表4。CL組預后良好組的CD3+、CD4+水平、CD4+/CD8+高于預后不良組,差異有統計學意義(P<0.05)。見表5。
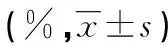
表2 AL各亞組之間外周血T淋巴細胞亞群分布情況
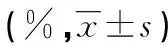
表3 CL各亞組之間外周血T淋巴細胞亞群分布情況
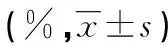
表4 AL組外周血T淋巴細胞亞群在不同預后白血病患者中的分布情況
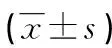
表5 CL組外周血T淋巴細胞亞群在不同預后白血病患者中的分布情況
3 討 論
白血病的特點是造血干/祖細胞惡性克隆性增生,雖然近年來治療白血病的藥物及新方法層出不窮,但其5年生存率仍低于30%[5]。有研究顯示,白血病患者的細胞免疫功能紊亂[6]。白血病患者5年生存率低與當前的治療方法無法改善患者的免疫系統來達到清除殘留白細胞有關。T淋巴細胞是機體免疫系統中功能最重要的細胞群之一,有輔助功能、殺傷功能和抑制功能,其中CD3+細胞代表T淋巴細胞總數,可分為CD4+和CD8+,各亞群之間的平衡狀態與機體的免疫功能密切相關。其中CD4+T細胞為輔助/誘導性T淋巴細胞亞群,具有免疫協調功能,可增強和擴大其他免疫細胞的功能。CD8+細胞系細胞毒性T細胞,可分泌一些抑制因素,同時產生腫瘤源性免疫抑制因子。CD4+/CD8+的比例可反映機體細胞免疫功能狀態,它們之間既相互促進又相互制約。該比值的穩定對維持細胞免疫反應平衡至關重要,只有當CD4+/CD8+正常時才能發揮抗腫瘤作用。有研究顯示,白血病患者常伴有T淋巴細胞亞群的改變和功能損害,如免疫監視功能減弱、數量減少、細胞免疫功能缺陷[7]。
本研究結果顯示,AL組和CL組患者的CD4+/CD8+較對照組顯著降低,且均小于1,這提示白血病患者存在免疫功能低下。AL組的CD3+和CD8+水平較對照組顯著升高,而CL組的CD3+和CD4+水平較對照組顯著降低。這提示AL患者和CL患者的免疫紊亂是不同的,AL患者主要是CD8+增加,CL患者主要是CD4+的減少。CD4+/CD8+比值升高提示機體免疫功能加強,降低提示機體免疫抑制,已發生腫瘤免疫逃逸[8]。在AL患者中ALL患者伴隨有CD4+的減少,且該類患者的CD4+/CD8+比值略低于AML患者。這提示AML患者的免疫功能在一定程度上優于ALL患者。在CL患者中通過比較各T淋巴細胞亞群發現CML患者的CD3+與對照組相當,而CLL患者是顯著減少的。且CML患者的CD8+水平顯著增加,CLL患者的CD8+與對照組相當。CLL組CD4+/CD8+的比值接近1,略高于CML組。CD4+T淋巴細胞、CD8+淋巴細胞失調可導致繼發性免疫缺陷[9]。這提示CML患者的免疫功能較CLL患者差,患者的預后可能更差。以上結果顯示白血病類型不同,T淋巴細胞紊亂的形式存在差異。以往有研究報道,隨著白血病患者病情的緩解,患者的細胞免疫功能得到一定程度的恢復,T淋巴細胞亞群的數量及比例可基本恢復正常[10]。
本研究還對白血病患者的預后情況進行隨訪,結果發現,預后良好組的CD3+、CD8+
水平顯著低于預后不良組,CD4+/CD8+顯著高于預后不良組。這提示預后較好的患者免疫功能較強外,外周T淋巴細胞亞群也能在一定程度上反映患者的預后情況。但本研究由于樣本量較小,未對CL患者的預后情況進行隨訪比較,同時也未比較CL、AL患者中不同類型的疾病T淋巴細胞亞群的情況,在下一步的研究中將逐漸完善以上問題。
4 結 論
白血病患者存在外周血T淋巴細胞異常,外周血T淋巴細胞亞群檢測在患者病情檢測判斷及預后中有較高的應用價值。

