S22053不銹鋼在6% FeCl3溶液中的點蝕行為
,,
(1. 合肥通用機械研究院有限公司,合肥 230031; 2. 合肥通用機械研究院特種設備檢驗站有限公司,合肥 230031;3. 國家壓力容器與管道安全工程技術研究中心,合肥 230031)
電化學阻抗技術是一種以小振幅正弦波電位(或電流)為擾動信號的電化學測量方法。該方法的擾動信號小,不僅對體系的影響小,還能使擾動與體系響應之間近似呈線性關系,測量結果的數學處理過程簡單,能比其他電化學技術獲得更多的動力學信息及電極界面的結構信息[1-3]。因該技術有眾多的優點,后續又發展了動電位電化學阻抗譜技術(不同電位下測量材料的阻抗譜)和時間掃描模式下的電化學阻抗譜技術(隨時間的推移測量,不同時間段測量材料的阻抗譜)。
點蝕是一種典型的局部腐蝕,具有很大的隱蔽性和破壞性,通常發生在易鈍化金屬或合金中。其重要特征之一是在某一給定的金屬-介質體系中,存在特定的陽極極化電位門檻值,低于此電位時,不會發生點蝕,高于此電位則發生點蝕[4-5]。
結合點蝕特點和動電位阻抗譜的優點,可以用動電位電化學阻抗譜技術研究鈍化金屬或合金的點腐蝕行為,從而研究材料從鈍化態到亞穩態點蝕,再到穩態點蝕的連續變化過程。杜楠等[6-7]采用動電位電化學阻抗譜和時間掃描模式下的電化學阻抗譜研究了304不銹鋼在3.5% NaCl溶液中的點蝕行為,揭示了點蝕發展過程中雙電層和鈍化膜結構的變化特點;張勝寒等[8]采用動電位電化學阻抗譜技術研究了304不銹鋼在0.1 mol/L NaCl溶液中的點蝕行為,指出點蝕對鈍化膜外層的破壞作用重于對內層的。
S22053不銹鋼常用于含氯離子的腐蝕性環境中,有必要對其點蝕敏感性進行評估。工程中常用6%(質量分數,下同)FeCl3溶液評定不銹鋼的耐點蝕性能[9-11],因此,本工作采用動電位電化學阻抗譜技術研究了S22053不銹鋼在6% FeCl3溶液中的點蝕行為,通過其在不同電位下的電化學阻抗譜變化,分析點蝕行為特征,以期為S22053不銹鋼在含氯離子腐蝕環境中的工程應用提供參考。
1 試驗
1.1 試樣
試驗材料為S22053不銹鋼,其化學成分見表1。試樣尺寸為φ14 mm×6 mm,將試樣置于丙酮溶液中進行超聲波清洗除油后,表面用砂紙(200~1 000號)逐級打磨,隨后再次浸入丙酮溶液中清洗,吹干后放入干燥皿中備用。試驗前,將試樣放入特制的小容器中,其外部為聚四氟乙烯,內部有金屬導線,小容器一端面開有φ11.29 mm的圓孔,面積約為1 cm2,試樣有1 cm2工作面露出并能浸入介質,試樣背面采用螺紋蓋壓緊。
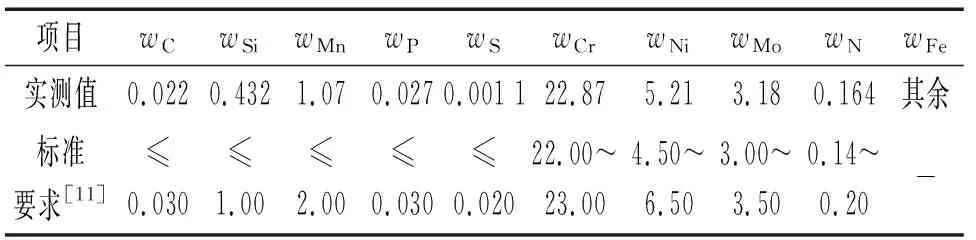
表1 S22053不銹鋼的化學成分Tab. 1 Chemical composition of S22053 stainless steel %
1.2 試驗方法
電化學試驗在德國Zahner公司生產的Zennium E型電化學工作站上完成,采用三電極體系,試樣為工作電極,鉑電極為輔助電極,飽和甘汞電極(SCE)為參比電極。文中電位若無特指,均相對于SCE。試驗溶液為6% FeCl3水溶液,試驗溫度為(25±1) ℃。電化學阻抗譜測試結果采用ZsimpWin軟件進行擬合。
試驗開始前先對試樣進行極化曲線測試,掃描速率為1 mV/s,至電流密度達到10 mA/cm2后停止。根據極化曲線測試結果,確定動電位電化學阻抗譜的電位區間,電位階躍幅度為0.1 V,施加的正弦波電位階躍信號為10 mV,頻率掃描范圍為50 mHz~100 kHz。電化學測試前試樣需先在-0.8 V下陰極極化5 min,以去除試樣表面的氧化膜,隨后在試驗溶液中浸泡1 h,使電化學體系保持穩定。
2 結果與討論
2.1 極化曲線
由圖1可見:試樣在6% FeCl3溶液中的自腐蝕電位為248 mV,在陽極極化區存在明顯的鈍化區(300~850 mV),在鈍化區的腐蝕電流密度約為15 μA/cm2。根據GB/T 17899-1999《不銹鋼點蝕電位測量方法》標準,陽極極化曲線上電流密度達到100 μA/cm2時對應的最正電位為點蝕電位Eb100,故試樣在6% FeCl3溶液中的點蝕電位Eb100為915 mV,根據極化曲線的陽極區間確定動電位電化學阻抗譜的動電位區間為0.3~1.4 V。
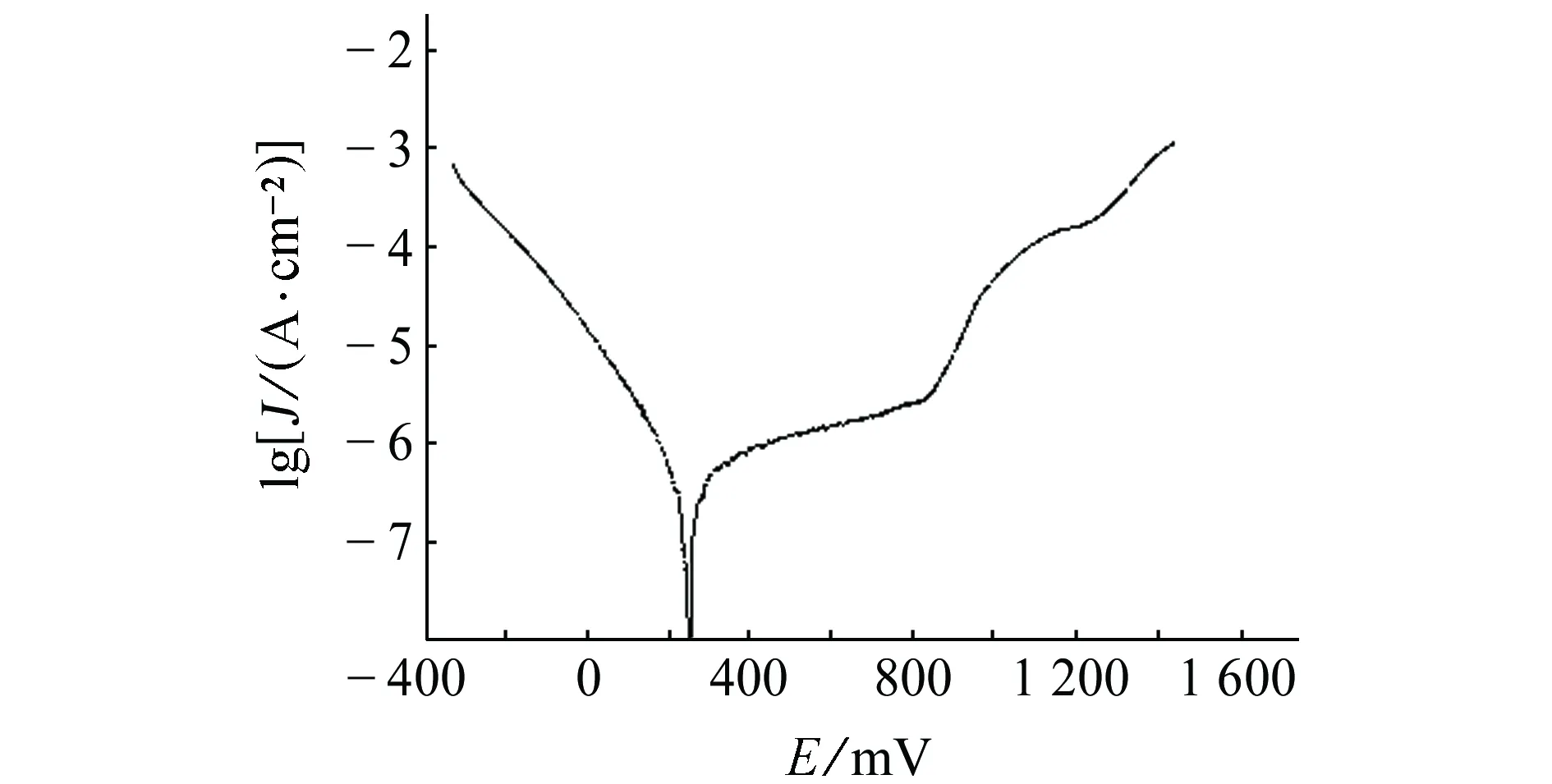
圖1 試樣在6% FeCl3溶液中極化曲線Fig. 1 Polarization curve of sample in 6% FeCl3 solution
2.2 電化學阻抗譜
由圖2(a)可見:在0.3~0.9 V電位區間,Nyquist圖均呈圓弧狀,由一個高-中頻容抗弧組成,低頻區不存在Warburg阻抗,說明在此電位區間,活化控制占主導;在0.3~0.6 V電位區間,阻抗譜半徑隨電位的升高逐漸增大;在0.6~0.9 V電位區間,阻抗譜半徑隨電位的升高逐漸減小,且在0.9 V時尤為明顯。由圖2(b)可見:電位為1.0 V時,阻抗譜由一個高-中頻容抗弧組成,低頻區出現明顯的感抗弧;在1.1~1.2 V電位區間,阻抗譜高-中頻區表現為一個容抗弧特征,低頻區也為一個容抗弧特征;在1.3~1.4 V電位區間,阻抗譜在高頻區表現為容抗弧特征,中頻區表現為另一個容抗弧特征,低頻區表現為一個感抗弧。且在1.0~1.4 V電位區間,容抗弧和感抗弧半徑都隨電位的升高而減小。
(a) 0.3~0.9 V

(b) 1.0~1.4 V圖2 試樣在不同電位下的Nyquist圖Fig. 2 Nyquist polts of samples at different potentials
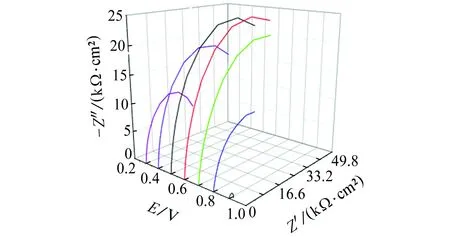
由于在0.3~0.8 V電位區間,試樣Nyquist圖的形狀近似,故對0.8 V時試樣的Bode圖進行分析,結果見圖3。由圖3可見:相頻圖上只有一個峰,故體系中有1個時間常數,0.3~0.8 V電位區間的電化學阻抗譜等效電路見圖4。其中,Rs1是溶液電阻,Qm1是與界面電容相關的常相位角元件,表征試樣表面的鈍化膜,Rt1是電荷轉移電阻。0.9 V時,試樣的Nyquist圖呈半圓狀,低頻區剛進第四象限,初步展現感抗特性,由圖1可知,當電位為0.9 V時,腐蝕電流低于100 μA/cm2,未達到點蝕電位,且Nyquist圖中還沒有明顯的感抗特征,故其等效電路也如圖4所示。
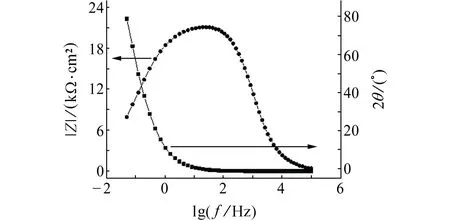
圖3 0.8 V時試樣的Bode圖Fig. 3 Bode plots of sample at 0.8 V
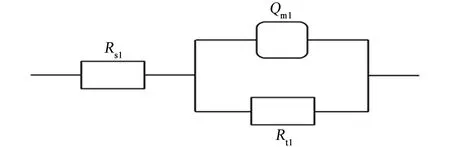
圖4 0.3~0.9 V電位區間,試樣的電化學阻抗譜的等效電路Fig. 4 Equivalent circuit of EIS for samples under the condition of 0.3~0.9 V
曹楚南[2]指出,在鈍化區間,金屬表面同時進行鈍化膜的生成(使鈍化膜增厚)和溶解(使鈍化膜減薄)。由表2可見:在0.3~0.6 V電位區間,常相位角元件Qm1的電容值隨電位的升高而減小,電荷轉移電阻Rt1隨電位的升高而增大,這是因為該區間電位較低,鈍化膜生成占主導,其厚度隨電位的升高而增加,且隨著電位的升高,Qm1和Rt1減小和增加的趨勢減緩,說明隨電位的升高,鈍化膜生成的主導作用削弱。在0.6~0.9 V電位區間,常相位角元件Qm1的電容值和電荷轉移電阻Rt1的變化趨勢正好與在0.3~0.6 V電位區間的相反,這是因為該區間電位稍高,鈍化膜溶解占主導,其厚度隨電位的升高而減小,且隨著電位的升高,Qm1和Rt1分別增大和減小的趨勢加劇,說明隨電位的升高,鈍化膜溶解的主導作用增強。常相位角元件系數nm1在較低電位區間(0.3~0.5 V)基本保持不變,在較高電位區間(0.6~0.9 V),隨電位的升高逐漸降低(越來越偏離1),主要是因為電位較低時,鈍化膜溶解速率低,鈍化膜結構完整,隨著電位的升高,鈍化膜溶解速率高,且不均勻減薄,尤其是薄弱區域,導致nm1越來越偏離1。
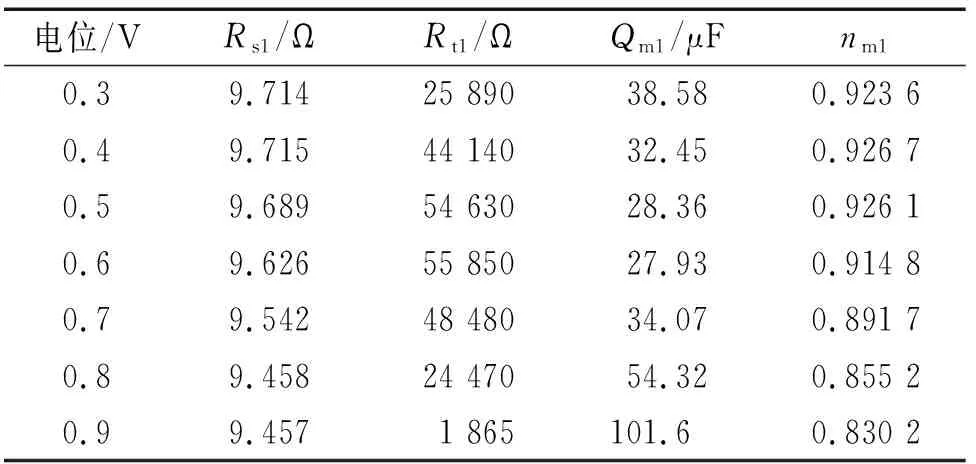
表2 電化學阻抗譜擬合結果(0.3~0.9 V)Tab. 2 Fitting results of EIS under the condition of 0.3~0.9 V
由圖2(b)可見:電位為1.0 V時,Nyquist圖在高-中頻為容抗弧特征,低頻部分出現明顯的感抗弧,曹楚南等[2-3,6]認為,當電極表面有點蝕形成,進入點蝕誘導期時,Nyquist圖中的低頻部分會出現感抗弧。感抗響應主要由于點蝕誘導期膜厚的變化或吸附膜覆蓋率的變化[2,12]。采用圖5所示等效電路進行擬合,其中Rs2為溶液電阻,Rt2為電荷轉移電阻,Rf1為點蝕發生處與膜的生長溶解相關的電阻,Qm2為與界面電容相關的常相位角元件,L1為點蝕形核處與鈍化膜厚度變化相關的等效電感,擬合結果如表3所示。
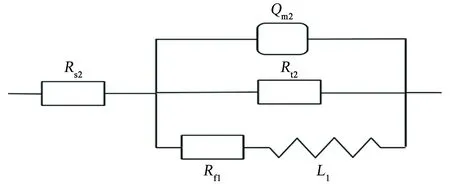
圖5 1.0 V條件下,試樣的電化學阻抗譜的等效電路Fig. 5 Equivalent circuit of EIS of sample under the condition of 1.0 V
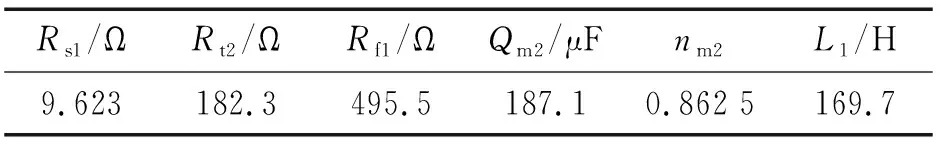
Rs1/ΩRt2/ΩRf1/ΩQm2/μFnm2L1/H9.623182.3495.5187.10.862 5169.7
對比0.9和1.0 V條件下試樣的EIS擬合結果可知,隨著電位的升高,亞穩態點蝕坑內鈍化膜繼續溶解,因點蝕形核處的面積比鈍化膜完好區域的面積小很多,且點蝕形核處的法拉第導納比鈍化膜完好區域的大很多[2],故形核處陽極電流密度很大,加速了誘導處的溶解,故點蝕形核區域的電化學行為是點蝕誘導期電化學阻抗譜的主要特征。
電位為1.1 V時,Nyquist圖出現兩個容抗弧,低頻區未出現感抗特征;電位為1.2 V時,Nyquist圖同樣出現兩個容抗弧,低頻區最后一個數據點進入第四象限,但沒有明顯的感抗特征。這說明隨著電位進一步升高(1.1~1.2 V),誘導處進一步腐蝕發展為穩態點蝕,此時點蝕處的鈍化膜完全消失,點蝕進入發展期,曹楚南等[2,13]的研究結果也證明了這一點。因蝕坑處無鈍化膜保護,“裸露”金屬直接與介質接觸,與有鈍化膜的區域相比,蝕坑處金屬更易腐蝕,且點蝕處的面積遠小于鈍化膜覆蓋區域的,再加上這兩個區域的短路耦合作用,蝕坑內陽極電流密度很大,蝕坑內的溶液電阻不能忽略。1.1~1.2 V時的EIS等效電路見圖6,其中Rs3為溶液電阻,Qm3為與界面電容相關的常相位角元件,Rt3為蝕坑內的溶液電阻,Qk1為點蝕坑內與界面電容相關的常相位角元件,Rf2為點蝕坑內電荷轉移電阻,其擬合結果如表4所示。
對比表3和表4可見:隨著電位的升高,點蝕坑內電荷轉移電阻減小,蝕坑內的溶液電阻減小,說明隨著電位的升高,蝕坑內裸露金屬腐蝕溶解使坑內的離子濃度增加,點蝕進一步加劇。Qm3相對于Qm2減小,nm3相對于nm2增大,蝕坑內的界面電容常相位元件Qk1減小,說明腐蝕更偏向發生在點蝕坑內,且腐蝕加劇的趨勢出現短暫的減緩,與圖1中的極化曲線上出現二次鈍化平臺一致。
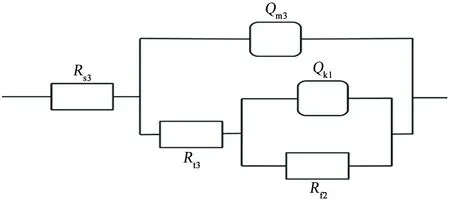
圖6 1.1~1.2 V條件下,試樣的電化學阻抗譜的等效電路Fig. 6 Equivalent circuit of EIS f under the condition of 1.1~1.2 V

電位/VRs3/ΩRt3/ΩRf2/ΩQm3/μFnm3Qk1/μFnk11.19.71471.26126.898.710.916 218 45011.29.68157.9846.3654.160.930 113 2901
點蝕過程是一個自催化過程[2,4,14-15],蝕坑內部金屬腐蝕溶解產生的陽離子會引起坑內離子濃度的增加,且蝕坑口由于殘余蓋[16-20]和腐蝕產物的存在,阻礙了蝕坑內外溶液的交換,加速點蝕。當點蝕發展到一定程度,蝕坑口的金屬部分殘余蓋脫落,加速了蝕坑內外溶液的交換,蝕坑口附近離子濃度降低而出現鈍化,蝕坑深處由于離子濃度高仍快速溶解,且坑內離子存在濃度梯度,越靠近坑口濃度越低,越遠離坑口,離子濃度越高,腐蝕主要體現在遠離坑口的部位,故此電位區間點蝕坑發展長大。
在高電位(1.3~1.4 V)條件下,Nyquist圖中高、中頻區分別出現容抗弧,低頻區出現感抗特征。對應的等效電路如圖7所示。其中,Rs4為溶液電阻,Qm4為與界面電容相關的常相位角元件,Rt4為蝕坑內的溶液電阻,Qk2為點蝕坑內界面電容相關的常相位角元件,Rf3為點坑內電荷轉移電阻,L2為新點蝕形核處與膜厚變化相關的等效電感,其擬合結果見表5所示。
由表5可見:隨著電位進一步升高,蝕坑內的溶液電阻Rt4、點坑內電荷轉移電阻Rf3減小,常相位角元件Qm4減小,這與1.1~1.2 V時的趨勢一致;常相位角元件Qk2隨電位升高而增大,且出現了新電感L2,說明隨著電位的升高,蝕坑深處腐蝕加速,且在高電位下,鈍化膜破裂區的再鈍化受到抑制,鈍化膜覆蓋區的鈍化膜快速溶解,新的點蝕在鈍化部位誘導產生。
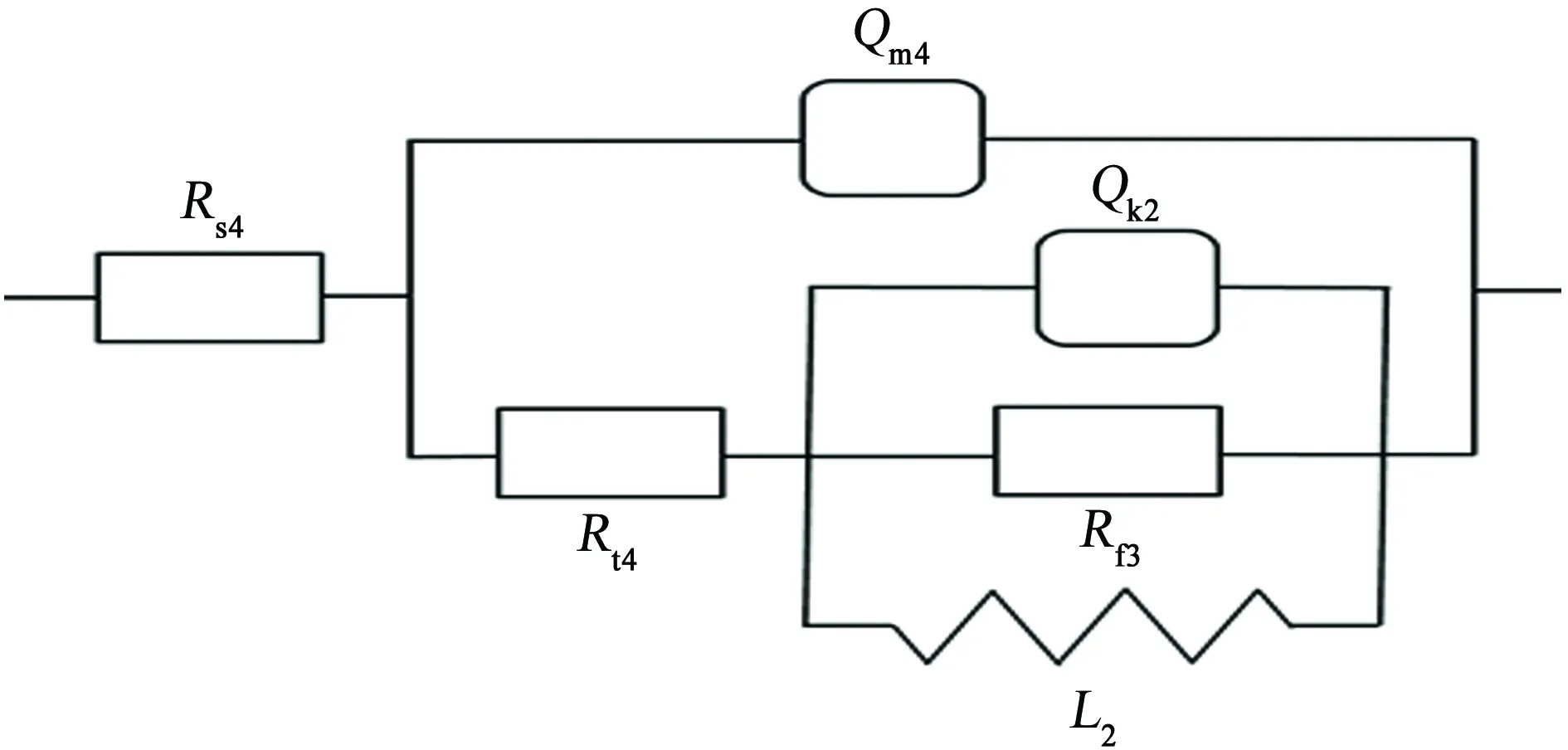
圖7 1.3~1.4 V條件下,試樣的電化學阻抗譜的等效電路Fig. 7 Equivalent circuit of EIS under the condition of 1.3~1.4 V

電位/VRs4/ΩRt4/ΩRf3/ΩQm4/μFnm4Qk2/μFnk2L2/H1.39.64419.7312.1535.470.956 114 0900.991 722.371.49.60411.627.19429.850.963 324 2200.921 212.63
綜上所述,S22053不銹鋼在6% FeCl3溶液中,當電位為0.3~0.9 V時,基本處于穩定的鈍化狀態,阻抗譜主要表征鈍化膜的電化學行為特征;1.0 V下鈍化膜上誘導點蝕;1.1~1.2 V區間,蝕坑腐蝕擴展,由于金屬殘余蓋脫落,蝕坑內坑口附近由于離子濃度降低而鈍化,以蝕坑深處腐蝕為主;1.3~1.4 V區間,由于電位高,試樣表面鈍化膜快速溶解,新的點蝕在鈍化部位誘導產生。
3 結論
(1) S22053不銹鋼在6% FeCl3溶液中的點蝕電位為915 mV,自腐蝕電位為248 mV。
(2) 電位為0.3~0.9 V時,S22053不銹鋼表面處于穩定鈍化狀態;電位為1.0 V時鈍化膜上誘導點蝕;電位為1.1~1.2 V時,以蝕坑深處腐蝕為主;電位為1.3~1.4 V時,因電位高,新的點蝕在鈍化部位誘導產生。
(3) 點蝕誘導及發生后,電化學阻抗譜主要表征蝕坑處的特征。

