靶向端粒與POT1蛋白的小分子藥物研究進展
尹曉剛
(浙江工業大學,浙江 杭州 310014)
端粒是染色體的保護性末端,存在于真核細胞染色體之中,與端粒結合蛋白一起構成了染色體“帽子”結構[1-2],起著保持染色體完整,控制細胞有絲分裂的作用[3-4]。端粒的功能異常會導致細胞有絲分裂的異常,從而使增殖活性降低,誘導細胞凋亡,是抗腫瘤靶點研究的重要內容。一系列證據表明腫瘤細胞中的端粒能夠以自身為模板,通過活化的端粒酶進行自我復制、延長,是導致腫瘤細胞永生化的主要因素[5]。
端粒是由端粒DNA與端粒復合蛋白相結合的復合結構,端粒復合蛋白(shelterin)在端粒長度調控和保護端粒的DNA損傷反應中起著至關重要的作用。端粒復合蛋白由六種蛋白組成,分別為端粒重復序列綁定因子TRF1、TRF2,TRF1相互作用蛋白TIN2,端粒保護蛋白POT1,TIN2與POT1連接蛋白TPP1,以及受體活化蛋白RAP1[6]。其中對POT1的大量研究中發現:POT1的表達與端粒結構的穩定、端粒懸突G-四鏈體的形成息息相關[7-8]。端粒保護蛋白POT1是一種高度保守的蛋白,由N端懸突結合結構域與C端蛋白結合結構域組成,分別結合端粒末端G-Overhang(端粒3’端懸突結構)與端粒蛋白TPP1,具有維持端粒結構穩定,限制G-Overhang長度等作用。POT1最為重要的作用是能夠誘導G-Overhang反向折回端粒DNA雙鏈結構,將雙鏈其中一段自身鏈置換出來,互補鏈進行配對,形成端粒結構中獨有的D-Loop(Displacement Loop)與 T-Loop(Telomere Loop),將活性的端粒末端DNA隱藏,從而維持端粒結構的穩定。POT1蛋白的缺失或低表達對于維持端粒結構穩定、染色體遺傳穩定性乃至細胞產生重大的影響(Figure 1)。
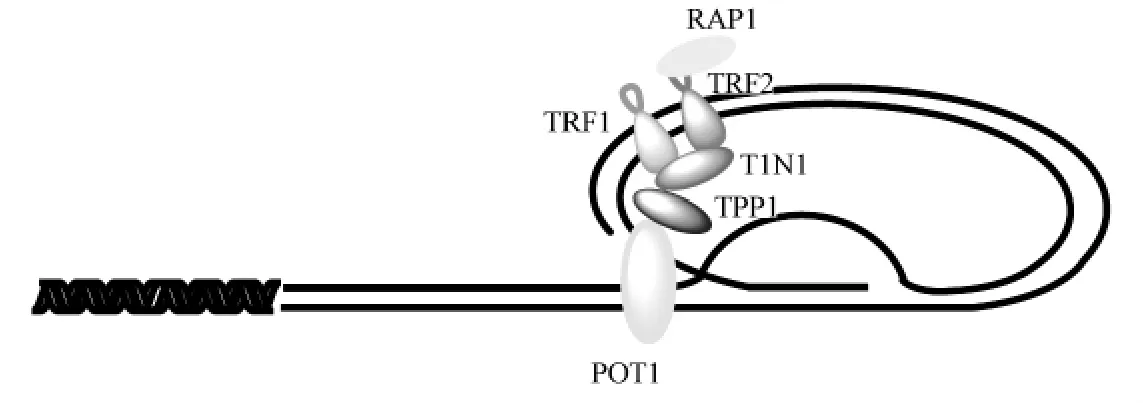
Figure1 The structure of the ternal of telomere
1 POT1蛋白的生物學意義
1.1 POT1蛋白缺失導致端粒結構破壞
存在于端粒末端的蛋白POT1是形成末端結構D-LOOP與T-LOOP的關鍵蛋白,POT1蛋白的缺失將導致D-LOOP與T-LOOP之上的鍵合強度降低,使該結構不穩定,重新轉變為自由單鏈結構,使得通過形成D-LOOP與T-LOOP結構被隱藏起來的端粒3’端懸突結構重新暴露(端粒“脫帽”),導致端粒結構發生破壞。
細胞的遺傳增殖是一個相對保守且穩定的過程,其中端粒的存在作用巨大,是細胞染色體的保護者。當POT1的缺失導致端粒結構發生“脫帽”時,由于G-overhang的暴露,使得細胞中的染色體容易發生自重復與四倍體現象,發生遺傳紊亂。
1.2 POT1蛋白的缺失導致端粒持續性損傷
端粒是細胞染色體中的重要結構部分,端粒的存在在很大程度上調控了細胞的增殖、凋亡、有絲分裂等必要生命活動,端粒的結構變化將對細胞的生命活動產生巨大的影響。
在Churikov D等人關于POT1生物學功能的研究中[9],他們通過構建雌激素受體(ER)-POT1蛋白的復合突變株細胞與野生型細胞的對照中發現,在它莫西芬的作用下,兩組細胞無表現出明顯的區別。而有趣的是,當不受藥物它莫西芬干預時,野生型細胞能夠保持正常生長,而突變株在前24 h細胞數量幾乎無明顯變化,而48 h后出現細胞減少的趨勢,直到無干預后第三天細胞全部死亡。說明當雌激素受體不受到藥物抑制時,能夠正常表達,與POT1蛋白結合,導致POT1功能異常。在進一步探究其作用機制的研究中,他們嘗試在24 h不干預它莫西芬后,開始加入藥物,發現并不能逆轉之前的作用損傷,且對ER蛋白與POT1蛋白進行熒光染色發現,兩者在突變株細胞中表達均明顯下降。說明當POT1下調表達時,導致的端粒結構發生不穩定的過程是不可逆的。
在Kenkichi M等人對于端粒的研究中也發現,當端粒末端結構G-Overhang以自由單鏈形態暴露出來時,細胞自身將進入DNA損傷狀態,大量上調γ-H2AX蛋白表達,致使細胞發生凋亡[10-11]。由于POT1的缺失,使得端粒的結構被破壞而導致的DNA損傷狀態被稱為端粒的持續性損傷,且這個過程是不可逆的。端粒的持續性損傷導致細胞的有絲分裂無法從G2期過渡至M期,使得細胞周期停滯于G2期,在所有對POT1蛋白的研究中發現,構建的POT1缺失的突變株細胞均出現G2-Arrest狀態[9]。
POT1蛋白對端粒結構的完整性與穩定性具有至關重要的作用,并且由于其不可逆的特性,從POT1蛋白表達水平研究靶向端粒結構的抗腫瘤小分子化合物是行之有效的途徑[12-14]。
2 以POT1蛋白為靶點的小分子藥物的發展
2.1 對端粒抑素的研究的發現推動了靶向POT1蛋白小分子的研究
端粒抑素(Telomestatin)是一種天然存在于人體中的小分子(Figure 2),Dennis Gomez 等人[15]發現該化合物是一種有效的G-四鏈體的配體,且能靶向結合于端粒3’端懸突結構,導致其結構的退化。后續的研究發現,這樣的結構變化導致了POT1蛋白無法與端粒DNA相結合,是誘導細胞有絲分裂異常與凋亡的主要因素。
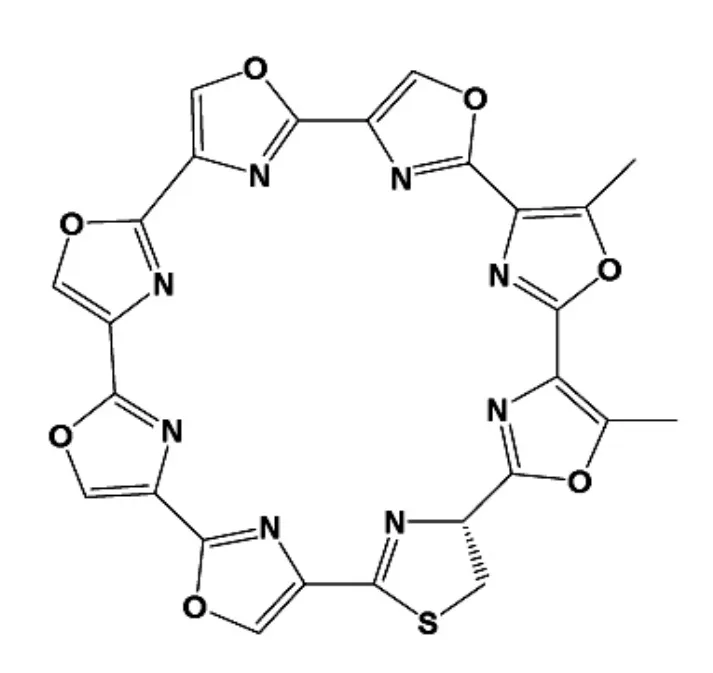
Figure2 The structure of telomestatin.
端粒抑素作用機制的發現,推動了小分子化合物抗腫瘤的新發展。研究發現,通過靶向作用腫瘤細胞中關鍵性序列與蛋白,誘導其構象變化,能夠引發機體強烈應激反應,從而實現腫瘤細胞的增殖抑制與凋亡。該類機制的發現,使抗腫瘤的研究不再局限于免疫應答與基因手段,大大推動了抗腫瘤研究的進展。
2.2 小分子抗腫瘤化合物的發展
20世紀末,對于聚酰胺的研究熱潮以及G-四鏈體形成機制的研究日漸成熟,使得小分子抗腫瘤化合物突破傳統的放療、化療以及免疫治療的壟斷,開拓了一片嶄新的抗腫瘤研究領域。以下重點介紹以小分子化合物誘導G-四鏈體的形成,表現高活性抗腫瘤活性。
在對腫瘤發病的機制研究中,發現這是一個復雜的病變過程,無明確的病變起因。對于各腫瘤細胞的普遍研究中,發現腫瘤細胞之所以能夠實現永生化,主要是由于在胞內高活性的端粒酶的作用下,以其自身為模板,使端粒得以延伸,導致腫瘤細胞能夠無限分裂,所以設計靶向作用于端粒與端粒酶的小分子化合物,能夠實現良好的選擇性。
2.2.1 以端粒末端及POT1蛋白為靶點的G-四鏈體構建作用機制
端粒3’懸突是一段富含鳥嘌呤的序列,在正電荷離子中心的共同作用下,具有共軛大平面結構的小分子化合物能夠嵌插進入端粒末端中首尾通過氫鍵相連的鳥嘌呤構成的G-四分體之中,通過π-π堆積作用,誘導G-四鏈體的形成(Figure 1)。現今,已有報導證實二萘嵌苯、2,7-二取代氨基芴酮、吖啶、乙啡啶衍生物、二取代三嗪,以及最新發現的雙角鯊衍生物等具有共軛大平面結構的小分子能夠成功誘導端粒DNA形成G-四鏈體。
端粒末端DNA在小分子化合物的作用下,被誘導形成特殊二級結構-G-四鏈體,使端粒末端T-環結構與D-環結構受到破壞,將被隱藏的端粒懸突序列重新暴露,使得端粒末端雙鏈結構破壞致使細胞出現端粒持續性損傷。端粒持續性損傷是導致細胞有絲分裂周期出現G2-Arrest,誘導細胞自身凋亡的原因之一,所以以端粒末端為靶點設計能夠誘導其形成G-四鏈體的小分子化合物實現高活性抑制腫瘤增殖是一個行之有效的潛在方法。
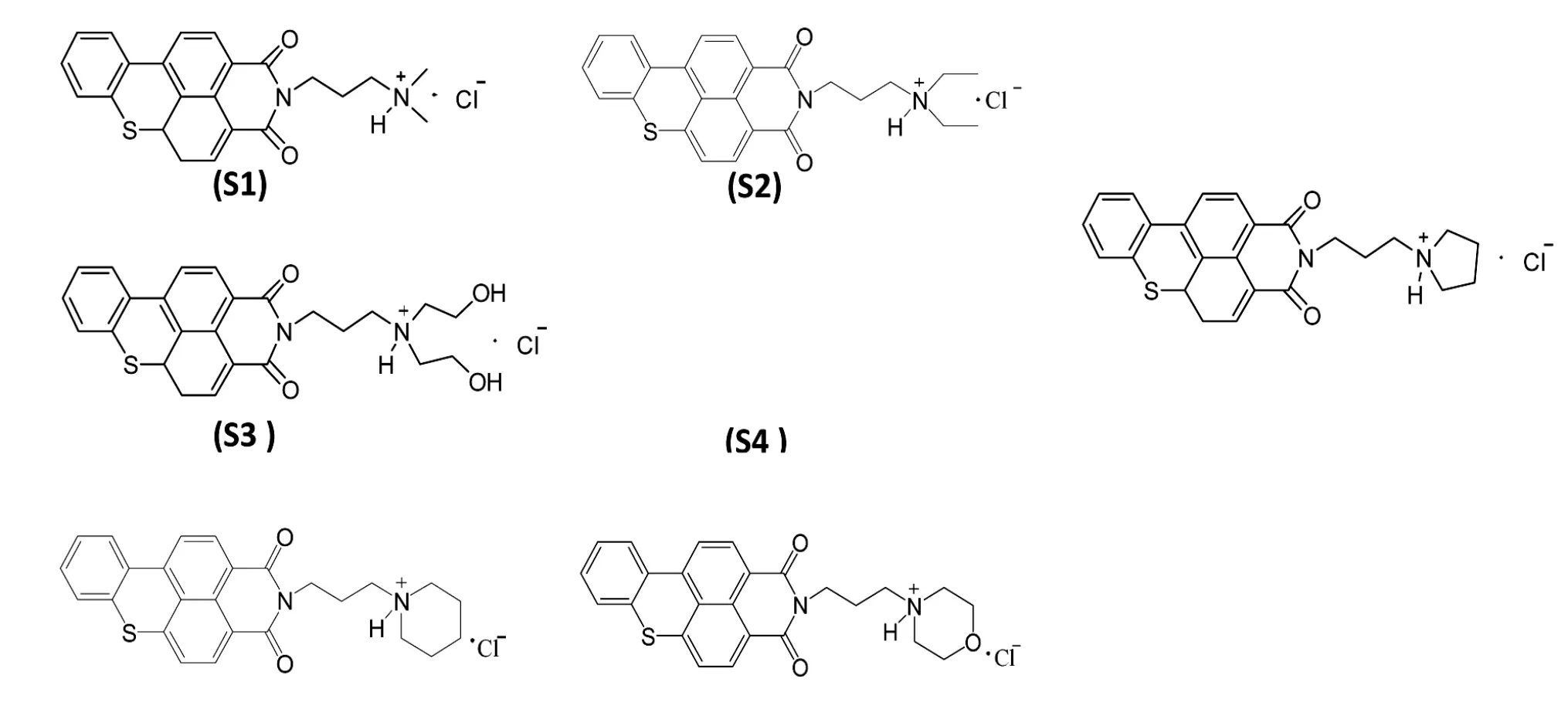
Figure3 The structure of compound benzothioxanthene derivatives S1-S6
2.2.2 共軛大平面化合物誘導G-四鏈體形成機制
在本課題組先前已經報道的研究中[16],已經證實苯并硫雜蒽類衍生物(Figure 3)能夠在細胞外誘導端粒G-四鏈體的形成,并能有效抑制腫瘤細胞增殖,具有良好的抗腫瘤活性。為探究該類化合物誘導端粒DNA形成G-四鏈體的機制,用Discovery Studio軟件進行計算機分子模擬,以抗腫瘤活性最好的三號化合物(S3)為研究對象,對PDB庫中的端粒DNA晶體進行結合模擬。
從結果發現(Figure 4),具有共軛結構的苯并硫雜蒽母環與同為共軛平面的鳥嘌呤與腺嘌呤存在更好的親和力,易嵌插進入腺嘌呤與G-四分體之間的空間,以化合物:DNA=4∶1,2∶1 的比例為主。小分子配體通過與富G之間以π-π堆積作用力為主,氫鍵為輔相結合,結合于腺嘌呤與鳥嘌呤之上,誘導端粒DNA向空間結構更緊湊進行,最終形成特殊二級結構-G-四鏈體。另一方面,化合物中柔性更好的側鏈通過空間折疊,嵌入溝槽結構中,通過其上電負性較強的氮原子與溝槽周邊堿基形成氫鍵,使整個結構更為牢固、緊湊。
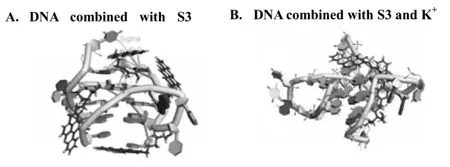
Figure4 The formation of G-quadruplex by computer molecular simulation.
研究表明,在不含正電荷中心K+共同作用時,具有共軛大平面結構的苯并硫雜蒽類衍生物可以輕易地嵌插進入端粒DNA堿基與堿基之間(以腺嘌呤與鳥嘌呤、胸腺嘧啶與鳥嘌呤之間的空間為主),G-四鏈體溝槽之間,通過化合物:核酸=4∶1作用比例,強有力地誘導并穩定G-四鏈體的形成(Figure 4A)。對含有正電荷中心與化合物共同作用,與同一個DNA晶體進行結合模擬發現,結果整個DNA構型發生了有趣的變化,所有相鄰堿基之間的空間縮小,整個DNA表現出更緊湊的構型。此時在正電荷中心K+作用下,化合物與DNA更多以2∶1比例相結合,苯并硫雜蒽化合物π電子受到中心K+牽引,嵌入更加完全,使整個G-四鏈體結構展現更穩定構象(Figure 4B)。
3 結語
對POT1蛋白的研究已較為完善,但卻未能有以其為靶點的高效抗腫瘤藥物的上市。POT1蛋白的存在與端粒末端的穩定息息相關,對兩者的相關研究中,以端粒酶抑制劑為主的抗腫瘤藥物占大多數。由于在之前的研究中,對于以POT1蛋白的治療未能夠跳脫出基因手段,導致了其局限性及進入臨床的困難。新技術的出現固然是抗腫瘤研究中的重要部分,但新思路的形成也同樣重要。研究已久的靶點形成的新作用機制,希望能夠一定意義上推動抗腫瘤研究的發展。

