鞣花酸的生物學效應
吳小磊,鐘晨,史金銘
(東北林業大學生命科學學院,哈爾濱150040)
1 引言
1.1 來源
鞣花酸(ellagic acid,EA)發現于1831年,是一種天然酚類,廣泛存在于各種軟果、堅果等植物組織中,例如核桃[1],草莓[2],葡萄[3],桃子[4]和石榴[5]等。
1.2 化學性質及代謝形式
分子式:C14H6O8
IUPAC命名:2,3,7,8-Tetrahydroxy-chromeno[5,4,3-cde]chromene-5,10-dione
其它命名:4,4′,5,5′,6,6′-Hexahydroxydiphenic acid 2,6,2′,6′-dilactone
結構式:

鞣花酸是沒食子酸的二聚衍生物,是一種多酚二內酯,呈反式沒食子酸單寧結構。它是一種黃色針狀晶體,熔點(吡啶)大于360℃,微溶于水、醇,溶于堿、吡啶,不溶于醚。
鞣花酸通常與葡萄糖,阿拉伯糖,西洛糖等縮合形成糖苷,但更易參與鞣花單寧(Ellagitannin,ET)的形成,植物往往通過水解鞣花單寧產生鞣花酸[6]。在人體中,腸道微量吸收水解鞣花單寧所釋放的鞣花酸,大部分鞣花酸進一步被微生物群落代謝為尿石素[7-9]。這些代謝物具有生物可利用性,也具備生物學效應,所以有人認為尿石素才是機體攝入鞣花酸后產生的真正“有益成份”,是鞣花酸能作為抗癌,抗細胞增殖的活性成分的主要原因[10]。
2 生物學功能
鞣花酸具有多種生物活性功能,如抗氧化[11],抑制增殖[12],誘導凋亡[13],阻斷病毒感染[14],抑制炎癥[15],還可以作為凝血劑[16]等。
2.1 抗氧化作用
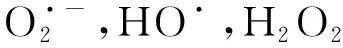
活性氧簇(Reactive oxygen species,ROS)是一類含氧化合物,在體內會損傷核酸,氧化多不飽和脂肪酸和氨基酸,甚至引起炎癥反應等。研究表明,EA降低了ROS水平[20-21],進而降低了ROS對機體所引發的傷害。而在野百合堿誘導的小鼠肺動脈高壓(PAH)模型中,EA處理導致IL-1β、NLRP3等炎癥因子表達降低,同時caspase-1的水平也受到了EA的抑制[22]。綜上來看,EA處理后氧化應激(oxidative stress,OS)的減少是改善整個炎癥反應的前提條件:首先,NLRP3炎性體參與炎癥的多功能細胞因子IL-1β的激活,而ROS的產生是NLRP3激活的中心[23-24];其次,激活的NALP3復合體中的caspase-1(p20)有助于IL-1β的成熟,因此作為上游效應引發者的ROS成為激活caspase-1,IL-1β的關鍵[24-25]。總而言之,EA通過下調ROS,產生了積極的抗炎癥級聯效應。
除了調節ROS水平,EA也對非酶糖基化反應中羰基類氧化毒素的產生有抑制效果。蛋白質羰基化是一種由羰基引起的不可逆的氧化反應,被認為是蛋白質氧化損傷和原纖維形成的重要指標[26]。在山梨酸鉀和葡萄糖對人血清白蛋白影響的研究中,Taghavi等[27]發現,加速原纖維形成的羰基化合物經EA處理而減少,進而影響了人血清白蛋白淀粉樣原纖維的形成,這與其它研究[11,28]結果相一致。具有抗氧化活性的EA終止了氧化反應,進而表現了一種積極的抗纖維化作用。
不僅如此,EA也對抗氧化信號通路產生影響。研究顯示,EA能通過上調Nrf2(Nuclear factor (erythroid-derived 2)-like 2)的表達,產生抗氧化效果,保護HaCaT角質形成細胞免受長波紫外線(ultraviolet A ,UVA)引發的氧化應激的傷害[29];同時,EA對Keap1(Kelch-like ECH-associated protein 1)表達也存在抑制作用[29-31]。從以上實驗結果來看,Nrf2/Keap1信號通路可能是EA調節機體抗氧化的潛在分子機制。機體中,Keap1可以與Nrf2結合,有助于泛素化蛋白酶降解Nrf2[32];當低水平的ROS或者親電試劑作用于Keap1時,Nrf2脫離Keap1并轉運至核中,與Maf蛋白形成一個二聚體,結合到抗氧化劑反應元件(ARE)或親電子反應元件(EpRE)上,調節編碼抗氧化劑和細胞保護酶的基因的表達[33-39]。在整個過程中,Nrf2和Keap1因EA影響的改變對氧化應激的改善非常重要。
首先根據不同模型處理方法對光譜產生的不同影響[9-11],確定原始光譜的化學計量學模型處理方法。實驗先選取6張雷公藤去皮凈制完全后的打粉樣本光譜,經平均得到1張雷公藤凈制完全打粉樣本的平均參考光譜,以其為基礎,在5800 cm-1~5500 cm-1與4400 cm-1~4200 cm-1的特征譜段處進行驗證。實驗選取雷公藤未去皮凈制的打粉樣本2批、去皮凈制完全的打粉樣本2批、未去皮凈制完全的打粉樣本2批,合計6批樣本,各掃描6張,合計36張NIR光譜,對相應相關系數模型進行驗證,求得各6張NIR光譜的平均相關系數),掃描驗證結果如下:
此外,EA還能通過上調谷胱甘肽合成酶、谷氨酸-半胱氨酸連接酶的催化亞基(GCLC)和調節亞基(GCLR)來提高谷胱甘肽水平[40],以及誘導NADPH:醌氧化還原酶,血紅素氧合酶1[41-44],超氧化物歧化酶,過氧化氫酶,谷胱甘肽過氧化物酶,谷胱甘肽轉移酶[21,29,45]等涉及氧化還原反應酶的表達,實現其抗氧化活性。
2.2 放射增敏作用
放射治療是目前對腫瘤細胞治療的主要手段之一,而放射敏感性的增加對于輻射劑量的優化和治療比率的提高有著重要意義。Das等[46]發現EA具有放射增敏效應。EA和γ射線共同處理使與炎癥反應有關的IL-6,COX-2,TNF-α的表達降低,并且導致血管生成標志物基質金屬蛋白酶(Matrix metallopeptidase 9,MMP-9)水平的下降。同時,活性氧簇(ROS)的產生和積累成為細胞凋亡的誘因,克服天然抗氧化劑的防御作用,在癌細胞中誘導氧化應激并對生物分子造成損傷,其中ROS誘導的DNA損傷促使p53易位至細胞核,隨后與細胞周期密切相關的p21表達,細胞周期發生停滯。受EA影響的ROS在放射增敏效應和抗氧化效應中的相反現象可能歸因于研究對象和EA處理濃度的不同。此外,EA和γ射線聯合處理后,細胞出現的磷脂酰絲氨酸(PS)外化和線粒體膜電位(Mitochondrial membrane potential,MMP)的喪失表明細胞凋亡的啟動,而Bax的過表達和caspase-3的活化表明細胞凋亡的發生。EA提高了ROS水平及凋亡相關因子的水平,這與Bhosle等[47-48]的研究發現一致,它們為EA作為放射治療的輔助手段提供了實驗依據,對臨床用藥有一定的指導意義。
2.3 抗增殖作用和促凋亡作用
化學合成藥物可通過抑制增殖、促進凋亡來有效地治療癌癥,但這往往有很強的副作用。近幾年的研究發現包括鞣花酸在內的一些天然活性物質[49-51],具有抗增殖、促凋亡的特性。
Hong等[12]發現,EA抑制MCF-7乳腺癌細胞的增殖且使細胞主要在G0/G1期發生停滯,效果呈時間和劑量依賴性。EA處理24h后, cDNA微陣列的分析結果預示了對TGF-β/Smads信號傳導途徑有調節作用的16個基因(TGF-β1,TβR-Ⅰ,TβR-Ⅱ,Smad3,p-Smad3,Rb1,p-Rb1等)有明顯變化,也正因此,TGFβ/Smads信號通路被認為是鞣花酸調控乳腺癌細胞周期阻滯的潛在分子機制。其中,由轉化生長因子-β(TGF-β)攜帶的細胞因子信號將通過I型和II型絲氨酸/蘇氨酸激酶受體(TβR-I和TβR-II)的異源性復合物來傳遞,配體結合導致受體復合物激活,進而導致TβR-II對TβR-Ⅰ的磷酸化。隨后磷酸化TGF-β信號的胞內轉導物Smads(R-Smads),磷酸化的R-Smads與Smad4相關聯,進入細胞核,之后與大量的轉錄因子相互作用產生相應的生物學功能[52-55]。EA對TGFβ/Smads信號通路中相關因子的調控將直接影響與TGFβ/Smads相關的細胞周期。
除了TGFβ/Smads信號通路,PI3K/Akt(磷脂酰肌醇3-激酶/蛋白激酶B)信號通路也與細胞存活和凋亡之間的平衡緊密相關[56-57],被認為是EA處理結腸癌細胞引發生物學效應的潛在靶點。EA處理使細胞在G2/M期停滯,顯著降低活化的PI3K,p-Ak(能滅活前caspase-9,阻斷caspase-9參與的凋亡),Bcl-2,DNA聚合酶的輔助因子PCNA,細胞周期蛋白D1的水平,而Bax,cytc及caspase-3表達的增加,顯示出EA抗增殖作用和細胞毒性[58]。該信號通路關鍵蛋白PI3K和Akt的失活促進了與細胞凋亡相關基因(caspase,p53等)的表達,這與許多多酚可調節Akt途徑的研究相一致[51,59-60]。目前的研究結果表明,EA在誘導細胞凋亡方面有累加效應[61]。
2.4 抗炎作用
近幾年研究發現,大多數植物來源的次級代謝產物能夠直接影響炎癥介質、第二信使、轉錄因子等產生來實現抗炎作用[64-65]。Alexandre等[15]在卵清蛋白誘導的小鼠哮喘模型中研究鞣花酸在過敏性肺部炎癥中的療效。結果表明,鞣花酸減少了嗜酸性粒細胞的數量,抑制了細胞募集和細胞因子(IL-4、IL-5、IL-13)的表達并呈時間和劑量依賴性,而且降低了白細胞浸潤現象。研究者推測,由于鞣花酸抑制了激活蛋白1(AP-1)[66]和NF-κB[67],所以嗜酸性細胞的招募和細胞因子的產生才得到抑制。
許多粘附分子在炎癥過程和免疫應答中也發揮著重要作用[68],EA對炎癥的調節作用也在這些方面有所體現[69]在核桃(JuglansregiaL.)中鞣花酸對內皮細胞抗炎效應的研究中發現,在不影響細胞增殖速率的條件下,由炎性細胞因子TNF-α激活的血管細胞粘附分子-1(VCAM-1)和細胞內細胞粘附分子-1(ICAM-1)在實驗中受到鞣花酸的抑制,這種效應可能影響某些疾病的發生。細胞粘附分子表達和活化的增加刺激了白細胞募集到血管內皮中,這是動脈硬化發病機制中的重要步驟[70],因此粘附分子是臨床中潛在的治療靶點。而鞣花酸對粘附分子的抑制現象不僅體現了其抗炎作用,而且為其具有潛在的抗動脈硬化能力提供了實驗依據。
不僅如此,EA的抗炎作用在組織實驗中也得到了很好的驗證。Mohammad等[71]發現,全身施用EA可以降低一氧化氮(Nitric Oxide,NO)(只降低血清中,對爪組織中NO無影響)水平,減少多形核白細胞遷移到炎癥部位,最終大鼠炎癥爪水腫得到緩解且效果呈劑量依賴性。受到EA抑制的NF-κB引起下路的誘導型一氧化氮合酶(iNOS),促炎細胞因子TNF-α,IL-1β的表達水平下調,同時iNOS的產物NO下降[72]。由于L-精氨酸-NO途徑參與EA對醋酸引起內臟疼痛的鎮痛作用[73]以及EA可通過下調iNOS來抑制NO的釋放[74],所以推測這種抗炎作用可能與L-精氨酸-NO途徑受到影響有關。而MDA和血漿中的AST和ALT酶的降低[71]預示EA的抗炎作用可能部分歸因于其抗氧化活性。
除此之外,EA還可以減少促炎、促纖維化的細胞因子(IL-1α,IL-6,IL-8,TNF-α和TGF-β)的表達,進而減少酒精誘導的炎癥反應發生和纖維的產生[75-76]。
2.5 抗病毒作用
在一些研究中,鞣花酸的抗病毒活性也得以發現[77-78]。Promsong等[14]研究了鞣花酸對HIV-1復制的影響。他們的結果表明,鞣花酸抑制了HIV-1整合酶的表達,進而抑制了HIV-1的感染。而且不論HIV-1感染前后,鞣花酸都表現出抑制作用,可能意味著鞣花酸可以抑制HIV-1早期和晚期復制。鑒于抑制整合酶而呈現出顯著的抗HIV-1活性,鞣花酸有望作為新型的抗HIV藥物。
在其它病毒中,EA呈現不同機制的抗病毒作用。HBx是一種多功能的細胞信號轉導和轉錄途徑調節劑,參與乙型肝炎病毒(HBV)復制過程[79]。Pathak等[80]確定EA抑制病毒復制時HBx誘導的轉錄激活。所以,EA可以降低HBV感染細胞中HBeAg(一種乙型肝炎病毒蛋白)的分泌[81-82],減少HBeAg在血清中的積累,進而阻斷了HBeAg引起的免疫耐受[83]。而在丙型肝炎病毒(HCV)中,非結構蛋白NS3具有解旋酶和NTPase活性,再與輔因子NS4A結合組成主要的病毒蛋白酶NS3/4A,而NS5B是RNA依賴的RNA聚合酶,參與病毒RNA的復制。Reddy等[84]和Ajala等[85]證明EA在體外能抑制NS3/4A蛋白酶活性,最終通過減少NS5B活性和HCV中RNA水平,表現出EA對HCV的抗病毒作用。
3 結束語
鞣花酸是一種天然存在的多酚化合物,與石榴等的保健功能密切相關。鞣花酸的結構功能、理化性質等不斷被挖掘,其存在潛在的藥理學特性一直是研究的熱點。雖然鞣花酸的抗氧化,抗增殖,抗病毒等機制被揭示,但目前無法將其投入到疾病治療中,還需要進一步臨床實驗評估鞣花酸及其代謝物的藥理學作用。此外,鞣花酸生物利用度低也是阻礙其應用的主要問題之一,尿石素及其衍生物的開發利用或許有助于改善這一狀況,以鞣花酸為本體修飾產生的衍生物已被用作生物膜形成的理想抑制劑[86]。鞣花酸的生物學效應的研究對癌癥治療和化學預防具有重大意義。相信隨著對鞣花酸研究的深入,鞣花酸將在疾病治療、美容保健等方面表現出積極作用。

