Cr(VI)鹽脅迫對小麥幼苗抗氧化酶活性的影響
王 琦,李桂玲,王金水
(河南工業大學 生物工程學院,河南 鄭州 450001)
鉻(Chomium,Cr)是重金屬污染源中工業五毒(鉻、鉛、汞、鎘和砷)之一,但低濃度Cr對植物生長發育有一定促進作用,而高濃度Cr將導致作物生長受抑制[1]。近年來,隨著印染、電鍍、化工等行業的發展,過量Cr隨被污染的灌溉水進入農田生態系統,對作物種子萌發和幼苗生長造成危害,導致農作物減產,甚至死亡[2-3],直接或間接危害人類健康[4]。由于Cr對農作物的毒害及其在陸地及水體生態系統中的轉移轉化[5-6],使得Cr的毒害作用逐漸受到重視。六價鉻〔Cr (VI)〕對作物的毒性遠遠超過三價鉻〔Cr (III)〕[7-8],有研究表明,Cr (VI)在小麥幼苗中的累積能力大于Cd2+和Pb2+ [9-10]。植物體內的活性氧 (Reactive oxygen species,ROS) 代謝與抗逆性有著密切關系,ROS包括H2O2、超氧陰離子自由基 (O2·-)和OH-等,逆境脅迫下植物體內會產生大量的H2O2、O2·-、OH-等活性氧自由基,導致膜脂過氧化,進而造成膜系統的氧化損傷[11-12]。植物體內也存在著一系列酶促和非酶促抗氧化劑來消除活性氧自由基,保護植物細胞免受活性氧傷害,維持膜系統穩定性,以增強植株抗逆性[13-14]。在小麥抗氧化脅迫中,超氧化物歧化酶(SOD)響應多種脅迫,能夠專一地清除超氧陰離子自由基 (O2·-),是一種廣泛的保護性抗氧化酶[15];過氧化氫酶(CAT)和過氧化物酶(POD)主要作用是引起H2O2分解成H2O和O2,減少H2O2對植物造成的傷害[16-17]。小麥種子萌發和幼苗生長對于小麥產量至關重要,萌發關鍵酶α-淀粉酶和抗氧化關鍵酶SOD、POD和CAT的活性變化則直接影響小麥種子萌發和幼苗正常生長[18]。筆者所在實驗室前期研究Cr (VI) 脅迫下小麥種子萌發和萌發關鍵酶α-淀粉酶的生理響應表明,Cr (VI) 脅迫下,淀粉酶的活性在一定濃度范圍內呈劑量效應,Cr (VI) 臨界值濃度為18 mg/L,小麥種子萌發關鍵形態學指標(胚芽和胚根生長)變化可能是通過淀粉酶對鉻脅迫響應實現[8,19]。為了進一步揭示小麥種子萌發和幼苗生長過程中抗氧化關鍵酶SOD、POD和CAT對Cr (VI) 脅迫的生理響應機制,以溫麥6號為材料,采用水培法培養,研究不同濃度梯度Cr (VI) 脅迫培養后小麥種子萌發情況以及SOD、POD和CAT酶活性,旨在從抗氧化酶活性角度解釋重金屬Cr (VI) 脅迫對小麥種子萌發和幼苗生長的影響機理。
1 材料與方法
1.1 試驗材料
供試小麥品種溫麥6號,種子購于河南省農業科學院。分析純重鉻酸鉀〔K2Cr2O7,Cr (VI)〕,購于華美生物工程公司。
1.2 試驗方法
1.2.1 小麥種子培養 挑選大小均一、籽粒飽滿的小麥種子,先用5%的H2O2處理5 min,用蒸餾水沖洗3~5遍,再加蒸餾水超過種子最上層2 cm左右,浸種12 h。將小麥種子腹溝向下排列在鋪有雙層濾紙的培養皿中,每皿40粒,每粒種子間距均勻,以防止發霉種子對健康種子的感染。
1.2.2 試驗設計 以K2Cr2O7不同培養濃度為試驗對象,設置13個濃度梯度處理(3 mg/L、5 mg/L、10 mg/L、15 mg/L、17 mg/L、18 mg/L、19 mg/L、20 mg/L、25 mg/L、30 mg/L、35 mg/L、40 mg/L和45 mg/L)對小麥種子進行培養,每個濃度梯度均設6個重復,對照為蒸餾水培養。在培養皿中加入不同梯度濃度K2Cr2O7溶液各5 mL,置25℃光照培養箱中培養。其中,3個重復培養時間為3 d,用于根長和芽長測量;另外3個重復培養6 d,用于根長和芽長及抗氧化酶活性測定。
1.3 抗氧化酶液的制備和活性測定
1.3.1 超氧化物歧化酶(SOD) 小麥種子培養6 d后,取幼苗葉片0.500±0.005 g,放入預冷研缽,先加PBS緩沖液2.5 mL (pH 7.8,50 mmol/L)研磨勻漿,再加入PBS2.5 mL 混勻。4℃ 10 000 rpm離心30 min,上清液即為粗提取液,低溫貯藏備用。采用氮藍四唑(NBT)光化還原法測定SOD酶活性[20]。
1.3.2 過氧化氫酶(CAT) 稱取培養6 d的小麥相同部位的葉片或根,用蒸餾水洗凈,吸干水分,稱鮮重。稱取1 g,置預冷研缽中,加入2~3 mL 4℃下預冷的pH7.8的磷酸緩沖液和少量石英砂研磨成勻漿后,轉入10 mL容量瓶中,并用緩沖液沖洗研缽體數次,合并沖洗液,定容至10 mL,4 000 rpm離心15 min,上清液即為CAT酶粗提液,4℃下保存備用。采用紫外吸收法在240 nm處測定CAT酶活性[21]。
1.3.3 過氧化物酶(POD) 稱取培養6 d的小麥相同部位的葉片0.5 g,加入0.2 mol/L(pH 6.0)磷酸緩沖液2.5 mL,于研缽中研磨成勻漿,用磷酸緩沖液定容到10 mL,4 000 rpm離心15 min,上清液即為粗酶提取液,低溫保存備用。采用愈創木酚法測定POD酶活性[21]。
1.4 數據處理和分析
利用Excel 2016軟件將所測得的數據進行成組數據T檢驗統計分析。
2 結果與分析
2.1 Cr(VI)處理對小麥種子芽長和根長的影響
2.1.1 小麥胚芽 從圖1看出,不同濃度Cr (Ⅵ)處理小麥種子3 d后,低濃度處理的小麥胚芽長度略高于對照,高濃度處理比對照低。與對照相比,Cr (Ⅵ) 濃度為3~15 mg/L促進小麥胚芽生長,其中以濃度10 mg/L的處理極顯著高于對照;當Cr (Ⅵ) 濃度18 mg/L時,小麥胚芽與對照基本相同;Cr (Ⅵ)濃度為 20 mg/L時,小麥種子胚芽生長受到極顯著抑制;隨 Cr (Ⅵ) 濃度繼續升高,受抑制程度更為嚴重,當處理濃度在30 mg/L時,小麥種子芽長僅為對照的85%左右。處理6 d與處理3 d的小麥胚芽生長總體趨勢一致(圖2)。因此,推測18 mg/L的Cr (Ⅵ) 處理濃度為影響小麥種子萌發和幼苗生長的閾值。
2.1.2 小麥胚根 從圖1看出,萌發3 d和6 d的小麥胚根生長均受Cr (Ⅵ)抑制,且抑制效果均達極顯著水平。說明,不同濃度 Cr (Ⅵ) 處理后,小麥胚根的生長狀況與胚芽不同,Cr (Ⅵ) 對小麥種子胚根生長的抑制作用明顯大于胚芽。高濃度(18 mg/L以上)Cr (Ⅵ) 處理時,濃度越高,抑制效應越強,Cr (Ⅵ) 濃度在25~30 mg/L時,處理組根長較對照組低60%以上。
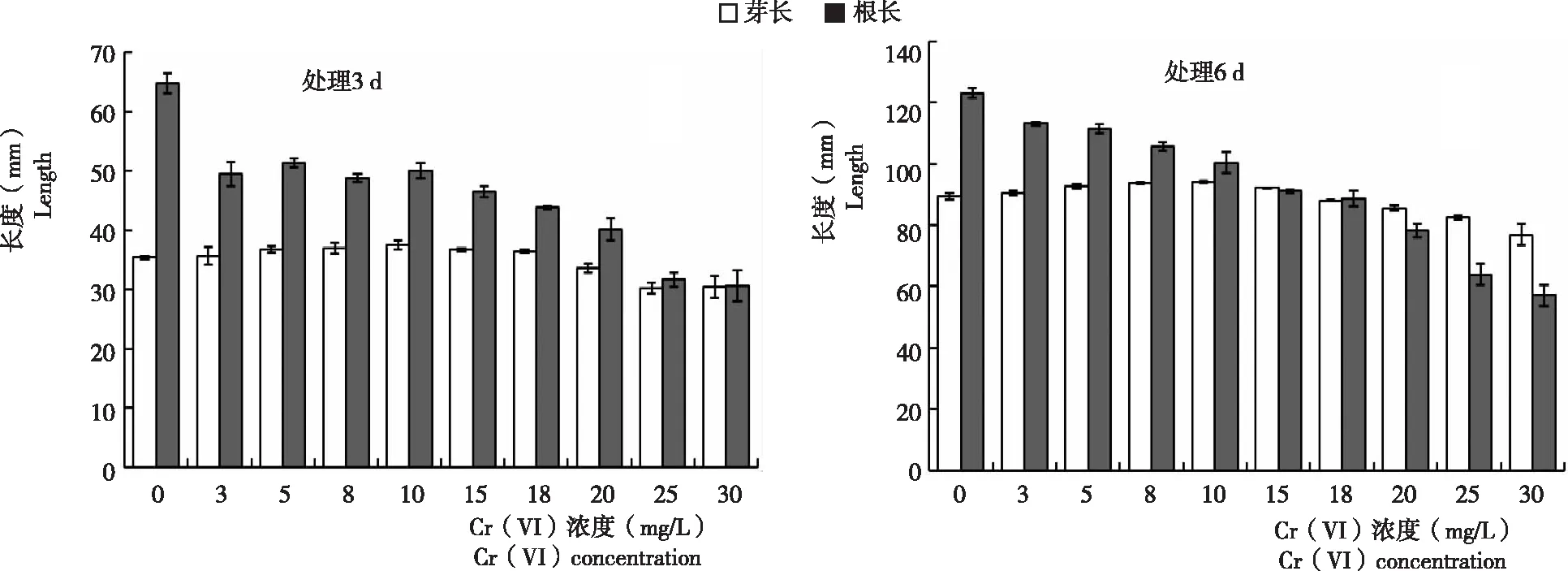
圖1 不同濃度Cr(VI)處理小麥種子3 d和6 d小麥胚芽和胚根變化Fig.1 Variation in germ and radicle of wheat seeds treated with different concentration of Cr (Ⅵ) after 3 d and 6 d
2.2 Cr(VI)脅迫培養對小麥幼苗SOD、CAT 和POD 酶活性的影響
從圖2可看出,SOD、CAT和POD酶活性隨著Cr (VI) 濃度變化而變化。
2.2.1 SOD酶活性 Cr (VI) 濃度為3 mg/L時,小麥葉片SOD活性處理組與對照組無顯著變化;15 mg/L時酶活性最高,較對照升高66.91%;隨著Cr (VI) 濃度進一步提高,SOD酶活性開始下降,當Cr (VI) 濃度在20 mg/L時,處理組與對照組酶活性幾乎相同或略有降低;當Cr (VI) 濃度在25 mg/L以上,SOD酶活性顯著下降。Cr (VI) 濃度達45 mg/L時,SOD酶活性僅為對照的68.67%,此時表明植物受到Cr (VI) 脅迫后傷害嚴重。
2.2.2 CAT酶活性 Cr (VI) 濃度在3~5 mg/L時,小麥葉片CAT酶活性較對照組略有增加,但差異不顯著;Cr (VI) 濃度為15 mg/L時,酶活性達最大,比對照增加6.7%;Cr (VI) 濃度為18 mg/L時,酶活性與對照組幾乎相同,當Cr (VI) 濃度增加至19 mg/L以上時,CAT酶活性逐漸降低。
2.2.3 POD酶活性 Cr (VI) 濃度3 mg/L時小麥葉片POD酶活性略微下降,隨后逐漸上升,在Cr (VI) 濃度15 mg/L時出現峰值,較對照提高52.6%。隨著Cr (VI) 濃度繼續增大,酶活力逐漸降低,Cr (VI) 濃度在18 mg/L時,POD酶活性與對照組幾乎相同,Cr (VI) 濃度在19~45 mg/L時,POD酶活性逐漸降低,此時POD活性受Cr (VI) 脅迫影響最大。
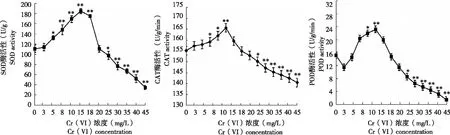
圖2 不同濃度 Cr(VI)處理小麥種子6 d小麥葉片的 SOD、CAT和 POD酶活性Fig.2 Leaf SOD,CAT and POD activity of wheat seeds treated with different concentration of Cr (Ⅵ) after 6 d
3 結論與討論
植物生長過程中不斷遭受環境脅迫,在長期的進化過程中,植物通過與環境相互作用,形成相應的防御系統,一方面通過形態結構變化進行防御,另一方面,從生理生化上進行改變以提高防御能力。抗氧化酶系統是研究逆境脅迫下植物抗逆機理的重要內容。本研究以溫麥6號為材料,采用水培法研究小麥幼苗生長過程中抗氧化酶(SOD、CAT和POD)對重金屬Cr (VI) 脅迫的響應,結果表明,對小麥種子萌發和幼苗生長影響的Cr (VI) 濃度閾值是18 mg/L,即Cr (VI)濃度低于18 mg/L 時促進小麥種子萌發和幼苗生長,高于18 mg/L則起抑制作用;Cr (VI) 對小麥根生長的抑制作用大于對芽生長的抑制。小麥SOD、CAT和 POD酶活性對Cr (VI) 脅迫響應低濃度范圍內呈劑量效應,臨界值濃度均在18~20 mg/L,即低濃度Cr (VI)促進抗氧化酶活性,高濃度則抑制酶活性。
不同重金屬離子對植物的抗氧化酶活性的影響存在差異,這可能與植物對不同重金屬離子響應和耐受性程度不同有關。當植物受到重金屬脅迫時,通過抗氧化酶系統清除體內過多的活性氧是植物對抗重金屬脅迫的重要機制之一[22]。田保華等[2]研究表明,隨著Cr6+/Cd2+濃度升高,谷子根和葉片中NADPH氧化酶活性顯著增強,高濃度Cd2+、Cr6+可導致POD、CAT和抗壞血酸過氧化物酶(APX)活性顯著升高,編碼NADPH氧化酶基因SirbohD-F表達升高;而SOD酶活性則表現出低濃度增加高濃度下降趨勢,SOD酶活性變化趨勢與本研究結果相似。劉鳳等[23]研究發現,Cd2+對于小麥根的毒性較強,根對重金屬污染脅迫響應較敏感,小麥的根長顯著受抑制,Cd2+脅迫時小麥抗氧化酶活性顯著升高,這是Cd2+脅迫下小麥的一種防御機制。馮旭等[24]研究表明,Cr3+脅迫顯著影響葎草雌雄幼苗的SOD、POD、CAT酶活性,總體上呈低濃度促進、高濃度抑制趨勢,與本研究抗氧化酶活性響應重金屬Cr (Ⅵ) 變化的趨勢一致。趙慶芳等[25]研究認為,Zn2+脅迫下小麥SOD酶活性呈先降低后升高,POD活性則明顯受到抑制,CAT活性在Cu2+或Zn2+脅迫下均表現出下降趨勢,Cu2+脅迫下小麥SOD活性呈升高的趨勢,而POD活性呈先升高后下降的趨勢。萬永吉等[26]研究表明,秋茄POD活性隨著Cr (Ⅵ) 離子濃度提高而逐漸降低。何俊瑜等[27]研究表明,小麥SOD酶活性隨著Cd2+濃度升高而升高,CAT和APX酶活性則呈下降趨勢。
筆者所在的實驗室前期研究發現,低濃度Cr (Ⅲ) 離子和Cr (VI)促進小麥種子萌發和淀粉酶活性提高,高濃度則抑制[8,28]。本研究進一步分析重金屬Cr (VI)脅迫對小麥幼苗生長過程中抗氧化酶活性的影響,結果發現,重金屬Cr (VI) 在低濃度范圍內,促進抗氧化酶活性,使植物免受重金屬Cr (VI)的傷害。高濃度重金屬Cr (VI) 脅迫時,清除重金屬Cr (VI) 脅迫產生ROS的酶活力較低,造成植物受重金屬傷害。由此可見,低濃度的Cr (VI) 可提高SOD活性來消除ROS,使其處于相對較低水平,而脅迫后期積累的ROS則由POD和CAT酶分解,這種協調作用在一定程度上可減輕重金屬對小麥幼苗造成的傷害。因此,重金屬Cr (VI) 對小麥幼苗生長的影響是通過抗氧化酶對重金屬的響應實現的。

