抗體親和肽配基的高通量篩選和理性設計
劉夫鋒,李 麗
(1. 天津科技大學生物工程學院,天津 300457;2. 天津科技大學海洋與環境學院,天津 300457)
抗體又稱免疫球蛋白,是由動物血液和組織液中B淋巴細胞分泌的一種特殊的可溶性糖蛋白.抗體可與相應抗原進行高親和性和特異性的結合,這一特性是抗體在生物技術和醫療領域廣泛應用的理論基礎.靶向性強、特異性高和毒副作用小等優點使得抗體已被廣泛應用于自身免疫性疾病、癌癥和眼科等多種疾病的治療[1].經過20余年的發展,抗體已成為最成功的醫藥之一[2].抗體藥物包括多種類型,如單克隆抗體、雙特異性抗體、抗體片段和抗體偶聯物等.而單克隆抗體是研究最為成熟及應用最為廣泛的抗體藥物.單克隆抗體指由單一 B細胞克隆產生的高度均一、僅針對某一特定抗原表位的抗體.2017年藥物銷售額排行榜前 100名中,抗體藥物占了 21名.表1列出了全球銷售額占前10名的抗體藥物.據不完全統計,2020年抗體的全球市場會超 1250億美元[1,3].
抗體含對稱的四條多肽鏈.其中相對分子質量較小(2.5×104)的兩條稱為輕鏈,約含 250個殘基;另外兩條相對分子質量較大(5.0×104~7.5×104)的稱為重鏈,含 450~550個殘基.輕鏈和重鏈之間通過四對二硫鍵相連接形成 Y型結構(圖 1).抗體 N-末端序列變化較大,因此該區域被稱為可變區,又稱Fab片段.Fab片段是抗體與抗原結合的主要部位,其結合抗原的部位在 VL及 VH 功能區的可變區.相對 Fab、Fc片段在同一種屬動物中是比較恒定的,且其不能與抗原結合,因此一般作為親和配基的結合位點.目前,抗體分為 IgG、IgM、IgA、IgD 和 IgE五大類.其中IgG 是血清中主要的抗體成分,約占血清抗體的75%.IgG又進一步分為IgG1、IgG2、IgG3和IgG4這四個亞類.
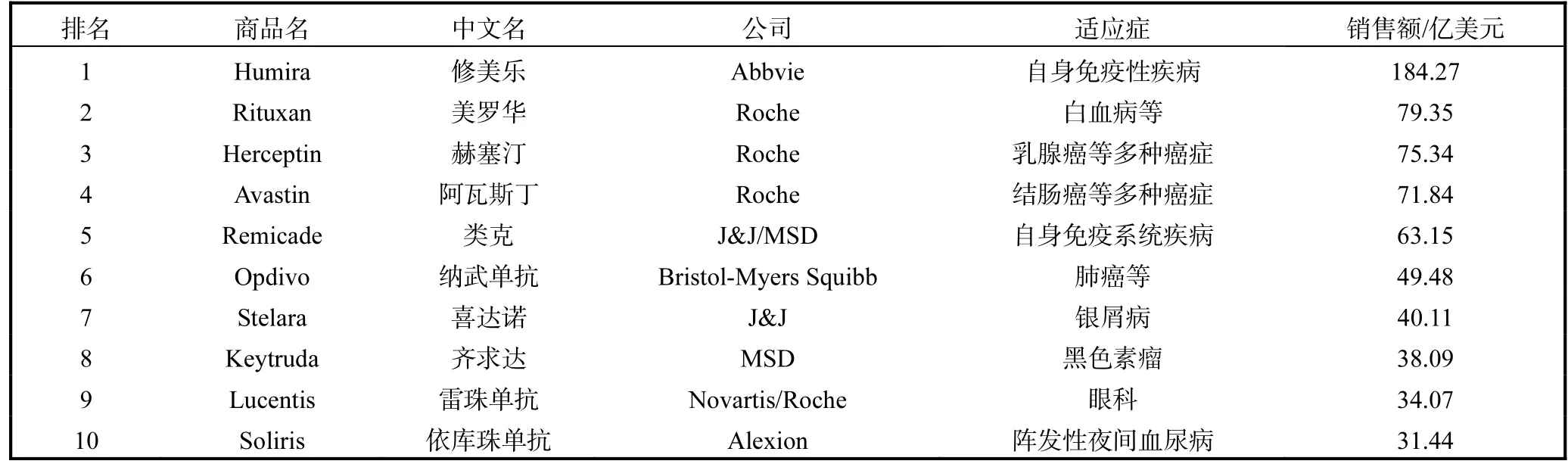
表1 2017年全球銷售額排名前10位的抗體藥物的相關信息Tab. 1 Top 10 global sale antibodies in 2017
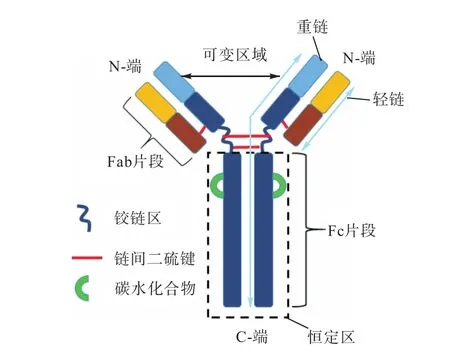
圖1 單克隆抗體的結構示意圖Fig. 1 Structure of a monoclonal antibody
由于抗體表達的復雜性以及醫用抗體的高品質要求,抗體純化已成為抗體生產過程的關鍵步驟之一[4-5].目前,抗體純化常用的分離方法主要有離子交換色譜、疏水作用色譜、凝膠過濾色譜和親和色譜等[6-7].其中親和色譜因其對抗體的高特異性已成為抗體純化最常用的色譜方法之一.親和色譜利用固定化配基和目標抗體之間的特異性和可逆的親和作用,從復雜的生物樣品中分離純化目標抗體.由于親和配基僅能特異性結合目標抗體,因此親和色譜具有非常高的選擇性和純化效率[8].此外,親和色譜還具有條件溫和、操作簡單和保證分離的蛋白質性質穩定的優點[9-11],因此特別適用于含量少且穩定性低的抗體的分離[12-13].
篩選和選擇親和配基是構建有效親和色譜分離體系的先決條件[14].一旦開發獲得合適的親和配基,利用親和色譜技術一步就能夠使目標抗體的粗提液提純幾百甚至上千倍.因此,開發合適的親和配基是利用親和色譜分離純化抗體的首要問題.理想的抗體親和配基應具有以下四個特點:與抗體有適當的親和力,從而在吸附過程中特異地吸附目標抗體且在洗脫過程中易于解離;易于大規模制備和固定到色譜介質上;有足夠的生物和化學穩定性,從而能夠耐受親和色譜的洗脫和再生等操作條件;不易被降解、不易脫落而污染抗體產品等.
隨著親和色譜技術在抗體分離純化中的廣泛應用,目前已開發出多種類型的親和配基,如蛋白質、染料、過渡金屬離子和短肽等[15].抗體的蛋白質配基主要指自然界中存在的與抗體之間具有很高的親和性和特異性(結合常數為 108~109L/mol)的蛋白質,如抗原、凝集素和細菌細胞壁的免疫結合蛋白質(如葡萄球菌蛋白A、蛋白G、蛋白L、蛋白H和蛋白M)等[15-16].雖然蛋白質配基有高特異性,但這些配基存在價格昂貴、吸附容量小、化學穩定性差和易生物降解等缺點而難以大規模重復使用[17].與蛋白質配基相比,染料(如三嗪類和蒽醌等)和過渡金屬離子(如Ni2+、Zn2+、Cu2+和 Co2+等)具有價格便宜、化學穩定性好且能夠承受較苛刻的洗脫條件,但這些配基的選擇性不高[18],且通常有毒,這進一步限制了它們在抗體分離純化中的應用[19].
1986年 Geysen等[20]首次提出的親和短肽配基能夠彌補上述三類配基的缺點.肽配基指由少數幾個關鍵氨基酸殘基組成,且與目標蛋白之間存在較強的親和作用力的短肽.因此,抗體的親和短肽配基具有以下四個優點:與抗體之間有足夠高的親和性;具有較好的理化穩定性;由于是小分子質量的短肽,即使不慎脫落進入抗體產品中也不易引起免疫和中毒反應;短肽配基與抗體之間的親和性適中,在洗脫過程中不需引入苛刻的洗脫條件,從而避免洗脫過程中抗體變性.但因自然界中與抗體具有較高親和性的短肽數量有限,如何尋找高親和性的多肽配基就成為制約利用親和色譜技術純化抗體的關鍵問題.本文結合作者的前期研究工作,簡要綜述了抗體親和短肽配基的篩選、理性設計與應用方面的進展.
1 抗體親和短肽配基的高通量篩選
由于自然界中的短肽含量很少,目前最常用的獲取親和短肽配基的方法就是從肽庫中篩選.近年來,快速發展的組合化學、噬菌體展示和核糖體展示技術均為快速構建大容量肽庫奠定了堅實的基礎.同時,高通量快速篩選技術的發展也使從大容量肽庫中篩選獲得高親和性肽配基成為了可能.利用目標抗體篩選相應的肽庫,可以獲得與該抗體有一定親和力的短肽配基.
1.1 組合化學合成肽庫篩選技術
組合化學合成肽庫篩選技術是利用組合化學技術將氨基酸按隨機組合方式進行酰胺反應,從而在短時間內就可獲得含有所有可能氨基酸序列的多肽庫[21].然后再用待分離的抗體為靶標,從上述組合化學合成肽庫中篩選出與該目標抗體具有較高親和性的短肽[22].理論上利用組合化學合成技術可以非常容易地獲得具有所有排列組合的短肽序列.因利用組合化學技術獲得的短肽之間具有盡可能大的差異性和化學多樣性,利用該技術來篩選短肽配基就引起了研究者的關注與重視,表2列出了部分應用組合化學肽庫技術篩選獲得的親和短肽配基.Yang等[23]從線性六肽庫中經過三輪篩選獲得親和短肽配基HWRGWV,并利用該配基從哺乳動物培養液中純化獲得人 IgG.為了提高合成效率同時降低篩選工作量,Frank[24]開發了單點多肽陣列合成技術來替代傳統的固相和液相多肽合成技術,從而使高密度合成短肽成為現實.Sugita等[25]利用該技術篩選獲得了鼠源和人源抗體的八肽配基NKFRGKYK和NARKFYKG,然后利用這些短肽配基從細胞培養液中分離獲得了抗體.為了克服線性短肽易于被體外降解的缺點,一些穩定性較高的多聚肽段被開發出來用于抗體的親和配基.例如,Fassina等[26-27]通過三輪篩選從組合肽庫中獲得一個多聚短肽配基(RTY)4K2KG. 然后利用固定化該配基的色譜柱純化獲得了不同來源的 IgG,并取得了良好的分離效果.

表2 應用組合化學肽庫技術篩選獲得的親和短肽配基Tab. 2 Some peptide affinity ligands for antibody purification using combinatorial peptide library
1.2 噬菌體展示肽庫篩選技術
噬菌體展示技術是近年發展起來的利用噬菌體表達外源基因的一項新技術[34-35].該技術以噬菌體(如 M13、λ和 T4等)為載體,首先把化學合成的隨機核苷酸序列與噬菌體外殼蛋白的基因相融合,然后再將對應于上述隨機核苷酸序列的短肽展示于噬菌體表面.隨后利用待分離的抗體分子為靶標,利用多輪篩選方法獲得與該目標抗體具有較高親和性的多肽,最后通過測序技術獲得展示在噬菌體表面的與目標抗體具有較高親和性的短肽序列(圖2)[36].綜上所述,噬菌體展示技術是一種利用生物技術快速構建隨機組合肽庫的常用方法[37].
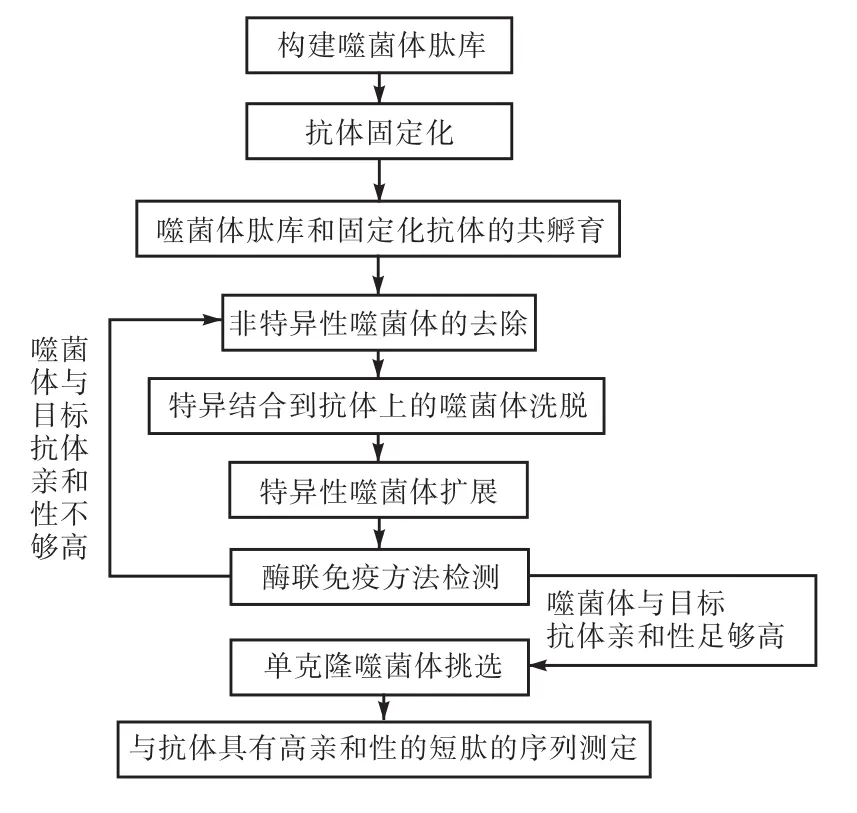
圖2 噬菌體展示肽庫篩選多肽的流程Fig. 2 Screening of peptides with phage display peptide library
噬菌體展示技術的出現為獲得親和性高且性質穩定的多肽配基提供了相對簡便和快速的篩選途徑[38]. 國內外的研究者利用這一技術已成功獲得多種短肽配基并且已經廣泛用于抗體的親和色譜分離[39].表 3列出了應用噬菌體展示肽庫技術篩選獲得的部分親和短肽配基.例如,Ehrlich等[40]利用噬菌體展示隨機肽庫技術建立了兩個噬菌體庫(七肽庫和十二肽庫),以抗體的 Fc片段為靶標分別篩選了上述肽庫,從 34億個隨機序列中獲得了多肽EPIHRSTLTALL,合成后作為親和配基分離獲得了高純度人 IgG 單克隆抗體.針對單克隆抗體 3-E7,Cwirla等[41]利用噬菌體展示技術經過三輪篩選得到了51個含酪氨酸的六肽配基.實驗測得其中6個配基與目標蛋白質之間的結合常數在 0.35~8.3μmol/L之間.

表3 應用生物展示肽庫技術篩選獲得的親和短肽配基Tab. 3 Some peptide affinity ligands for antibody purification using biological display technology
噬菌體展示肽庫雖然已用于抗體親和短肽配基的篩選,但該技術尚存在如下三個缺點:(1)DNA的轉導效率直接限制了噬菌體展示肽庫容量的上限為1010[50];(2)噬菌體宿主細胞對多肽的種類也有一定的選擇性,從而使一些性能良好的多肽因為對宿主生長不利或具有毒性而首先被排除;(3)一些多肽作為噬菌體外鞘蛋白的一部分時具有很高的親和性. 但當把該多肽合成并固定化后,其親和作用力會大大降低甚至完全消失[51].
1.3 核糖體展示肽庫篩選技術
核糖體展示肽庫技術是另外一種利用生物技術構建體外肽庫的方法[52].由于該技術采用無細胞的轉錄、翻譯和選擇的方法,從而有效克服了噬菌體展示技術的上述缺點.圖 3為利用核糖體展示肽庫技術篩選親和短肽配基的示意圖.從圖 3可以看出:首先通過聚合酶鏈反應擴增目的基因的 DNA文庫(圖3A),同時加入T7啟動子、核糖體結合位點和莖環結構,將其轉錄成 mRNA(圖 3B)[53].上述 DNA 文庫可以利用化學合成的方法獲得.將上述DNA文庫在無細胞翻譯系統中孵育,使目的基因的翻譯肽鏈展示在核糖體表面,形成“mRNA-核糖體-多肽”三元復合物,構成核糖體展示的短肽庫(圖 3C).然后采用常規的酶聯免疫分析方法從混合物中篩選出與目標抗體具有較高親和性短肽的核糖體三聚體(圖3D).最后通過調節溶液使核糖體三聚體解離而釋放mRNA(圖 3E).后者經純化后作為模板進行反轉錄聚合酶鏈反應得到富集DNA(圖3A).最后經過多輪展示和富集,將最終得到的 DNA進行測序分析即可確定與目標蛋白具有較高親和性的短肽的氨基酸序列.
與噬菌體展示這一類的體內展示方法相比,核糖體展示技術具有建庫簡單、庫容量大(高達 1013~1015)、分子多樣性強、易于添加非天然氨基酸和短肽環化等優點[54-55].由于核糖體展示技術沒有選擇壓力的限制,從而可以大大提高該技術的庫容量和分子多樣性.利用該技術非常容易進行后續的體外重組和突變,以進一步提高活性.此外,利用該方法可篩選有細胞毒性的多肽[56].例如,Yonezawa等[57]以單克隆抗體anti-FLAG M2為目標蛋白,篩選獲得了高親和性短肽FLAG.該研究表明核糖體展示能在一天內完成兩輪篩選,且篩選周期更短,是一種快速篩選的有效方法.Lamla等[58]也采用同樣方法從含 2×1013條序列的核糖體展示肽庫中篩選鏈霉親和素的親和肽配基,所得到的九肽配基的解離常數為17nmol/L,其親和力是已有九肽配基 Strep-tagⅠ和Strep-tagⅡ的1000倍以上.

圖3 利用核糖體展示技術體外篩選高親和性短肽配基的示意圖Fig. 3 Screening high affinity short peptide ligands in vitro with ribosome display technology
2 抗體親和短肽配基的理性設計
前述的組合化學合成肽庫技術、噬菌體和核糖體展示技術的建立分別從化學和生物學的角度推動了組合庫構建方法和篩選技術的迅速發展,使大容量肽庫的快速構建和篩選成為可能,但利用這些篩選技術獲得短肽配基均存在工作量大、篩選靈敏度差和容易遺漏等缺點.因此,利用計算機技術在抗體及其已有配基的三維結構基礎上開發高效的親和短肽配基就成為更加快速的獲得高親和性短肽配基的有效方法.利用分子模擬軟件可以對短肽與目標蛋白之間的親和性進行預測,從而能夠提高合成短肽的命中率,減少短肽的合成數目,雙向降低合成與篩選的成本,從而大大縮短開發周期.因此,借助于分子模擬技術,親和短肽配基的理性設計整合了抗體的結構特異性和合成肽配基在穩定性方面的各種優點,為高親和性肽配基的設計提供了一種全新思路.
近年來,計算機軟硬件技術的高速發展使研究者能夠從微觀角度進一步認識蛋白質-肽配基之間的作用模式,以及結合過程中作用力和能量的變化,這些均為高親和性肽配基的開發提供了一條新的途徑.在現有的計算機軟硬件技術基礎上,近年來分子模擬軟件得到了快速發展.基于先進的分子圖形學技術,利用分子模擬技術能在三維水平上了解短肽的分子結構和各種重要的理化性質,如靜電勢和疏水性等與所期望的宏觀性質、親和性之間的定量關系.理性設計親和短肽配基的研究歷史雖然僅有十余年,但其發展對于親和色譜技術在抗體分離純化過程中的應用具有重要的意義.表 4列出了部分應用分子模擬技術理性設計獲得的親和短肽配基.目前常用的抗體短肽配基理性設計方法有:基于結構的理性設計方法、基于功能的理性設計方法和理性設計結合組合庫技術方法.

表4 應用分子模擬技術理性設計獲得的部分親和短肽配基Tab. 4 Some peptide affinity ligands for antibody purification using molecular simulation method
2.1 基于結構的理性設計方法
基于結構的理性設計方法是在抗體三維結構的基礎上,利用分子模擬軟件虛擬篩選或開發獲得與抗體具有較高親和力的短肽配基.近年來,生物信息學、計算機軟硬件技術和分子模擬技術的飛速發展為抗體功能和三維結構的解析提供了更為廣闊的平臺.截至2018年6月,已有3142個抗體的三維結構信息通過實驗方法測得,這些信息都存儲在蛋白質結構數據庫(Protein Data Bank,PDB)(http://www.rcsb.org/pdb/home/home.do)中,供全世界的研究人員免費使用.這些抗體的三維結構為抗體短肽配基的理性設計提供了便利,使其成為更加快速地獲得抗體高親和性短肽配基的有效方法.基于目標抗體三維結構的理性設計方法一般包括以下步驟:
(1)通過蛋白質數據庫下載或同源建模的方法獲得目標抗體的三維結構信息.
(2)基于實驗數據或分子模擬軟件分析找到潛在的配基結合位點(基于抗體結構的特殊性,一般的抗體的配基結合位點為Fc片段).
(3)下載或建立一個含有大量候選分子的短肽數據庫.
(4)利用分子對接軟件(FlexX、Dock和 Autodock等)對上述短肽庫進行虛擬篩選,并利用打分函數評價各配基與目標抗體之間的親和性,獲得與目標抗體有較高親和性的短肽配基.
(5)利用分子動力學模擬軟件(Gromacs、Charmm和 Amber等)進一步驗證上述虛擬篩選獲得的短肽配基和抗體Fc片段之間的親和性.
(6)然后利用分子顯示分析軟件評價所獲得的配基和目標抗體之間的親和性.
(7)最后利用親和色譜實驗來驗證上述配基與目標蛋白質之間的親和性.
利用基于目標抗體三維結構的理性設計方法篩選抗體親和配基的研究已經取得了一定的研究成果.例如,Wang等[62]結合柔性分子對接和分子動力學模擬方法從含 128個短肽配基的肽庫中篩選獲得了人IgG的四肽配基YFRH.利用該配基從CHO細胞培養液中分離純化獲得純度達 98%的單克隆抗體.Wei等[63]利用分子對接在 hIgG三維結構的基礎上設計出三種新型的四肽配基 DWHW、CEWW 和HEYW;并利用DWHW配基從cMEM和CHO細胞培養液中分離獲得高純度的抗體 IgG.在蛋白 A結構的基礎上,利用仿生設計方法構建了一個八肽庫,然后依次利用半柔性分子對接、柔性分子對接和分子動力學模擬方法篩選獲得了 FYWHCLDE配基,并利用固定化該配基的親和色譜柱,從人血清中分離獲得高純度的人IgG[65].
2.2 基于功能的理性設計方法
基于功能的理性設計方法是在自然界中存在的親和作用體系的基礎上,利用已知的配體或抑制劑的功能基團來設計新的親和配基[66].例如,通過研究目標蛋白的底物、抑制劑或輔酶的形狀或物理化學性質,如疏水性、靜電勢等來設計一種與目標蛋白具有高親和性的配基.若目標蛋白的活性部位所暴露的殘基已知,也可以根據理化性質互補的原則,如鎖鑰模式;或引進一些特殊的功能基團來理性設計配基[67].因此,基于功能的理性設計的實質是在經驗知識的基礎上模仿自然界中存在的配體.例如,芐脒基團常被用來作為配基來分離純化胰蛋白酶類蛋白酶[68].Platis等[69]以鎖鑰原理為基礎,理性設計了人艾滋病毒單克隆抗體 2F5的親和配基,同時利用親和色譜實驗證明了該配基與目標蛋白具有較高的親和力.
利用基于功能的理性設計方法,理性設計肽配基有以下兩種途徑:一種途徑是通過研究與目標抗體具有較高親和性的蛋白質(如抗原、蛋白 A、蛋白 G 和蛋白 L等)的形狀或理化性質(如疏水性和靜電勢),設計與目標抗體具有高親和性的配基;另一種途徑是在目標抗體的活性部位所暴露殘基的基礎上,根據理化性質互補的原則或引進一些特殊的功能基團,理性設計短肽配基.因此,該方法的實質是在經驗知識的基礎上模仿自然界中存在的配體.例如,Palombo等[64]在蛋白 A結構的基礎上設計獲得了短肽配基TG19318,從腹水粗提液中分離獲得 IgE.由于三嗪類基團與糖蛋白上的糖鏈部分有較強的親和作用,因此基于三嗪類結構設計多種親和配基用于抗體分離[70].
2.3 結合理性設計和組合庫技術的方法
理性設計的成功率雖然很高,但該方法必須依賴于蛋白質結構-功能之間關系的深入了解.由于目前很多目標抗體缺乏結構-功能的信息,從而大大限制了該方法在親和肽配基設計方面的應用.組合庫技術雖然可以不用考慮目標抗體的結構與功能,但是利用該方法需要建立大容量的短肽庫和高效靈敏的篩選方法.基于上述方法的優缺點,結合理性設計和組合庫技術的方法被廣泛用于親和短肽配基的篩選和設計[71].該方法在組合庫技術的基礎上加入理性設計的元素,使庫容量大大降低,從而極大降低后期的篩選工作量和篩選成本,同時能夠提高篩選命中率.因此,與組合庫篩選技術理性設計兩種方法相比,基于目標抗體及其現有配體結構和功能的基礎上更加高效.結合理性設計和組合庫技術的配基篩選過程一般包括以下步驟:
(1)在抗體或其自然配基三維結構基礎上選擇合適的結合位點.
(2)利用分子模擬軟件理性設計一些與目標蛋白結合位點的結構和理化性質互補的氨基酸片段.
(3)以這些氨基酸片段為先導利用組合庫技術來合成一系列的候選化合物.
(4)以目標抗體為靶標篩選與其具有高親和性的短肽配基.
(5)合成該配基,固定化后制得親和層析柱,利用其來分離目標蛋白;若其分離效果不佳,重復第(4)步進行重新篩選.
首先利用計算機的分子模擬技術獲得抗體或其自然配基的盡可能詳盡的結構信息,把合成的注意力更多地集中在具有相關結構或化學特性的潛在短肽配基上,以此構成一個小規模的短肽配基庫用于實驗篩選,研究人員可以從中獲得親和性較高的短肽配基;同時,通過分析篩選結果與短肽配基結構的定性關系獲得一些更為直觀的經驗,用于指導短肽配基化合物的結構優化.由于單純的規模化篩選目的性不強,篩選結果很大程度上取決于所建肽庫的容量和質量;而單純的計算機輔助的設計過程不能將隨后的短肽配基固定化過程以及復雜的化學環境、動態的結合模式等諸多可變因素考慮在內[26].目標蛋白的結構和功能信息與組合短肽配體庫和高效篩選方法的結合,在很大程度上彌合了經驗與實際過程之間的偏差,這種設計思路將對親和色譜的規模化應用產生積極的影響.
2005年,Roque等[72]首先利用分子模擬工具分析了蛋白 L和人抗體輕鏈之間的相互作用,利用理性設計的方法獲得了與抗體或其小片段(Fab或scFv)具有親和作用的12個先導化合物分子,然后利用固相合成技術生成一個化合物庫,通過篩選獲得與目標蛋白具有高親和性的化合物.合成并固定化該化合物制得親和層析柱,用于人免疫球蛋白 G木瓜蛋白酶消化液中 Fab的分離純化,純度達到 96%~98%.
由于線性短肽易于被蛋白酶降解,尤其是利用親和短肽配基從動物血漿等含有多種蛋白酶的樣品中分離純化抗體,該問題更加嚴重.雖然通過添加一些蛋白酶抑制劑能緩解該問題,但由于這些抑制劑價格較貴且后期需要從抗體中進一步去除,這都會提高抗體生產的成本.因此,將易于被蛋白酶降解的線性肽改造成含有非天然氨基酸或擬肽可以有效解決上述問題.環形肽具有非常好的穩定性和抗蛋白酶解的能力,已被廣泛用作抗體的親和配基.Dias等[49]基于組合肽庫和理性設計方法在 Fc-Ⅲ的 N-和 C-端引入D-Pro-L-Pro得到 FcBP-2環肽,從而形成雙環的結構.結果表明,FcBP-2與IgG的親和性提高80倍以上.但由于 D-Pro不能固定化到介質上,因此 N-和C-端環化不能用于固相多肽合成,從而制約其工業化應用.為了克服上述缺點,Gong等[73]在FcBP-2結構基礎上利用一個二硫鍵來替代 D-Pro-L-Pro,獲得環肽 Fc-Ⅲ-4C(氨基酸序列為 DCAWHLGELVWCT).結果表明,利用Fc-Ⅲ-4C與IgG的親和性比Fc-Ⅲ提高30倍以上.
3 總結和展望
抗體在治療炎癥、腫瘤和傳染類疾病等方面應用廣泛.由于抗體表達技術的快速發展,下游的分離純化已成為整個生產過程的關鍵步驟.由于具有高選擇性和高特異性等優點,親和色譜技術是工業制備高純度抗體的主要手段之一.目前親和色譜技術的應用瓶頸在于缺少合適的親和配基.由于短肽配基具有較高的結構穩定性、易于從抗體產品中分離、與抗體的作用條件溫和從而避免目標抗體的變性等優點,親和短肽配基已廣泛用于抗體分離純化.
近年來,隨著蛋白質結構解析技術(如晶體衍射、核磁共振和低溫電鏡技術等)的快速發展,越來越多的抗體及其復合物的三維結構被解析,親和短肽配基理性設計技術得到了廣泛應用.但是該技術目前尚有一些關鍵問題亟待解決.
首先,短肽配基與目標抗體之間親和作用力的精確計算.目前主要使用分子對接方法來篩選與目標抗體有較高親和性的短肽配基,因此虛擬篩選的效率與所用分子對接所用打分函數的準確性密切相關.只有準確判定短肽配基與目標抗體之間的親和性,才能大大提高虛擬篩選的成功率.現有分子對接軟件大多采用經驗性力場來預測短肽與目標抗體之間的親和作用力,而目前的經驗性力場的準確度有待提高,因此如何準確判定短肽配基與目標抗體之間的親和性是制約短肽配基理性設計發展的主要問題之一.目前已開發出一些方法,如自由能微擾和分子力學-帕松波爾茨曼表面積計算等[74]用于計算抗體-短肽配基之間的結合自由能,并獲得了比較精確的結果.
其次,分子模擬過程中對抗體柔性的處理.現有的絕大多數分子對接軟件僅考慮配基的柔性,而將抗體看成剛性的;而實際的短肽-抗體結合和解離過程中,短肽和抗體均是柔性的.因此,這種近似處理在一定程度上會給基于分子對接方法的理性設計造成很大的誤差.雖然已有研究將分子動力學模擬和分子對接結合起來實現在對接過程中同時考慮配基和受體的柔性[75-76],但由于分子動力學模擬的計算量較大,從而僅使用該方法不利于大規模篩選短肽配基[77].將蛋白質-蛋白質對接技術(如 HADDOCK軟件[78])以及基于此技術開發的相應的打分函數(dMMPBSA[79])應用于短肽配基-抗體之間的親和作用力評價會極大解決上述問題.
由于現有分子模擬技術存在上述問題,因此目前理性設計的親和肽配基的成功率仍然較低.例如,本研究室開發的仿生設計方法設計獲得的15個短肽配基.利用親和色譜實驗證明只有 5個短肽能夠作為配基用于抗體的分離,另外 10條短肽配基與抗體之間的親和力比較弱,所以不能直接用于抗體的親和分離[80].因此,單純利用分子模擬來設計親和短肽配基的成功率還比較低.但隨著計算機軟硬件技術的進一步發展,尤其是分子模擬基本原理的飛速發展,分子模擬現存的上述問題將逐步得到解決,理性設計作為一種新興的技術,必將在親和肽配基的開發方面應用得越來越廣泛,從而為抗體產業的發展貢獻更多的力量.

