混菌發酵綠茶產脂肪酶及其對酯型兒茶素的水解作用分析
方洪楓,張慧霞,王國紅,楊民和,2*
1. 福建師范大學生命科學學院,福建 福州 350117;2. 工業微生物教育部工程研究中心,福建師范大學,福建 福州 350117
曲霉屬的真菌,包括黑曲霉(Aspergillus niger)和冠突曲霉(Aspergillus cristatum),是黑茶渥堆過程中的優勢微生物[1-3]。黑曲霉在茶葉渥堆過程中能夠分泌多種水解酶,如纖維素酶、淀粉酶、單寧酶、蛋白酶、多酚氧化酶等[4];黑曲霉也是產生脂肪酶的常見菌株[5]。冠突曲霉(冠突散囊菌)在發酵過程中可以分泌纖維素酶、蛋白酶、漆酶、多酚氧化酶、脂肪酶等酶類[6-7];采用橄欖油作為誘導底物,溴甲酚紫作為指示劑,楊金梅等[8]從17株散囊菌屬(Eurotium)真菌中獲得 6株產脂肪酶的菌株;分泌蛋白組學的初步分析表明,綠茶經菌株 LP-7的固態發酵后,可以檢測到 GDSL家族的一種脂肪酶,其分子量為32.38 kDa。通過這些水解酶的酶促作用,將纖維素、蛋白質、淀粉、多酚化合物和脂類等大分子物質轉化為小分子化合物,從而改變茶葉的粗、澀、老氣味,使茶湯滋味變得醇、厚、甘甜,呈現出黑茶茶湯特有的風味、顏色、品質和生理功能。
兒茶素類化合物是茶湯中主要的多酚類化合物,約占綠茶茶湯干物質重量的30%~42%,對茶葉的品質及其功效起著決定性的作用[9]。兒茶素類化合物的種類多,主要包括兒茶素(C)、表兒茶素(EC)、沒食子兒茶素(GC)、表沒食子兒茶素(EGC)、表沒食子兒茶素沒食子酸酯(EGCG)、表兒茶素沒食子酸酯(ECG)等,根據 C環上 3位是否連接沒食子基團,可將兒茶素分為酯型兒茶素和非酯型兒茶素[9-10]。茶葉經微生物發酵后,一個普遍的現象是隨著發酵的進行,茶葉中酯型兒茶素含量和茶多酚總量均呈現下降的趨勢,說明微生物的發酵可能引發了兒茶素的代謝過程[11-12]。當前,有關黑茶發酵過程中兒茶素和茶多酚的代謝途徑和調控機制還不清楚。
通過微生物細胞的發酵或商業酶制劑的處理可以引發兒茶素的生物轉化[13-14]。這些生物轉化作用在黑茶生產、茶飲料品質提升和藥物開發等方面發揮重要作用,近年來受到廣泛的關注。從化學結構上可知,酯型兒茶素合成的前體是非酯型兒茶素和沒食子酸(GA)衍生物,其酯鍵可以被脂肪酶、糖苷酶和單寧酶等水解酶降解[10,15]。聶志銀等[15]在研究中發現茶樹中存在活力較高的酯型兒茶素水解酶(Galloylated catechins hydrolase,GCH)類,對茶葉中酯型兒茶素的水解作用產生一定的影響,但該酶的性質并不清楚。單寧酶(E.C.3.1.1.20)具有水解單寧酸的酯鍵和縮酚酸鍵并產生沒食子酸和葡萄糖的功能,可將酯型兒茶素水解為非酯型兒茶素和沒食子酸[16]。微生物來源的單寧酶已經在茶飲料的澄清、去澀過程中得以應用[17]。但是,目前利用微生物發酵生產單寧酶需要用單寧酸作為誘導物,而且通常是胞內酶,提取和純化有一定的困難。因此,迫切需要開發新的酶類,應用于酯型兒茶素的水解,以促進兒茶素生物轉化的理論和應用研究[17-18]。
從普洱茶中分離獲得的黑曲霉和冠突曲霉菌株可以不同程度地產生多種胞外水解酶,有些菌株呈現脂肪酶活性[8]。本研究利用冠突曲霉菌株PE-1和黑曲霉PE-4作為混合菌發酵劑,以綠茶作為發酵基質,檢測菌株混合發酵條件下產生脂肪酶的能力;在分離純化脂肪酶的基礎上,對該脂肪酶酶解轉化EGCG和ECG的能力進行分析,明確綠茶固態發酵條件下產生脂肪酶,該脂肪酶對EGCG和ECG具有不同的水解效率。
1 材料與方法
1.1 供試菌株及培養
冠突曲霉PE-1和黑曲霉PE-4從普洱茶樣品(云南西雙版納勐海天福祥茶廠,2007年3月生產)中分離獲得。菌株生長于 DG-18培養基[19],4℃冰箱保存于福建師范大學生命科學學院微生物實驗室。將菌株 PE-1和 PE-4分別接種到 DG-18培養基上活化,待菌落長滿整個平板后,取10~15 mL無菌水倒入菌落表面,用接種針刮取菌落表面的孢子,將孢子懸液移入帶玻璃珠的無菌 150 mL三角瓶中,充分振蕩以分散孢子。調整孢子懸浮液濃度為(3~4)×107個·mL-1,孢子懸浮液用于后續接種培養。
1.2 培養基
改良 DG-18培養基配方為:蛋白胨 5 g,葡萄糖 10 g,KH2PO41 g,MgSO4·7H2O 0.5 g,瓊脂 15 g,加入蒸餾水 800 mL,加熱攪拌煮沸至完全溶解。加入 200 g甘油,混合均勻,定容至1 L。121℃高壓滅菌消毒持續15 min。最后培養基水活度(aw)為 0.95,pH 為 5.6±0.2。
脂肪酶鑒別培養基[5,20]:NaNO33.0 g、NaCl 10.0 g、K2HPO41.0 g、MgSO4·7H2O 0.5 g、瓊脂20.0 g、溴甲酚紫0.5 g、三丁酸甘油酯乳化液20 mL,加蒸餾水至1 000 mL,加熱攪拌煮沸至完全溶解,121℃高壓滅菌20 min。
三丁酸甘油酯乳化液 20 mL體系配方:15 mL磷酸鈉緩沖液中加入0.4 g聚乙烯醇,放置于115℃高壓下持續30 min熔化后加5 mL三丁酸甘油酯,然后用超聲波破碎儀乳化20~30 min,即制備成三丁酸甘油酯乳化液。
1.3 供試茶葉
供試茶葉為綠茶,購置于福州春倫茶業有限公司。
1.4 脂肪酶平板檢測
將活化后的菌株PE-1和PE-4用9 mm直徑的打孔器沿各個菌落邊緣打取若干個菌餅,用接種針挑取菌餅接到脂肪酶鑒別培養基平板中央,每個菌株設置3個重復,放置于28℃恒溫培養箱培養3~5 d。觀察菌落周圍是否有透明圈產生,如果有透明圈產生,則利用數顯式卡尺測量透明圈的直徑(d)和菌落的直徑(D)。根據d/D的比值作為初步鑒別菌株產脂肪酶能力的指標[20]。
1.5 綠茶固態發酵
稱取10 g綠茶,放置于250 mL三角瓶中,加入10 mL蒸餾水,在115℃高壓滅菌30 min。在超凈工作臺中,吸取1 mL充分打散的真菌孢子懸液加入茶葉固體發酵培養基中,充分晃動搖勻。將該培養基放置于 28℃恒溫培養箱中培養14 d后,加入50 mL的0.05 mol·mL-1pH 8.0的磷酸鹽緩沖液置于4℃條件下150 r·min-1搖床中浸提12 h。浸提液用8層紗布過濾,浸提液在 4℃條件下 10 000 r·min-1離心 10 min,除去沉淀,上清液即為粗酶液。
1.6 菌種接種次序對發酵后脂肪酶活力的影響
設計3種不同的接種順序,分別是:(1)先接種菌株PE-1培養7 d后,接種菌株PE-4再培養至14 d;(2)同時接種菌株PE-1和菌株PE-4培養14 d;(3)先接種菌株PE-4培養7 d后,接種菌株PE-1再培養至14 d。之后分別將發酵的茶葉浸提,比較3種不同接菌順序發酵后茶葉中脂肪酶活力的大小。
1.7 脂肪酶活力測定
脂肪酶活力檢測體系[5]:A液:稱取30 mg棕櫚酸對硝基苯酯(p-NPP)溶于10 mL異丙醇中,置于棕色瓶中避光保存。B液:在0.05 mol·mL-1pH=8.0的 Tris-HCl緩沖溶液中加入0.4% TritonX-100。
脂肪酶活力測定反應液總體積為 3 mL,其中含0.2 mL粗酶液,0.2 mL A液及2.6 mL B液;對照以0.2 mL異丙醇替代A液。首先將A液和B液在37℃恒溫水浴鍋中預熱5 min,充分混合均勻,加入 0.2 mL的粗酶液后,在37℃條件下精確反應 20 min后,冰浴 5 min終止反應進程。將反應后的體系在410 nm波長條件下測定吸光值。根據對硝基苯酚(p-NP)標準曲線計算出粗酶液在水解過程中釋放出的p-NP的量,從而根據公式換算出脂肪酶的酶活力。
本試驗中脂肪酶活力定義為:在 37℃條件下,每分鐘水解p-NPP產生1 nmol游離的p-NP的脂肪酶量為一個酶活力單位(U)。并按以下公式計算脂肪酶活力:
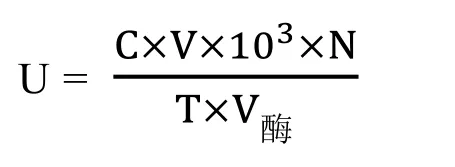
C,對應的 p-NP濃度 μmol·mL-1
V,反應總體系mL
N,酶液的稀釋倍數
T,酶反應時間min
V酶,測定的酶液體積mL
所有酶活力測定均重復3次,結果取平均值。
1.8 脂肪酶分離純化
脂肪酶的分離純化參照舒正玉等[5]的方法并加以改進。預試驗確定60%飽和度為硫酸銨最佳沉淀飽和度。粗酶液置于冰水浴中,緩慢添加烘干并研磨過的固體硫酸銨至 60%飽和度,4℃靜置 4 h,10 000 r·min-1離心 10 min去上清液。沉淀用0.1 mol·L-1pH 5的檸檬酸緩沖液溶解,溶解后的沉淀于檸檬酸緩沖液中透析過夜,其間更換3~4次緩沖液。
葡聚糖G-100凝膠柱先用0.1 mol·L-1pH 5的檸檬酸緩沖液平衡。取適量的凍干酶粉末,加以上緩沖液5 mL溶解,上樣洗脫。脂肪酶活性采用2%三丁酸甘油酯檢驗平板檢測,合并有酶活的酶液,透析脫鹽,凍干濃縮。
將經過葡聚糖 G-100凝膠層析純化得到的樣品進行SDS-PAGE凝膠電泳,分離膠和濃縮膠的質量分數分別為12%和5%。電泳結束后剝離凝膠用考馬斯亮藍 R-250染色30 min,而后冰醋酸脫色,以確定脂肪酶的分子量。
1.9 UPLC測定
經預試驗確定酶解反應的酶用量和酶解時間。在酯型兒茶素標準品溶液(10 mg·mL-1)中加入100 μL的純酶液,反應40 min后,終止反應,進行UPLC檢測分析。空白對照為不加酶液的酯型兒茶素標準品溶液。UPLC流動相:流動相A1:超純水,流動相B1:100%乙腈;流動相 A2:1%乙酸,流動相 B2:100%乙腈。UPLC色譜條件:色譜柱采用Waters BEH C1850 mm×2.1 mm,色譜檢測波長:280 nm;流速:0.1 mL·min-1,樣品進樣量:2 μL;樣品室溫度:4℃,柱溫:35℃。進樣前洗柱40 min,平衡色譜柱大約60 min,進樣后洗柱70 min。
1.10 數據處理
EGCG和ECG的水解率,EGC和EC的產率計算分別參照Zhong等[13]的方法。采用IBM SPSS Statistics 19軟件對數據進行分析與比較,并用Origin 8.5對數據進行統計與作圖。
2 結果與分析
2.1 脂肪酶平板檢測
在脂肪酶鑒別平板上,菌株PE-1和PE-4生長良好。于28℃恒溫培養3 d后均開始產生透明圈,培養5 d后透明圈變得清晰(圖1),說明菌株能產生和分泌胞外脂肪酶。菌株PE-1的透明圈直徑與菌落直徑的比值(d/D)為 2.26±0.80,菌株 PE-4的 d/D 比值為1.08±0.03,存在極顯著差異(P<0.01)。但是,菌株PE-4在生長過程中產生分生孢子,飛散的孢子形成新的菌落,產生小型而分散的水解圈。
2.2 固態發酵條件下菌株PE-1和PE-4產脂肪酶活力比較
以綠茶為發酵基質培養14 d后,菌株PE-1和 PE-4的脂肪酶活力分別為 67.15 U·mL-1和53.04 U·mL-1,菌株 PE-1與菌株 PE-4產脂肪酶活力存在極顯著差異(P<0.01)(圖2)。菌株PE-1和PE-4在綠茶葉固體發酵培養條件下,均能產生脂肪酶,進一步證明了在三丁酸甘油酯脂肪酶鑒別平板上初步鑒定脂肪酶的試驗方法和結果是可靠的。
2.3 菌種接種次序對產脂肪酶的影響
在黑茶自然渥堆過程中,有多種真菌參與黑茶的發酵,因此利用冠突曲霉菌株PE-1和黑曲霉菌株 PE-4混合發酵。3種接種順序的比較表明,先接種菌株PE-1,1周后再接種菌株 PE-4,兩種菌可以成功地混合生長。兩個菌株同時接種和先接種菌株 PE-4,茶葉上黑曲霉PE-4生長良好,而菌株PE-1的生長受到抑制。
菌株PE-1培養7 d后,再接種菌株PE-4培養 7 d的脂肪酶活力為 86.49 U·mL-1,酶活極顯著高于其他兩種接種方式(P<0.01)。同時接種菌株PE-1和菌株PE-4后培養14 d的脂肪酶活力為54.83 U·mL-1,先接種菌株PE-4后,再接種菌株PE-1的脂肪酶活力為56.72 U·mL-1,兩種接種方式之間差異不顯著(P>0.05)(圖3)。綜上所述,后續的試驗均采用先接種菌株PE-1后接種菌株PE-4的培養方式。
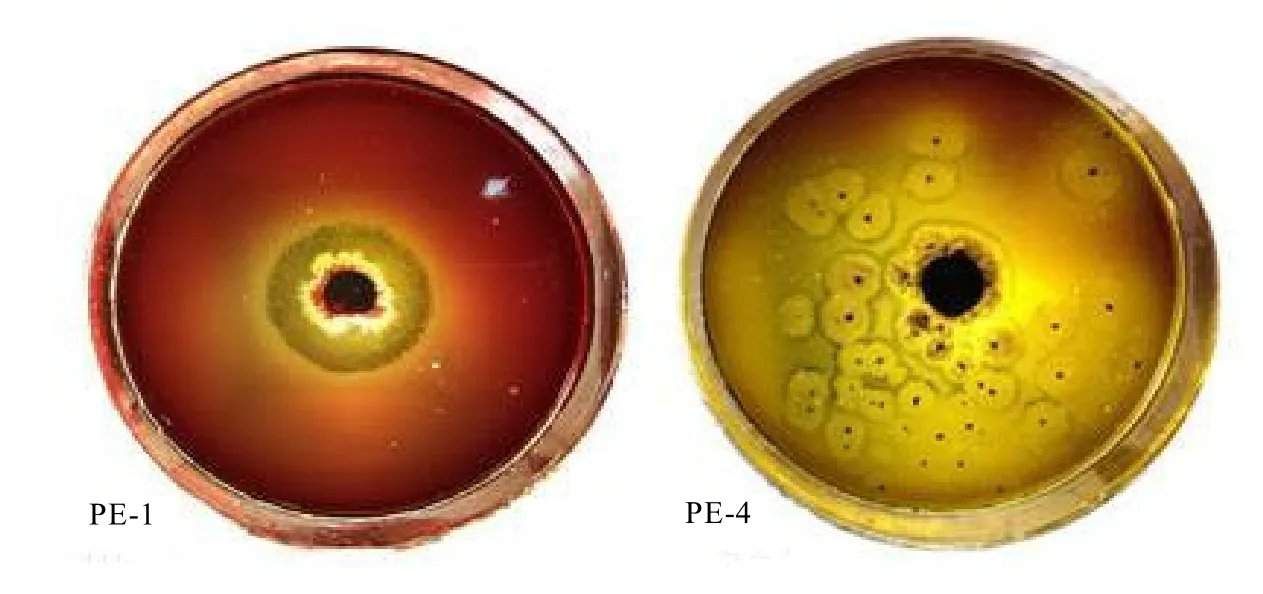
圖1 不同菌株在脂肪酶鑒別平板上的透明圈比較Fig. 1 Comparison of transparent areas of different strains with lipase plate test

圖2 菌株PE-1和PE-4脂肪酶活力比較Fig. 2 Comparison of lipase activity between strain PE-1 and strain PE-4
2.4 脂肪酶的分離純化
當硫酸銨飽和度在 20%~60%之間時,可觀察到上清液在檢測平板上產生清晰的透明圈;而當硫酸銨飽和度大于70%之后,上清液點樣后檢測不到脂肪酶活性,說明當硫酸銨飽和度達到60%時,粗酶液中的脂肪酶已經大部分沉淀。而在蛋白沉淀的點樣平板上,飽和度為 20%~90%均能一定程度地觀察到透明圈,飽和度為60%透明圈清晰。因此確定硫酸銨飽和度60%作為脂肪酶沉淀的值。
葡聚糖G-100凝膠層析結果見圖4。從層說明硫酸銨飽和沉淀純化蛋白效果較明顯。采析圖譜上可以看到,有一個明顯的洗脫峰出現,用2%三丁酸甘油酯檢驗平板檢測該洗脫峰對應的收集管中的酶活,發現其中4號、5號和6號管有酶活力,其中5號管酶活力最高,合并有酶活的3支管,凍干濃縮后備用。
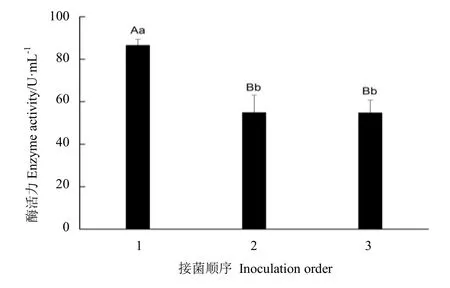
圖3 菌株接種順序對產脂肪酶活力的影響Fig. 3 The influence of fungal strain inoculation orders on lipase activity
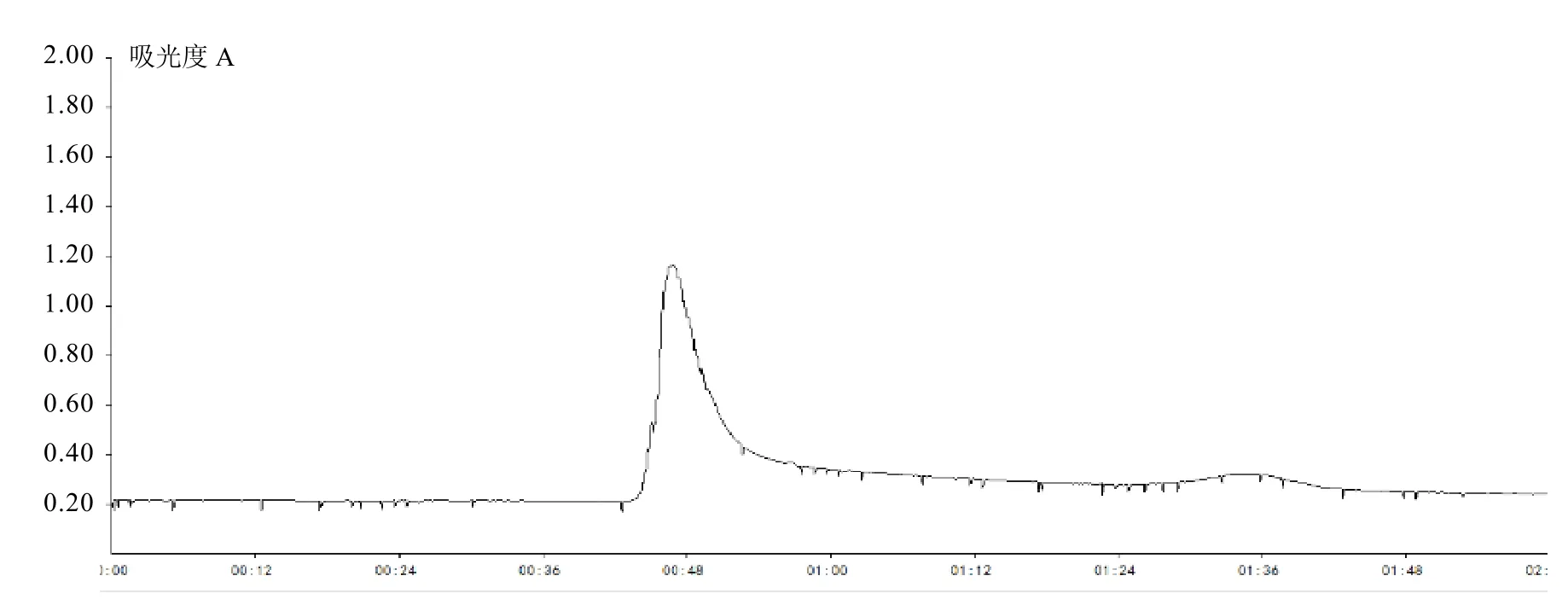
圖4 脂肪酶葡聚糖G-100凝膠層析圖譜Fig. 4 Sephadex G-100 column chromatography of lipase
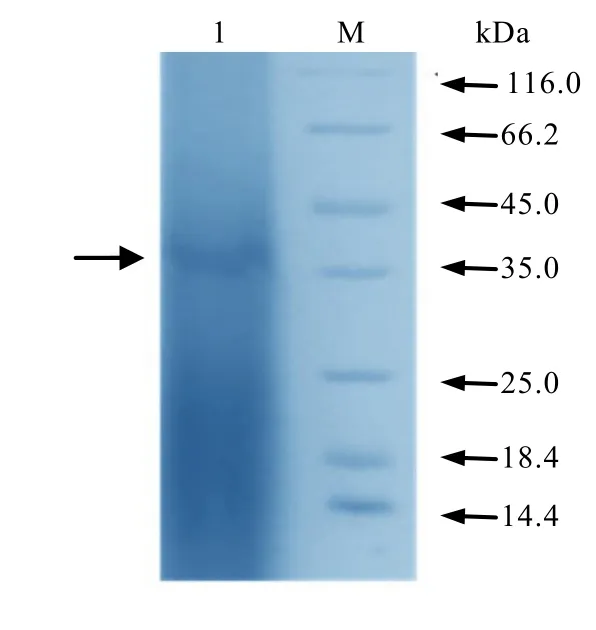
圖5 SDS-PAGE電泳圖譜Fig. 5 SDS-PAGE electrophoresis pattern
混合發酵得到的粗酶液經過硫酸銨分級沉淀和葡聚糖G-100凝膠層析等步驟,得到較純化的蛋白。從SDS-PAGE凝膠電泳檢測(圖5)中可見,純化后的脂肪酶蛋白呈現一條較為清晰的條帶,其分子量為 37 kDa左右。由于茶葉固體發酵得到的蛋白混有一些色素成分,造成背景色較深。
2.5 酶轉化產物的UPLC分析
將 EC、EGC、ECG、EGCG等 4種兒茶素單體標準樣品分別經UPLC檢測,獲得EC、EGC、ECG、EGCG等4種標準樣品出峰時間分別為 6.455 min、2.704 min、18.403 min和7.280 min(圖6)。
UPLC檢測結果見圖7和表1。經過純化的酶轉化ECG后,根據出峰時間推測在保留時間為 18.533 min時檢測到的物質為 ECG,峰面積百分比由原先的標準品中所占 99.94%降低為84.50%;而在保留時間為6.822 min時檢測到的物質為 EC,峰面積百分比由原先的標準品中0%上升到2.72%,峰面積有所上升,說明純酶中含有相應分解ECG的酶。
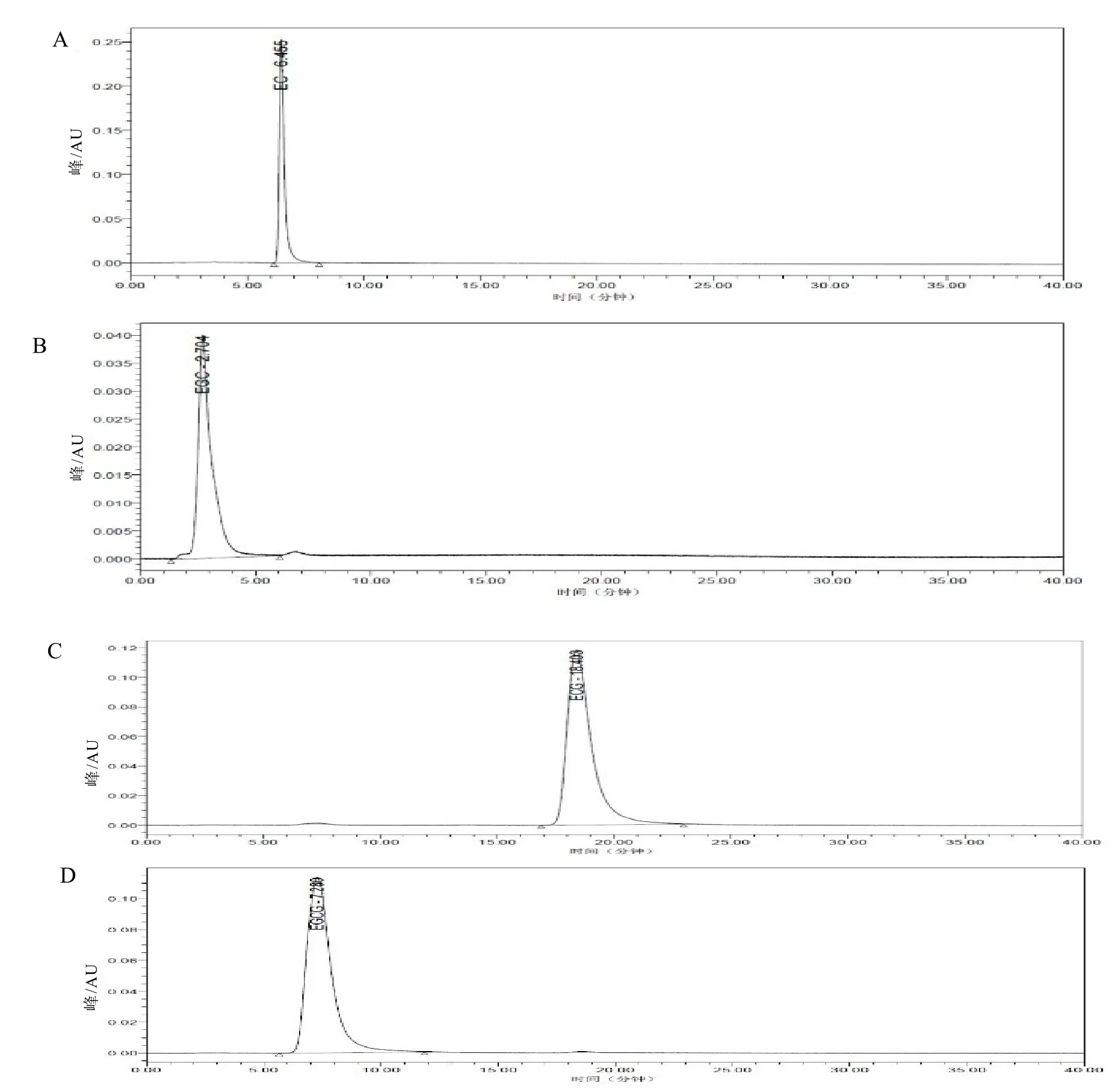
圖6 4種兒茶素標準品的UPLC圖譜Fig. 6 The UPLC chromatogram of four catechin standards
純酶轉化EGCG后,根據出峰時間推測,在保留時間為 7.504 min時檢測到的物質為EGCG,峰面積百分比由原先的標準品中所占99.97%降低為5.54%,峰面積明顯下降;而保留時間為 2.083 min時檢測到的物質為 EGC,峰面積百分比由原先的標準品中所占0%上升到 42.30%,峰面積明顯上升,說明純酶中含有以EGCG為底物的脂肪酶。
依據表1結果計算可知,酶處理后EGCG的水解率為94.46%,EGC的產率為 63.33%;ECG的水解率為15.45%,EC的產率為4.15%。
3 討論
黑茶渥堆過程是在多種微生物共同作用下完成的[2-4],是多種微生物協力發酵、多種水解酶協同酶促反應的結果[4,7]。微生物之間的協同作用,可以誘導產生水解酶,克服代謝中間產物積累對代謝終產物合成的影響[21]。同時,混菌發酵也利用不同菌株之間代謝差異,使酶系的種類、比例和酶活力相互協調,從而提高發酵效率和終產物產量[22]。菌株PE-1和PE-4接種次序顯著影響混菌發酵條件下的脂肪酶活力。混菌發酵酶活力高于兩個菌株單菌發酵的酶活力。該研究結果支持序列混菌發酵菌株之間存在協同代謝作用的理論[22]。深入研究茶葉發酵過程中菌株PE-1和PE-4之間的相互作用和酶活性促進機理,有助于認識黑茶渥堆過程中微生物群體發酵機制,對黑茶發酵工藝的優化將具有積極的意義。

表1 脂肪酶轉化ECG和EGCG標準品后各組分相對含量Table 1 Relative yield of mono-catechin after lipase hydrolysis of ECG and EGCG standards
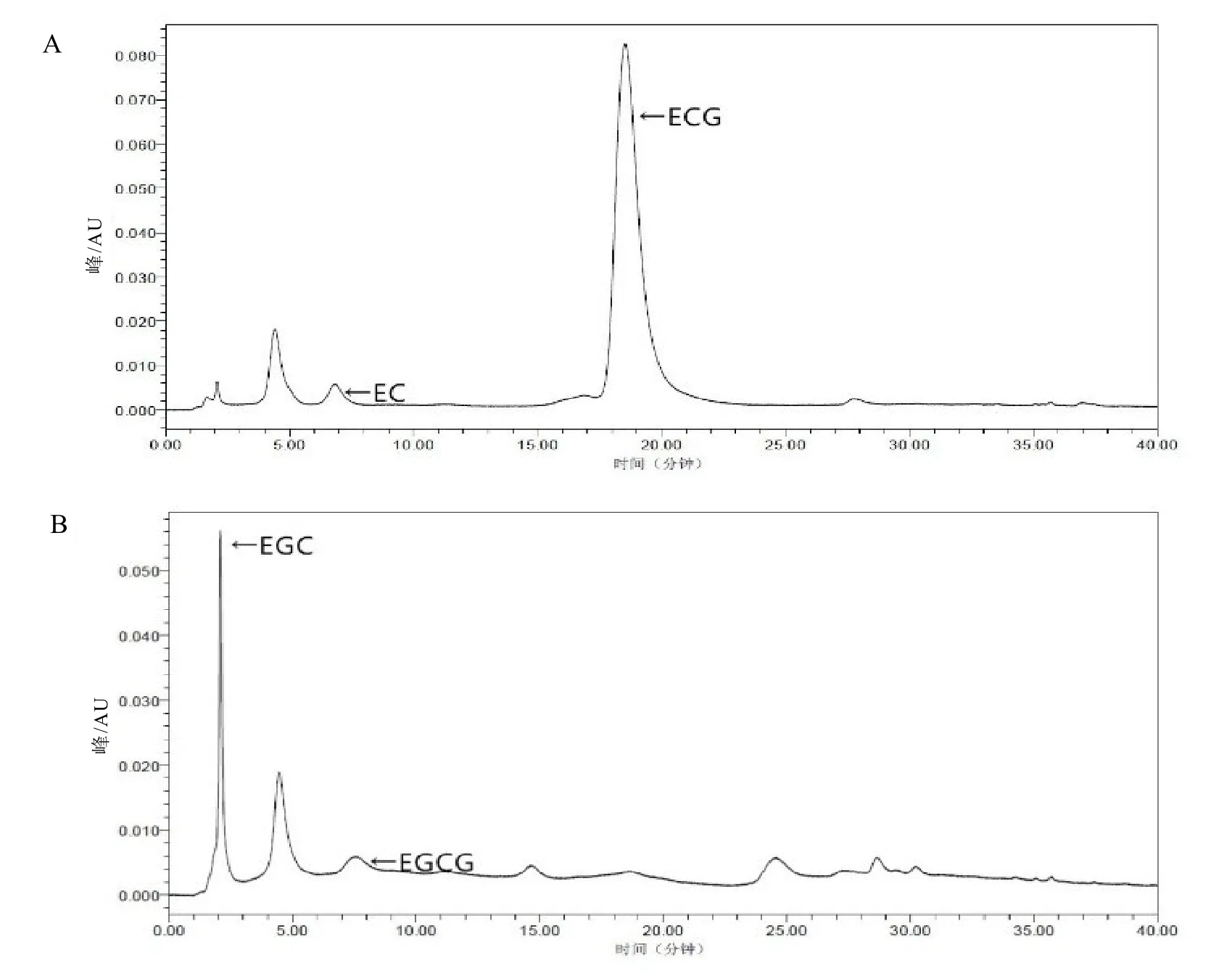
圖7 純酶轉化ECG和EGCG標準品的UPLC圖譜Fig. 7 UPLC chromatogram of ECG and EGCG standards after pure lipase transformation
菌株 EP-1和 EP-4混菌發酵的綠茶中分離純化獲得一個分子量為37 kDa左右的脂肪酶,該脂肪酶可以有效地轉化 EGCG產生EGC,水解率達到 94.46%。目前,利用微生物產生的商業酶處理茶葉、茶湯或是茶飲料已有較多的報道和應用[14,16]。例如微生物來源的單寧酶,被用于分解茶湯中的茶多酚和單寧類化合物,改善茶湯的苦澀味,降低茶湯的渾濁度[16]。除單寧酶外,利用微生物水解酶或微生物細胞生物轉化兒茶素,有目的地獲得某一單體兒茶素的研究很少。事實上,利用微生物來源的商業酶制劑,如糖苷酶、脂酶和脂肪酶處理酯型兒茶素以生產非酯型兒茶素,成功的事例很少[10,13]。利用 EGCG作為誘導物,Zhong等[13]研究了黑曲霉的一種水解酶,可以將EGCG水解產生EGC,EGC的產量為56%,但對該水解酶的性質沒有作進一步的分析和說明。紅茶菌中的混合菌群可以將EGCG和ECG轉化成EGC和EC,但轉化效率很低,酶的性質也不清楚[23]。本研究所獲得的脂肪酶對EGCG的水解率達到94.46%,但EGC的產率只有63.33%,說明該脂肪酶雖然具有較高的酶促轉化效率,但酶蛋白純度不夠。后期需進一步優化酶分離純化條件,以獲得更加純凈的酶,提高EGC的產率。
植物和微生物均能產單寧酶[16]。無論是本實驗室前期研究中的菌株LP-7[8],還是本研究中的菌株PE-1和PE-4,在單寧酸的誘導下均可以檢測到單寧酶活性。但是,微生物和植物來源的單寧酶一般是多聚體,分子量在 150~300 kDa之間,亞基分子量一般為75 kDa[15-16]。在酶的分離純化過程中,本研究對各個純化步驟的酶樣品均采用三丁酸甘油酯鑒定平板予以驗證,得到清晰的透明水解圈,SDS-PAGE凝膠電泳也獲得了較為純凈的酶帶,其分子量為37 kDa。因此,結合楊金梅等[8]的分泌蛋白組學研究結果,該酶可能是一種新的脂肪酶。有關該酶的酶學性質,需要作更為細致的深入研究。

