丹參酮ⅡA注射液對缺血缺氧性腦損傷新生大鼠皮質神經元自噬及Akt-mTOR通路的影響*
朱 波 楊 艷 蘇仁意 許細平 孫乾朕
(湖北醫藥學院附屬襄陽市第一人民醫院,湖北 襄陽 441000)
缺氧缺血性腦損傷(HIBD)是造成新生兒多種神經功能障礙的疾病之一,嚴重威脅新生兒生命健康[1]。據調查,圍生期HIBD新生兒死亡率高達20%,經治療幸存患兒中約40%存在腦神經損害等后遺癥[2]。目前,HIBD主要依靠亞低溫療法進行治療,但其預后效果并不理想。相關研究指出,病理性神經元自噬是造成多種神經元損傷凋亡的重要原因之一[3]。因此,尋找調節神經元自噬藥物的研究是目前治療HIBD的新思路。丹參酮ⅡA是丹參主要有效成分之一,難溶于水,易溶于有機溶劑。丹參酮ⅡA因含有醌型結構,具有多種藥理藥效,例如改善冠狀動脈循環、修復心肌損傷、抗細胞凋亡、神經保護等[4]。相關研究顯示,丹參酮ⅡA對多種臟器的缺氧缺血性損傷具有保護作用[5-6]。任陳等研究發現丹參酮ⅡA能明顯減輕放射線在體外對海馬神經元細胞的放射損傷作用,并推測其保護機制可能與調節放療過程中神經元自噬相關[7]。因此,本研究擬通過建造新生大鼠缺血缺氧性腦損傷模型,觀察丹參酮ⅡA對HIBD新生大鼠皮質神經元自噬及Akt-mTOR通路影響并探討其機制。現報告如下。
1 材料與方法
1.1 實驗動物 清潔級7日齡SD(Sprague-Dawley)大鼠80,雌雄不計,體質量11.6~12.17 g,平均體質量(11.98±0.32)g,由河南省實驗動物中心提供,許可證號:SYXK(豫)2015-0003。
1.2 試劑與儀器 丹參酮ⅡA磺酸鈉購自上海上藥第一生化藥業有限公司,國藥準字H31022558,批號160916。蛋白酶抑制劑購自上海子起生物科技有限公司,貨號E429-10MG。RIPA裂解液購自北京君諾德生物技術有限公司,貨號7011A。BCA蛋白濃度檢測試劑盒購自上海經科化學科技有限公司,貨號JK-201。LC3-Ⅰ、LC3-Ⅱ、Beclin-1、p-Akt、p-mTOR、p-S6、GADPH蛋白抗體及HRP綴合的二抗均購自藥明康德。透射電子顯微鏡購自尼康儀器(上海)有限公司。酶標儀購自美國伯騰儀器。
1.3 分組與造模 將SD幼鼠隨機分為5組,每組16只,分別為假手術組、模型組、高劑量組(0.1 mg/g)、中劑量組(0.05 mg/g)、低劑量組(0.02 mg/g)。假手術組僅左頸部切口處理,其余各組進行造模。3%乙醚麻醉幼鼠,手術暴露左側頸主動脈,分離神經,結扎血管,縫合傷口。放回原飼養環境,恢復3 h后,將幼鼠置于常壓缺氧艙內,溫度37℃,濕度45%~55%,持續通入8%O2和92%N2缺氧處理2.5 h,幼鼠出現左旋即為造模成功。
1.4 給藥方法 高劑量組、中劑量組、低劑量組幼鼠分別給予不同劑量的丹參酮ⅡA注射液,于出現左旋現象時腹腔注射1次,24 h后重復注射1次。假手術組與模型組分別按照上述給藥方式給予等體積0.9%氯化鈉注射液。
1.5 標本采集與檢測 1)大腦皮質超微結構觀察。缺氧缺血處理32 h后,取幼鼠斷頭取左腦,利用解剖鏡迅速剝離大腦皮質,置于冰上盛有2.5%戊二醛容器中進行處理,用1%鋨酸對腦組織進行固定,乙醇和丙酮不同濃度由低至高進行脫水,環氧樹脂包埋,切片,利用乙酸雙氧鈾和硝酸鉛染色,置于透射電子顯微鏡下觀察拍片。2)TTC染色觀察腦梗死面積。缺氧缺血處理36 h,取幼鼠斷頭,取左腦置于冰上。Rat Brain Matrix由前之后切片,厚度5 μm。室溫條件下,將切片置于2%TTC中,孵育35 min,PBS緩沖液洗滌,10%中性甲醛固定。數碼相機采集圖片,正常腦組織為紅色,梗死組織為白色。利用Image J對采集圖片急性分析,統計梗死面積百分比。3)蛋白免疫印跡法檢測腦組織自噬蛋白表達。缺氧缺血處理48 h,取幼鼠進行斷頭取腦,取左側腦組織,例用含有蛋白酶抑制劑的RIPA裂解液提取腦組織蛋白。4℃下10 000×g離心8 min后取上清,BCA蛋白濃度檢測試劑盒檢測總蛋白,10%SDS-PAGE分離膠分離蛋白,半干法轉移蛋白至PVDF膜上。PBS配制的5%脫脂乳對膜進行封閉,4℃過夜。棄封閉液,PBS緩沖液清洗膜5次,每次4 min。LC3-Ⅰ、LC3-Ⅱ、Beclin-1、p-Akt、p-mTOR、p-S6 蛋白抗體及內參GADPH蛋白抗體作為一抗,室溫孵育3 h。棄溶液,PBS緩沖液洗滌5次,每次4 min。室溫條件下,HRP綴合的二抗孵育1.5 h。利用Image J軟件分析條帶灰度,評估蛋白相對表達量。
1.6 統計學處理 應用SPSS20.0統計軟件。計量資料以(x±s)表示,兩組間比較行t檢驗。P<0.05為差異具有統計學意義。
2 結 果
2.1 各組新生大鼠大腦皮質超微結構 見圖1,表1。假手術組神經元結構正常,細胞核、線粒體、粗面內質網、高爾基體及溶酶體均正常存在。模型組中觀察到皮質神經元中存在大量的自噬體和自噬溶酶體,其泡狀自噬體中包裹有可見的細胞質結構。相較于模型組,高劑量組、中劑量組、低劑量組中自噬體數量明顯減少,且呈一定的劑量依賴性(P<0.05)。
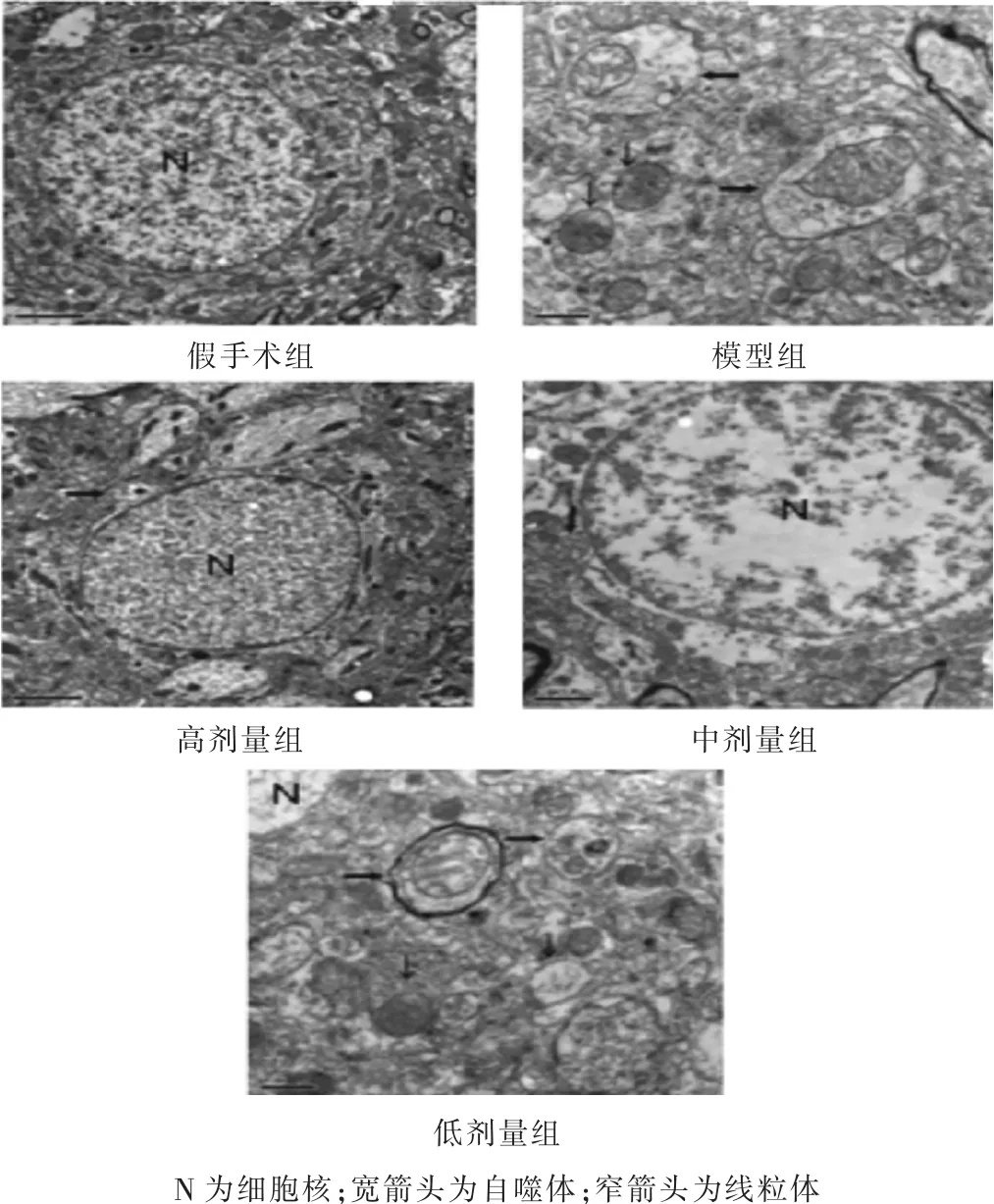
圖1 各組新生大鼠大腦皮質超微結構(乙酸雙氧鈾和硝酸鉛染色,5000倍)
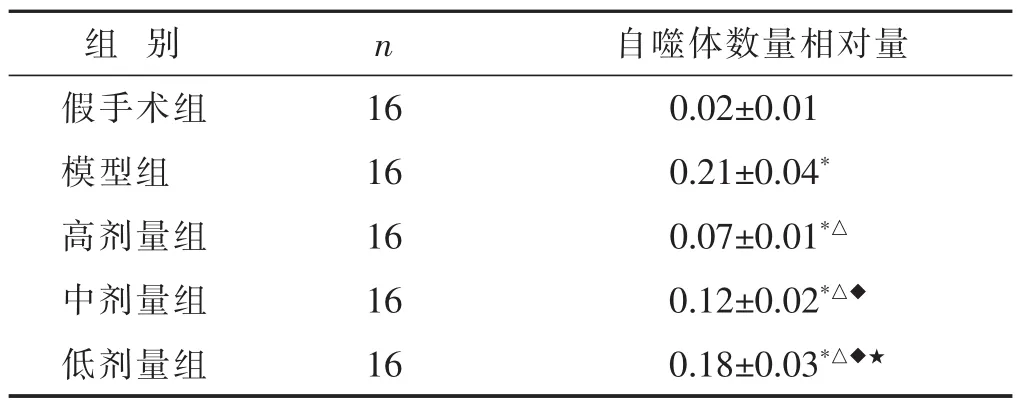
表1 各組新生大鼠大腦皮質超微結構(x±s)

圖2 各組新生大鼠腦梗死組織切片
2.2 各組新生大鼠腦梗死比較 與假手術組比較,模型組中幼鼠大腦皮質、海馬等區域呈現明顯的大面積白色梗死。與模型組比較,高劑量組、中劑量組、低劑量組中幼鼠腦梗死程度均有所改善。見圖2。對各組中幼鼠腦梗死面積進行定量,發現與假手術組比較,模型組中幼鼠腦梗死面積顯著增加 (P<0.05)。與模型組比較,高劑量組、中劑量組、低劑量組腦梗死面積顯著減小,且呈一定的劑量依賴性(P<0.05)。見表2。
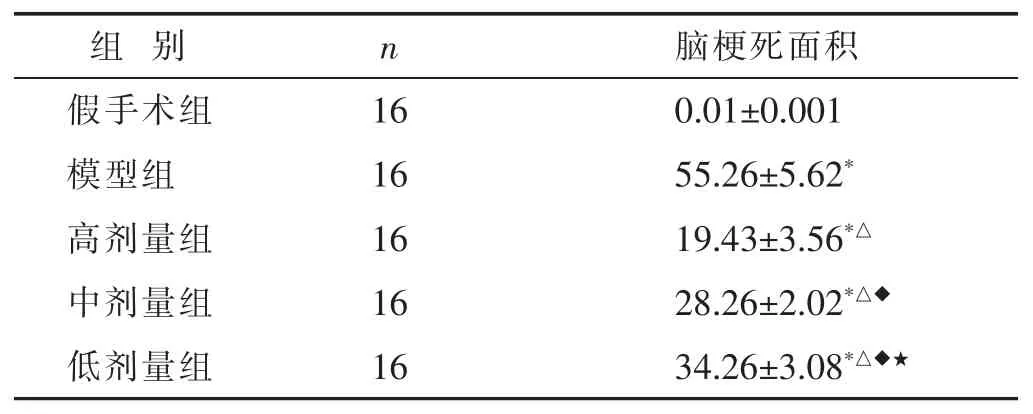
表2 各組新生大鼠腦梗死情況比較(%,x±s)
2.3 各組新生大鼠腦組織自噬蛋白表達情況比較
見圖3,表3。與假手術組比較,模型組新生大鼠腦組織中 LC3-Ⅰ/(LC3-Ⅰ+LC3-Ⅱ)的比值顯著增高,差異具有統計學意義(P<0.05)。與模型組比較,高劑量組、中劑量組、低劑量組新生大鼠腦組織中LC3-Ⅰ/(LC3-Ⅰ+LC3-Ⅱ)的比值顯著降低,呈劑量依賴性(P<0.05)。模型組新生大鼠腦組織中Beclin-1蛋白表達水平與假手術組比較顯著上升(P<0.05)。與模型組比較,高劑量組、中劑量組、低劑量組新生大鼠腦組織中Beclin-1蛋白表達水平顯著下降,且呈劑量依賴性(P<0.05)。

圖3 各組新生大鼠腦組織自噬蛋白表達情況
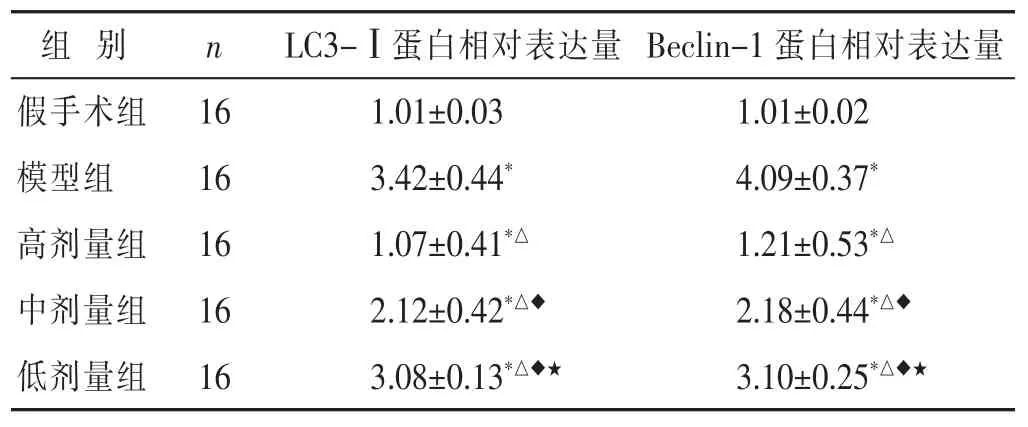
表3 各組新生大鼠腦組織自噬蛋白表達情況比較(x±s)
2.4 各組新生大鼠腦組織中p-Akt表達情況比較
見圖4,表4。與假手術組比較,模型組新生大鼠腦組織中p-Akt蛋白的表達水平顯著降低(P<0.05)。與模型組比較,高劑量組、中劑量組、低劑量組新生大鼠腦組織中p-Akt蛋白的表達水平顯著升高,呈劑量依賴性(P<0.05)。
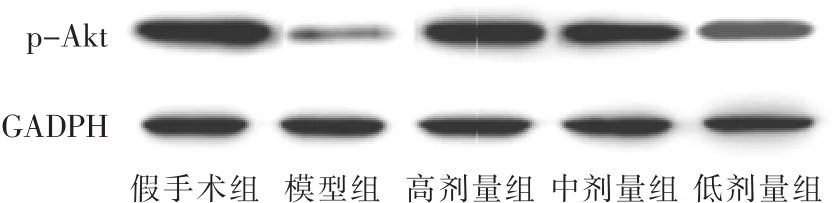
圖4 各組新生大鼠腦組織中p-Akt表達情況
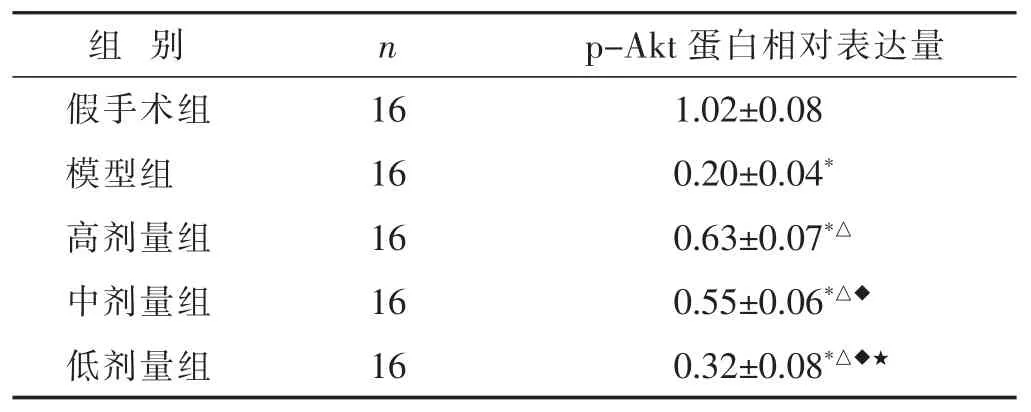
表4 各組新生大鼠腦組織中p-Akt表達情況比較(x±s)
2.5 各組新生大鼠腦組織中p-mTOR表達情況比較見圖5,表5。與假手術組比較,模型組新生大鼠腦組織中p-mTOR蛋白的表達水平顯著降低(P<0.05)。相較于模型組,高劑量組、中劑量組、低劑量組新生大鼠腦組織中p-mTOR蛋白的表達水平呈顯著升高,且呈劑量依賴性(P<0.05)。

圖5 各組新生大鼠腦組織中p-mTOR表達情況
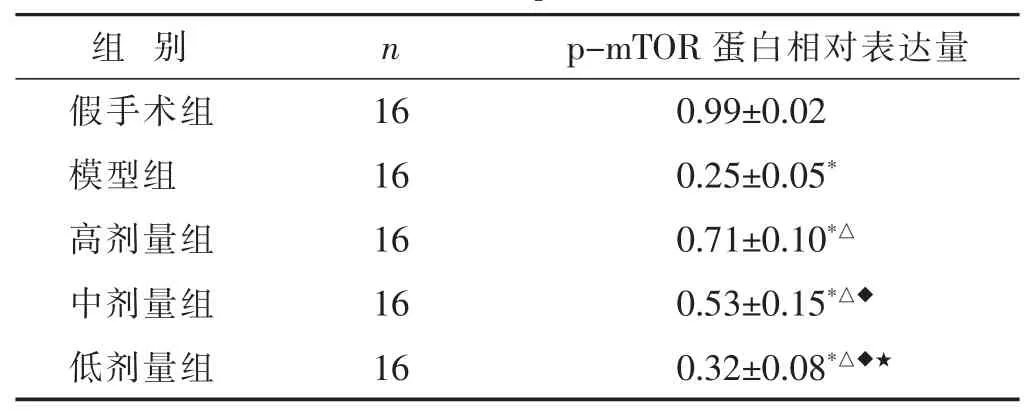
表5 各組新生大鼠腦組織中p-mTOR表達情況比較(x±s)
2.6 各組新生大鼠腦組織中p-S6表達情況比較 見圖6,表6。相較于假手術組,模型組新生大鼠腦組織中p-S6蛋白的表達水平顯著降低(P<0.05)。相較于模型組,高劑量組、中劑量組、低劑量組新生大鼠腦組織中p-S6蛋白的表達水平呈顯著升高,且呈劑量依賴性(P<0.05)。

圖6 各組新生大鼠腦組織中p-S6表達情況
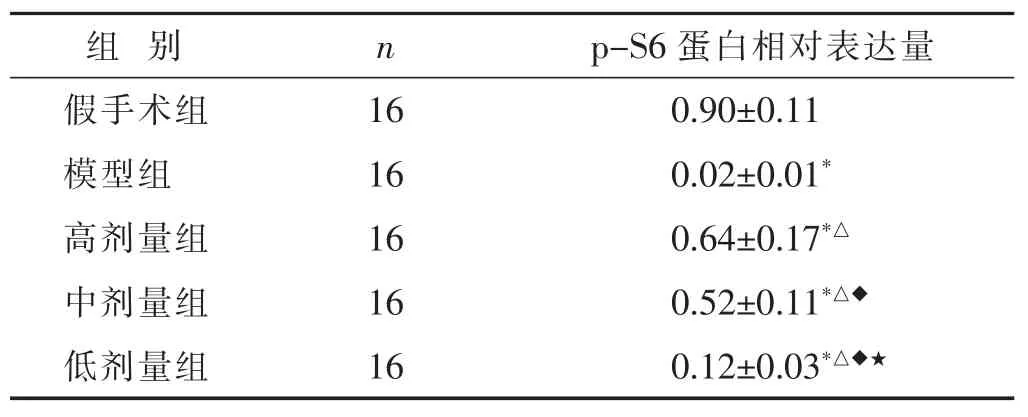
表6 各組新生大鼠腦組織中p-S6表達情況比較(x±s)
3 討 論
HIBD的發生機制極其復雜,與氧自由基、神經元自噬、神經元凋亡等密切相關[9]。相關研究指出,大腦發生缺氧缺血早期便可引起細胞凋亡及神經元病理性自噬等[10]。本研究實驗顯示,與假手術組比較,模型組中幼鼠大腦皮層、海馬等區域呈現明顯的大面積白色梗死,表明造模成功;高劑量組、中劑量組、低劑量組中腦梗死面積較模型組顯著減小,且呈一定的劑量依賴性,表明丹參酮ⅡA能有效改善腦梗死情況。
自噬是降解細胞內蛋白和損傷細胞器,穩定細胞環境的主要方式[11]。相關研究指出,當自噬處于穩態平衡時對機體具有保護作用,但當自噬平衡狀態打破時,將導致機體出現損傷[12]。 Lu 等[13]研究中發現,新生大鼠缺血缺氧性腦損傷模型中自噬體數量明顯增加,自噬標志蛋白表達水平明顯上升,當自噬抑制劑作用于模型可顯著降低自噬體數量,抑制神經細胞凋亡,其認為自噬的激活對新生大鼠HIBD具有促進作用。相關研究發現,LC3(微管相關蛋白輕鏈3)可作為自噬形成標志物,當細胞受到某種刺激,位于細胞內的LC3-Ⅰ將脂質化為LC3-Ⅱ,參與形成自噬體,因此可根據分析LC3-Ⅱ/(LC3-Ⅰ+LC3-Ⅱ)的比值是否上調判斷自噬體的形成[14]。還有研究證實,Beclin-1為除 LC3外與自噬密切相關的蛋白,主要參與自噬過程啟動[15]。本研究結果發現,模型組中觀察到皮質神經元中存在大量的自噬體和自噬溶酶體,其中泡狀自噬體中包裹有可見的細胞質結構,同時與模型組比較,高劑量組、中劑量組、低劑量組中自噬體數量明顯減少,且呈一定的劑量依賴性。同時本研究結果還發現,模型組中LC3-Ⅱ/(LC3-Ⅰ+LC3-Ⅱ)的比值和Beclin-1蛋白表達水平較假手術組均顯著降低,表明缺氧缺血破壞神經元內穩定環境,造成蛋白錯誤修飾及細胞器損傷,從而通過上調Beclin-1蛋白表達水平啟動自噬,LC3-Ⅰ脂質化,形成自噬體。與模型組比較,高劑量組、中劑量組、低劑量組新生大鼠腦組織中LC3-Ⅱ/(LC3-Ⅰ+LC3-Ⅱ)的比值和Beclin-1蛋白表達水平顯著下降,且呈劑量依賴性,提示丹參酮ⅡA可通過抑制LC3-Ⅱ/(LC3-Ⅰ+LC3-Ⅱ)的比值和Beclin-1蛋白表達水平,抑制自噬過程。
Akt-mTOR信號轉導通路是哺乳動物腫瘤免疫中的重要信號通路,其對調節細胞的生長、增殖、自噬以及凋亡有重要的作用[16]。Akt被相關因子激活磷酸化,發生空間轉移,由胞漿轉移至細胞核,進而調控下游如mTOR、Caspase-9、cyclin-D1等相應的信號分子,其中mTOR發生磷酸化激活下游p70S6K,促進核糖體蛋白S6發生磷酸化,從而調控細胞自噬,此調節過程與自噬的形成具有負相關性[17]。Makhov等通過蓽茇明堿對mTOR信號影響的研究中發現,蓽茇明堿能有效抑制細胞中Akt靶蛋白的磷酸化,下調Akt可有效抑制下游mTORC1的活性與細胞自噬[18]。本研究實驗發現,與假手術組比較,模型組新生大鼠腦組織中p-Akt、p-mTOR、p-S6蛋白的表達水平均顯著降低,提示Akt-mTOR信號轉導通路參與調節神經元自噬,且呈負調節作用。與模型組比較,高劑量組、中劑量組、低劑量組新生大鼠腦組織中p-Akt、p-mTOR、p-S6蛋白表達水平均升高,并呈劑量依賴性,提示丹參酮ⅡA對Akt-mTOR信號轉導通路具有正調節作用。
綜上所述,丹參酮ⅡA對新生大鼠缺血缺氧性腦損傷具有顯著的改善作用,大腦皮質神經元自噬受到顯著的抑制,推測其機制可能為通過激活Akt-mTOR信號轉導通路,抑制神經元自噬,從而改善腦損傷情況。然而,缺血缺氧性腦損傷是一個極其復雜的過程,其具體調節機制還有待進一步研究。

