L-2-氨基丁酸大腸桿菌生產菌株的構建
王婷,韓超,毛倩,張德志,蔡檸勻,劉宏亮,李燕軍,2,3,陳寧,2,3*
1(天津科技大學 生物工程學院,天津,300457) 2(代謝控制發酵技術國家地方聯合工程實驗室(天津科技大學),天津,300457)3(教育部工業發酵微生物重點實驗室(天津科技大學),天津,300457)
L-2-氨基丁酸是一種非天然的手性α-氨基酸,并不參與蛋白質的合成。L-2-氨基丁酸具有增強6-磷酸葡萄糖酯酶活性、抑制人體神經信息傳遞和提高神經元與神經膠質細胞新陳代謝速度的功能。它常被用作化工材料和手性化合物,同時也是多種藥物合成的中間體。利用L-2-氨基丁酸合成的新型藥物有抑制結核桿菌、治療疥病的鹽酸乙胺丁醇、治療癲癇的利維西坦、內皮素及其受體拮抗劑,以及連氮絲菌素(Azinothricin)類抗菌藥物等[1-3]。
L-2-氨基丁酸的合成方法有化學合成法[4]、酶催化法、細胞轉化法和發酵法。利用微生物進行細胞轉化或直接發酵生產L-2-氨基丁酸是特異性強、條件溫和、綠色無污染的方式。李國龍[5]在大腸桿菌中過表達蘇氨酸脫氨酶與ω-轉氨酶,用來轉化底物L-蘇氨酸和異丙胺合成L-2-氨基丁酸。目前通過微生物發酵法合成L-2-氨基丁酸鮮有報道,構建遺傳穩定的L-2-氨基丁酸高產菌株具有重要的現實意義。
通過基因工程手段延伸已有產品的代謝途徑,來生產人們所需的產品已經有許多成功的報道。CHOI等[6]在大腸桿菌中引入歐文氏菌crtEXYIB操縱子,延伸1-脫氧-5-磷酸代謝途徑來生產番茄紅素。SHEN等[7]引入乳酸菌2-酮酸脫羧酶(Kivd)和酵母菌乙醇脫氫酶(ADH2),延伸L-蘇氨酸途徑將L-2-酮基丁酸生成1-丙醇和1-丁醇等。另外,引入L-2-羥基丁酸脫氫酶還可以還原L-2-酮基丁酸為L-2-羥基丁酸,進而聚合成生物材料聚羥基丁酸(polyhydroxyalkanoates, PHA)等。
從生物合成途徑來看,L-2-氨基丁酸是L-蘇氨酸的下游產物,L-蘇氨酸在蘇氨酸脫水酶的作用下生成L-2-酮丁酸,L-2-酮丁酸在不同氨基酸轉氨酶、氨基酸脫氫酶作用下生成L-2-氨基酸丁酸(圖1)。
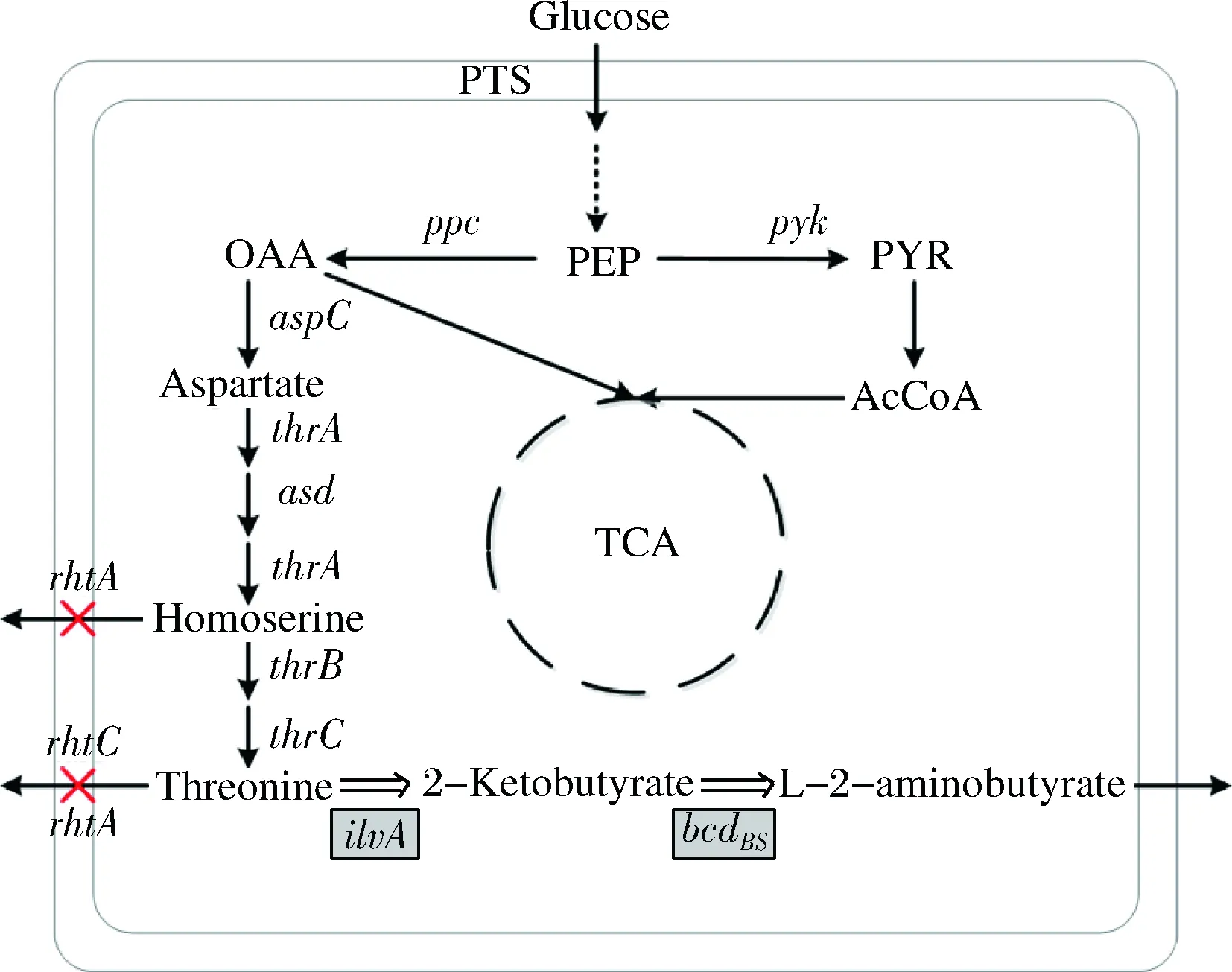
圖1 大腸桿菌L-2-氨基丁酸合成途徑
Fig.1 The biosynthesis pathway ofL-2-aminobutyrate inE.coli
注:黑色線條表示內源途徑,雙線條表示重構途徑。
叉號表示基因敲除,陰影方框表示延伸途徑中關鍵基因。
BS代表基因來源枯草芽孢桿菌
因此,通過延伸L-蘇氨酸的代謝途徑合成L-2-氨基酸丁酸是比較理想的選擇。本研究以L-蘇氨酸生產菌E.coliTHRD出發,通過不同酶的選擇延伸代謝途徑合成L-2-氨基酸丁酸,同時考察了阻斷L-蘇氨酸輸出途徑對L-2-氨基丁酸合成的影響。
1 材料與方法
1.1 實驗材料
1.1.1 菌種與質粒
L-蘇氨酸生產菌E.coliTHRD保藏于天津科技大學菌種保藏中心,編號為TCCC11825。菌株E.coliW3110、E.colidh5α、Bacillussubtilis168和Methanococcusjannaschii為本研究室保藏,THRDΔrhtA、THRLΔrhtC和THRLΔrhtAΔrhtC為本實驗構建。質粒pTrc99a、pKD3、pKD46、pCP20為本研究室保藏,其他質粒為本實驗構建。
1.1.2 酶與試劑盒
HS DNA聚合酶、QuickCut限制性內切酶和Solution I連接酶購自寶生物工程(Takara)有限公司(大連),Taq PCR MasterMix購自諾維贊(Vazyme)生物工程有限公司(南京),PCR產物純化試劑盒、膠回收試劑盒和質粒提取試劑盒購自Omega Bio-tek公司。
1.1.3 儀器與設備
Universal 320冷凍離心機,德國Hettich公司;MiniSpin臺式高速離心機,德國Eppendorf公司;LRH-250A培養箱,廣東醫療器械廠;ZWYR-P2403疊式搖床,上海智誠分析儀器制造有限公司;Mastercycler nexus PCR儀,德國Eppendorf公司;電擊轉化儀,德國Eppendorf公司;移液器,德國Eppendorf公司;德國Eppendorf公司;DYY-6C電泳儀,北京六一儀器廠;WD-9403C紫外分析儀,北京六一儀器廠;752紫外分光光度計,上海精密科學儀器有限公司;Thermo U3000高效液相色譜儀,美國Thermo公司;5 L發酵罐,上海保興生物設備有限公司。
1.1.4 培養基
斜面活化培養基(g/L):葡萄糖1.0,蛋白胨10.0,牛肉膏5.0,酵母粉5.0,NaCl 2.5,瓊脂20.0,pH調至7.0~7.2,0.1 MPa、121 ℃滅菌20 min。
種子培養基:葡萄糖25.0 g/L,酵母粉10.0 g/L,蛋白胨6.0 g/L,(NH4)2SO42.0 g/L,KH2PO41.2 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 10.0 mg/L,MnSO4·H2O 10.0 mg/L,維生素(VB1、VB3、VB5、VB7、VB12)1.0 mg/L,VH0.3 mg/L,pH調至7.0~7.2,0.1 MPa、115 ℃滅菌20 min。
發酵培養基:葡萄糖40.0 g/L,酵母粉2.0 g/L,蛋白胨4.0 g/L,檸檬酸鈉1.0 g/L,KH2PO42.0 g/L,MgSO4·7H2O 0.7 g/L,FeSO4·7H2O 50.0 mg/L,MnSO4·H2O 50.0 mg/L,維生素VB1、VB3、VB5、VB7、VB12濃度均為0.8 mg/L,VH0.2 mg/L,pH調至7.0~7.2,0.1 MPa、115℃滅菌20 min。
1.2 實驗方法
1.2.1 質粒、菌株構建
1.2.1.1 引物設計
本研究所用引物采用Primer Premier 5軟件進行設計,所有引物見表1。

表1 本研究所用引物Table 1 Primers used in the study
續表1

引物序列(5′-3′)rhtC-3GGTGGGCGGTTGTGTAGGCTGGAGCTGCTTCrhtC-4CTGAAGACGCGCCATGGTCCATATGAATATCCTCCTrhtC-5GACCATGGCGCGTCTTCAGAGTAAGTCGGATAAGrhtC-6CAATCGCGTCGACATTTGTTC
注:下劃線代表酶切位點,斜體代表引物間重疊區域。
1.2.1.2 質粒構建與轉化
以實驗室已有的抗L-異亮氨酸反饋抑制的突變基因ilvA2[8]和ilvA4[9]為模板,分別以引物對ilvA2-S、ilvA2-A,和ilvA4-S、ilvA4-A擴增這2個突變基因。以限制性內切酶PstI、Hind III切割ilvA2、ilvA4和質粒pTrc99a。用Solution I連接酶分別連接pTrc99a和ilvA2,pTrc99a和ilvA4,獲得質粒pTrc99a-ilvA2和pTrc99a-ilvA4。
以引物tyrB-S、tyrB-A擴增大腸桿菌酪氨酸轉氨酶基因tyrB。以KpnI和XbaI雙酶切質粒pTrc99a-ilvA2和片段tyrB。用Solution I將二者連接起來,獲得質粒pTrc99a-tyrB-ilvA2。采用類似的方法構建來源于枯草芽孢桿菌亮氨酸脫氫酶基因bcdBS、大腸桿菌谷氨酸脫氫酶基因gdh,和ilvA2串聯表達的質粒pTrc99a-bcdBS-ilvA2和pTrc99a-gdh-ilvA2。
質粒轉化采用CaCl2介導的方法,具體為將質粒加入冰浴20 min的E.coliTHRD感受態細胞,42 ℃熱激1 min、冰浴2 min,復蘇1 h后涂布添加相應抗生素的LB固體培養基培養皿,37 ℃過夜培養,采用菌落PCR鑒定陽性轉化子。
1.2.1.3 基因敲除菌株構建
基因敲除采用Red同源重組方法進行。
分別以引物對rhtA-1/rhtA-2和rhtA-5/rhtA-6擴增待敲除基因rhtA的上、下游同源臂序列,以引物rhtA-3、rhtA-4擴增氯霉素抗性基因cat。以rhtA-1、rhtA-6引物進行重疊PCR反應獲得敲除rhtA的DNA片段(兩端為rhtA基因同源臂、中間為抗性基因序列)。采用同樣方法獲得敲除rhtC的DNA片段。
將純化的DNA片段采用電轉化方法轉入攜帶pKD46的E.coli感受態細胞。涂布含有氯霉素的固體培養基,菌落PCR鑒定獲得正確的轉化子,即為片段重組到基因組的菌株。丟失溫敏質粒pKD46后,制備感受態細胞,轉化pCP20質粒,涂布含有氨芐青霉素的固體培養基,鑒定獲得陽性轉化子。通過對點含有抗性的固體培養基,獲得在氯霉素不生長、在氨芐青霉素生長的菌落,即為基因組上氯霉素抗性消除的菌株。最后,在42 ℃下培養丟失pCP20質粒。
利用上述方法敲除L-高絲氨酸和L-蘇氨酸輸出蛋白編碼基因rhtA和rhtC,獲得E.coliTHRDΔrhtA、THRDΔrhtC和THRDΔrhtAΔrhtC菌株。
1.2.2 發酵方法
搖瓶發酵:從新鮮活化斜面上挑取2環菌體接種于種子培養基中(500 mL三角瓶裝液量30 mL,添加相應抗生素)。置于搖床中200 r/min、36 ℃培養至OD600值約為12時,按10%接種量接入發酵培養基中,添加相應抗生素和IPTG(終濃度0.1 mmol/L),當葡萄糖耗盡時發酵結束。
5 L發酵罐發酵:吸取適量無菌水于3支新鮮的活化斜面,將菌懸液接入5 L發酵罐中進行種子培養,種子培養基裝液量為1.5 L。通過自動流加氨水控制pH在7.0左右,培養溫度36 ℃。培養至OD600值為12~14時,按13%接種量棄掉多余的種子培養基,接入新鮮的發酵培養基。發酵過程通過自動流加氨水控制pH在7.0左右,培養溫度36 ℃。菌體OD600=20時,添加終濃度為0.04 mmol/L的IPTG。以一定脈沖速度流加80%葡萄糖溶液,維持發酵液中葡萄糖濃度在菌體所需范圍。
1.2.3 檢測方法
菌體生物量測定:菌體生物量以菌體干重表示。取10 mL發酵液,13 000 r/min離心20 min,棄上清,菌體用去離子水洗滌2次,置于55 ℃恒溫干燥箱中至恒重,用分析天平稱重。發酵液稀釋適當倍數后,測定600 nm波長下的OD值。繪制OD600值與干重對應的標準曲線。
葡萄糖濃度測定:采用SBA-40C生物傳感儀測定。取發酵液1 mL離心2 min,取上清液10 μL,稀釋100倍后,取25 μL稀釋液直接進樣讀數。
L-蘇氨酸濃度測定:采用高效液相色譜法測定發酵液中蘇氨酸的含量。取1 mL發酵液于1.5 mL離心管中,12 000 r/min離心2 min,上清液過φ0.22 μm膜。用2,4-二硝基氟苯(DNFB)進行柱前衍生。色譜分離條件:色譜柱為Agilent ZORBAX Eclipse AAA(4.6 mm × 150 mm,5 μm),流動相A為乙酸鈉緩沖液,流動相B為乙腈,采用二元梯度混合,流速1.0 mL/min,柱溫33 ℃,檢測波長360 nm。
有機酸濃度測定:采用高效液相色譜法測定發酵液中L-2-氨基丁酸和L-2-酮基丁酸的含量。取1 mL發酵液于1.5 mL離心管中,12 000 r/min離心2 min,上清液過0.22 μm膜。色譜分離條件:色譜柱為Bio-Rad Aminex HPX-87H,300 mm×7.8 mm),流動相為5 mmol/L H2SO4,柱溫30 ℃,流速0.5 mL/min,檢測波長215 nm。
2 結果與討論
2.1 表達蘇氨酸脫水酶將L-蘇氨酸轉化為L-2-酮基丁酸
2.1.1 過表達ilvA基因菌株的搖瓶發酵
L-蘇氨酸首先在蘇氨酸脫水酶催化下生成L-2-酮基丁酸,然后L-2-酮基丁酸再通過轉氨基作用生成L-2-氨基丁酸。我們采取逐步延伸L-蘇氨酸代謝途徑的策略,首先過表達蘇氨酸脫水酶(由ilvA基因編碼),該酶受到L-異亮氨酸的反饋抑制。前期工作中,我們實驗室保存了2個ilvA突變體ilvA2[8]和ilvA4[9],本研究將這2個突變體在pTrc99a中過表達,導入E.coliTHRD中。對菌株THRD/pTrc99a、THRD/pTrc99a-ilvA2和THRD/pTrc99a-ilvA4進行搖瓶發酵,測定菌體生物量、L-蘇氨酸和L-2-酮基丁酸積累量,結果如表2。

表2 過表達ilvA菌株搖瓶發酵結果Table 2 The fermentation profiles of ilvA overexpressionstrains
注:a-菌生物量以菌體干重表示。
由表2可知,與對照THRD/pTrc99a相比,THRD/pTrc99a-ilvA2和THRD/pTrc99a-ilvA4的細胞干重大幅減少,但二者之間無明顯差別。對照菌株產生23.4 g/LL-蘇氨酸,并不積累L-2-酮基丁酸。攜帶重組質粒菌株在蘇氨酸脫氨酶的作用下,L-蘇氨酸積累量下降90%左右,生成較高濃度的L-2-酮基丁酸。THRD/pTrc99a-ilvA2和THRD/pTrc99a-ilvA4的L-2-酮基丁酸積累量分別為9.2 g/L和8.3 g/L,葡萄糖到L-2-酮基丁酸的轉換率分別為15.4%和13.8%。由此可知,ilvA2比ilvA4具有更強的L-蘇氨酸轉化能力。
2.1.2 菌株THRD/pTrc99a-ilvA2的5 L發酵罐分批補料發酵
以THRD/pTrc99a為對照,對菌株THRD/pTrc99a-ilvA2進行了5 L發酵罐分批補料發酵,菌體生物量、L-蘇氨酸和L-2-酮基丁酸積累量結果如圖2。
由圖2可見,在發酵前期,菌株THRD/pTrc99a-ilvA2與對照THRD/pTrc99a的生長速率無顯著差異,但是在穩定期,THRD/pTrc99a-ilvA2的生物量僅為對照的一半左右。發酵4~16 h是THRD/pTrc99a的快速產酸期,L-蘇氨酸的最終積累量為118 g/L。同樣,菌株THRD/pTrc99a-ilvA2在4~16 h時快速合成L-2-酮基丁酸,最終可積累18 g/L;而發酵過程中并沒有出現L-蘇氨酸的過量積累,發酵液中始終維持約2 g/LL-蘇氨酸,說明蘇氨酸脫水酶的表達有效的將細胞合成的L-蘇氨酸轉化為L-2-酮基丁酸。然而,L-2-酮基丁酸的最高產量只有18 g/L,原因可能是當其積累到一定濃度時對細胞具有較強的抑制作用[10],導致菌體生長變慢和蘇氨酸合成受阻。
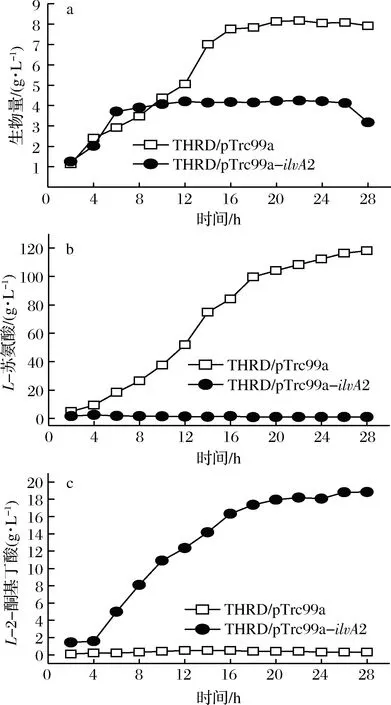
a-生物量;b-L-蘇氨酸;c-L-2-酮基丁酸圖2 E. coli THRD/pTrc99a和THRD/pTrc99a-ilvA25 L發酵罐發酵過程曲線Fig.2 The fed-batch fermentation process of E. coliTHRD/pTrc99a and THRD/pTrc99a-ilvA2 in a 5 L fermenter
2.2 延伸代謝途徑將L-2-酮基丁酸轉化為L-2-氨基丁酸
2.2.1 串聯表達tyrB、gdh和bcdBS菌株搖瓶發酵
酪氨酸轉氨酶、谷氨酸脫氫酶和亮氨酸脫氫酶均可以催化L-2-酮基丁酸合成L-2-氨基丁酸。本研究在pTrc99a-ilvA2質粒中串聯表達來源于大腸桿菌的酪氨酸轉氨酶編碼基因tyrB、谷氨酸脫氫酶基因gdh和來源于枯草芽孢桿菌的亮氨酸脫氫酶基因bcdBS,將重組質粒導入E.coliTHRD。對3株菌進行了搖瓶培養,定時取樣測定了菌體生物量、L-蘇氨酸、L-2-酮基丁酸和L-2-氨基丁酸積累量(圖3)。

圖3E.coliTHRD/pTrc99a-tyrB-ilvA2、THRD/pTrc99a-
gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2搖瓶發酵結果
Fig.3 Shake flask fermentation of strainsE.coliTHRD/
pTrc99a-tyrB-ilvA2, THRD/pTrc99a-gdh-ilvA2 and
THRD/pTrc99a-bcdBS-ilvA2
由圖3可知,發酵結束時菌株THRD/pTrc99a-tyrB-ilvA2、THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2的生物量比THRD/pTrc99a要顯著降低,但是比THRD/pTrc99a-ilvA2(2.6 g DCW/L,
表1)略高一些。串聯表達tyrB基因之后,L-2-酮基丁酸仍有9.3 g/L的積累,但是同時也產出4.1 g/LL-2-氨基丁酸。串聯表達gdh和枯草芽胞桿菌的bcd基因之后,菌株的L-2-酮基丁酸積累量顯著降低至僅約1.0 g/L,同時二者均產生較高質量濃度的L-2-氨基丁酸,分別為9.0 g/L和7.9 g/L。由此可見,在過表達ilvA2的基礎上,再串聯表達谷氨酸脫氫酶和亮氨酸脫氫酶基因,均能高效地將細胞內積累的L-2-酮基丁酸轉化為L-2-氨基丁酸。因此,我們對菌株THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2進行了5 L發酵罐發酵測試。
2.2.2E.coliTHRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2的5 L發酵罐分批補料發酵
在5 L罐發酵過程中對兩株菌進行定時取樣,測定了生物量L-蘇氨酸、L-2-酮基丁酸和L-2-氨基丁酸積累量,發酵過程曲線如圖4所示。菌株THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2發酵前期生物量迅速積累,在8 h左右時達到最高值。之后THRD/pTrc99a-bcdBS-ilvA2的生物量保持緩慢下降的狀態,而THRD/pTrc99a-gdh-ilvA2的生物量則快速下降。分析原因可能是從發酵8 h開始,菌株THRD/pTrc99a-gdh-ilvA2開始快速合成L-2-酮基丁酸(終積累量達到17.8 g/L),造成了菌體的衰亡;與此同時,也有部分L-2-酮基丁酸轉化為L-2-氨基丁酸(終積累量為8.3 g/L)。而菌株THRD/pTrc99a-bcdBS-ilvA2
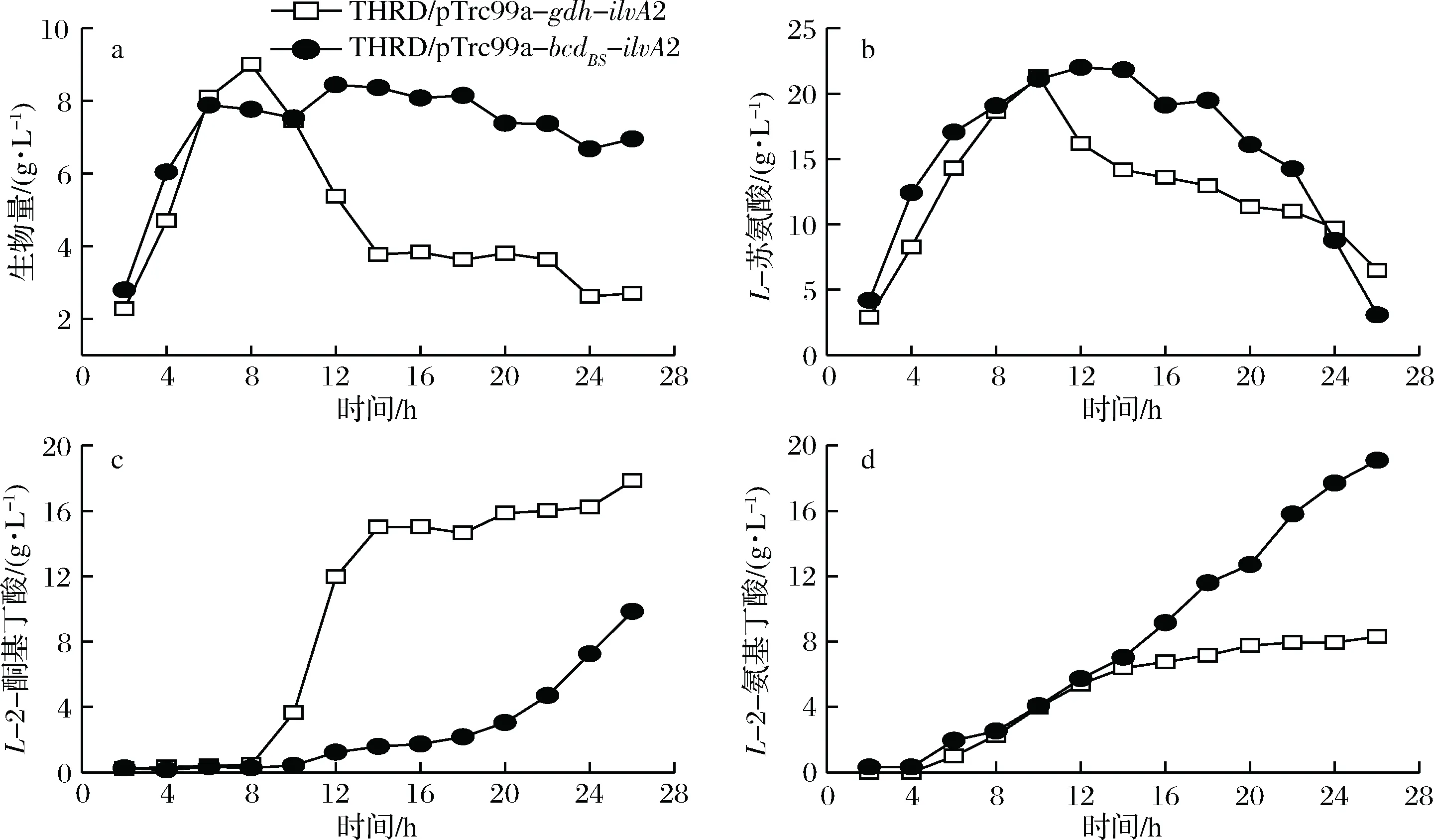
a-生物量;b-L-蘇氨酸;c-L-2-酮基丁酸;d-L-2-氨基丁酸圖4 E. coli THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2分批補料發酵過程曲線Fig.4 The fed-batch fermentation processes of E. coli THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2
在發酵過程中L-2-酮基丁酸和L-2-氨基丁酸均緩慢積累,終質量濃度分別達到8.3 g/L和19.1 g/L。我們之前的研究發現L-2-酮基丁酸對大腸桿菌細胞的生長具有抑制作用。DANCHIN等[11]研究發現,L-2-酮基丁酸的添加會造成糖酵解反應中6-磷酸葡萄糖、6-磷酸果糖、1,6-二磷酸果糖,以及乙酰輔酶A的濃度下降。此外,L-2-酮基丁酸還會影響AMP的循環以及mRNA的翻譯,從而造成細胞生物量的下降。
5 L發酵罐發酵實驗結果與搖瓶發酵結果相差較大,也說明了在構建大腸桿菌工程菌株的過程中,在搖瓶發酵初步優化結果的基礎上,有必要及時進行發酵罐的測試。在搖瓶發酵中,菌株THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2發酵過程參數相當,二者均積累少量的L-2-酮基丁酸,THRD/pTrc99a-gdh-ilvA2的L-2-氨基丁酸產量甚至超過THRD/pTrc99a-bcdBS-ilvA2(圖3)。在5 L發酵罐發酵過程中,2株菌L-2-酮基丁酸和L-2-氨基丁酸的總濃度相當,然而THRD/pTrc99a-gdh-ilvA2的L-2-酮基丁酸積累量顯著高于L-2-氨基丁酸,而THRD/pTrc99a-bcdBS-ilvA2則恰好相反(圖4)。因此,我們選擇THRD/pTrc99a-bcdBS-ilvA2進行后續研究。
在5 L罐發酵過程中,培養基L-蘇氨酸呈現先積累(超過20 g/L)后消耗的趨勢(圖4),說明在發酵前期,L-蘇氨酸不能完全被轉化而排出細胞,在發酵后期隨著胞內L-蘇氨酸的消耗,胞外的L-蘇氨酸逐漸進入細胞。由于L-蘇氨酸的跨膜運輸需要消耗能量,因此我們探索了阻斷L-蘇氨酸的運輸途徑對L-2-氨基丁酸發酵的影響。
2.3 阻斷L-蘇氨酸輸出途徑對L-2-氨基丁酸發酵的影響
2.3.1 敲除L-蘇氨酸分泌蛋白基因各菌株搖瓶發酵
大腸桿菌L-蘇氨酸分泌蛋白有RhtA、RhtB和RhtC,其中RhtA同時可以輸出L-高絲氨酸[12-13]。為了研究阻斷L-蘇氨酸輸出途徑對發酵的影響,本研究借助RED重組基因編輯方法[14],單獨和組合敲除了E.coliTHRD中rhtA和rhtC基因,獲得菌株THRDΔrhtA、THRDΔrhtC和THRDΔrhtAΔrhtC。將質粒pTrc99a-bcdBS-ilvA2轉化入這3株菌中進行搖瓶發酵實驗,結果如圖5所示。

圖5E.coliTHRD/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/
pTrc99a-bcdBS-ilvA2、THRDΔrhtA/pTrc99a-bcdBS-ilvA2和
THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2搖瓶發酵結果
Fig.5 Shake flask fermentation of strainsE.coliTHRD/
pTrc99a-bcdBS-ilvA2, THRDΔrhtC/pTrc99a-bcdBS-ilvA2,
THRDΔrhtA/pTrc99a-bcdBS-ilvA2 and THRDΔrhtAΔrhtC/
pTrc99a-bcdBS-ilvA2
由圖5可見,與對照菌株THRD/pTrc99a-bcdBS-ilvA2相比,菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/pTrc99a-bcdBS-ilvA2和THRDΔrhtAΔrhtC/ pTrc99a-bcdBS-ilvA2的生物量無明顯差異,說明敲除rhtA和rhtC基因對菌體生長影響不大。對照菌株L-蘇氨酸積累量為9.25 g/L,而3株敲除菌株的L-蘇氨酸積累量分別為4.9、5.1和1.1 g/L,降幅明顯,說明rhtA和rhtC基因的敲除對副產物L-蘇氨酸的減少具有顯著作用。4菌株的L-2-酮基丁酸積累量沒有太大差異,分別為1.0、2.5、1.4和1.1 g/L。而L-2-氨基丁酸的產量具有較大差異,對照菌株為7.9 g/L,其他3株菌分別達到13.5、11.2和4.5 g/L。分析以上結果可知,單敲除菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2和THRDΔrhtC/pTrc99a-bcdBS-ilvA2的L-蘇氨酸積累量下降,使得L-2-氨基丁酸的產量提高;雙敲除菌株THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2的L-蘇氨酸積累量最低,然而并沒有轉化為產物L-2-氨基丁酸,其產量卻下降了42.4%。雙基因敲除菌株雖然L-蘇氨酸積累量大幅降低,但仍有1.1 g/L的質量濃度,說明大腸桿菌還存在其他特異或非特異的L-蘇氨酸輸出途徑。另外,雙敲除菌株由于胞內L-蘇氨酸的快速積累,可能強化了其他代謝途徑,導致碳源流向其他副產物。
2.3.2 四菌株5 L發酵罐分批補料發酵
從搖瓶發酵結果可見,單獨敲除rhtA和rhtC后,較為顯著地提高了L-2-氨基丁酸的生產能力。為了進一步表征L-蘇氨酸/L-高絲氨酸輸出途徑缺失對L-2-氨基丁酸發酵的影響,以THRD/pTrc99a-bcdBS-ilvA2相比為對照,對菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/pTrc99a-bcdBS-ilvA2和THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2進行了5 L發酵罐分批補料發酵,結果如圖6所示。
由圖6可知,對照菌株THRD/pTrc99a-bcdBS-ilvA2在發酵過程中先積累L-蘇氨酸,在12 h后L-蘇氨酸逐漸轉化為L-2-酮基丁酸和L-2-氨基丁酸,二者質量濃度分別達到9.9 g/L和19.1 g/L。菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2在發酵2 h后,開始快速積累L-2-酮基丁酸,導致菌體生長受阻,在發酵過程中L-蘇氨酸沒有明顯積累;然而,在12 h后,L-2-酮基丁酸逐步轉化為L-2-氨基丁酸,最終產量達到13.7 g/L。菌株THRDΔrhtC/pTrc99a-bcdBS-ilvA2發酵過程曲線與對照菌株類似,不同的是生成更多L-蘇氨酸,且后期L-蘇氨酸更多的轉化為L-2-氨基丁酸,生成L-2-酮基丁酸的量相對較少。比較奇怪的是,雙敲除菌株THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2菌體生長最好,而生成L-蘇氨酸、L-2-酮基丁酸和L-2-氨基丁酸的量都很低,可能是阻斷L-蘇氨酸/L-高絲氨酸的分泌對產物合成途徑產生了調節作用,導致碳源流向菌體生長和其他副產物的合成。由此可見,改造L-蘇氨酸/L-高絲氨酸的輸出途徑對L-2-氨基丁酸的發酵產生了多樣化影響,與對照相比,敲除rhtC基因的菌株效果較好,但是仍積累了較高濃度的L-2-酮基丁酸。此外,可能由于L-蘇氨酸/L-高絲氨酸輸出途徑的阻斷對菌體特性影響較大,導致5 L發酵罐的發酵結果與搖瓶發酵相差較大,提示我們在今后研究中有必要對代謝工程改造的過程菌株也進行發酵罐測試。

a-生物量;b-L-蘇氨酸;c-L-2-酮基丁酸;d-L-2-氨基丁酸圖6 E. coli THRD/pTrc99a-bcdBS-ilvA2、THRDΔrhtA/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/pTrc99a-bcdBS-ilvA2和THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2分批補料發酵過程曲線Fig.6 The fed-batch fermentation processes of E. coli THRD/pTrc99a-bcdBS-ilvA2, THRDΔrhtA/pTrc99a-bcdBS-ilvA2,THRDΔrhtC/pTrc99a-bcdBS-ilvA2 and THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2
3 結論
L-2-氨基丁酸是一種非蛋白質氨基酸,在化工和制藥領域具有廣泛的應用前景。目前還沒有直接發酵法生產L-2-氨基丁酸的報道。本研究以1株L-蘇氨酸大腸桿菌生產菌株出發,通過延伸代謝途徑構建了L-2-氨基丁酸高產菌株。L-2-氨基丁酸最高產量達到22 g/L,但培養基中仍然存在一定濃度的L-蘇氨酸和L-2-酮基丁酸。本研究結果表明延伸代謝途徑合成下游產品的策略具有可行性,然而,如何將中間代謝物最大程度上轉化為目標產物具有一定的挑戰。本研究同時表明,對某些產品的合成而言,搖瓶發酵和發酵罐水平的發酵結果可能相差很大,在今后研究中應該重視這一現象。

