P17-BMP2聯合成骨誘導對大鼠骨髓間充質干細胞的影響
李佳濱 薛鋼 寧尚波 戴辛鵬 王晗
近些年來,隨著醫療技術的快速發展,對心血管疾病治療方法的研究也日漸深入。研究發現干細胞對修復損傷心肌細胞起到積極促進意義并逐漸成為潛在治療方法[1]。骨髓間充質干細胞是存在于骨髓內的成體干細胞,具備多種生物學特性,P17-BMP2 是BMP2 的核心功能區氨基酸序列合成的一條存在17 個核苷酸的寡肽BMP2,合成便捷,操作簡單,具有調控成骨方向分化、骨誘導性的作用[2]。本研究據此探討P17-BMP2 聯合成骨誘導對大鼠骨髓間充質干細胞增殖和成骨分化作用,現報道如下。
1 材料與方法
1.1 一般資料選取3 周齡Wistar 雄性大鼠9 只(由上海第九人民醫院動物實驗中心提供,許可證號:SYXK2012-0001),體質量60~70g;P17-BMP2 由清華大學合成提供;美國HyClone 公司生產的胰蛋白酶、DMEM-HG 及DMEM-LG 培養基;美國Gibca 生產的青霉素、特級胎牛血清、鏈霉素;美國Sigma 公司生產的β-甘油磷酸二鈉、地塞米松、抗壞血酸;美國Invitrogen 公司生產的Trizol;日本同仁化學研究所生產的CCK-8 試劑;日本IX70 公司生產的熒光顯微鏡;美國DU-800 公司生產的核酸蛋白分析儀;美國MX3000P 公司生產的熒光定量PCR 分析儀;美國Beckman 公司生產的高速冰凍離心機。
1.2 培養方法將9 只大鼠脫頸處死,經75%乙醇浸泡消毒5min,無菌環境下,將雙側脛骨、股骨取出,剪除骨端,以止血鉗壓碎,取含有20%胎牛血清、100mg/ml 青霉素、100mg/ml 鏈霉素的DMEM 完全培養基,對骨髓腔進行沖洗,均勻分散骨髓細胞,使用吸管打勻,加入離心管,1 500r/min 離心5min,丟棄上清,適量DMEM 打勻,制作單細胞懸液,取1ml 懸液置入25ml 培養瓶內,放置37℃、5%CO2孵育箱內,48h 后換液,隨后每72h 換液。待細胞匯合成80%~90%單層后,取0.25%胰蛋白酶消化進行傳代,繼續培養,取第3 代的細胞備用。隨后分成兩組進行培養,即A 組進行成骨誘導(含地塞米松7~10mg/L、維生素C 10mg/L、β-甘油磷酸鈉10mmol/L 的DMEM 培養基培養),B 組進行成骨誘導+P17-BMP2(成骨誘導液+P17-BMP2 10μg/ml培養)。
1.3 檢測方法第3 代細胞,經BMSCs 離心稀釋,吹打成濃度1×104cells/ml 的均勻單細胞懸液,接種在96 孔培養板,每孔置入100μl 細胞懸液量,設置3 個復孔、空白對照組(培養基100μl),孔板周圍加PBS 100μl,保持濕度。接種4 個96 孔板,置入CO2孵育箱培養,24h 后換液,隨后每72h 換液,在培養第1、3、5、7 天取出,每孔加10μl CCK-8 試劑,繼續置入CO2孵育箱,孵育4h,酶聯免疫測定法檢測各組吸光光度值,取3 個孔的OD 平均值,波長450nm。取3 只大鼠骨髓,反復3 次。
取第3 代細胞,接種在24 孔培養板內,各組培養基培養7 天。PBS 洗滌,反復3 次,置入4℃固定液,流水沖洗后晾干。底物以二甲基甲酰胺溶解后,倒入緩沖液內,并加入固紫B 混勻;取工作液,置于37℃水溫箱內,靜置45min,流水沖洗;顯微鏡下觀察;取3 只大鼠骨髓,反復3 次。
實時熒光定量PCR:按NCBI Cenebank 序列行引物設計,開蓋前先進行離心,置入DEPC 處理的ddH2O 稀釋,形成10nmol/μl 溶液,-20℃保存備用。OPN 引物序列:上游引物5'-CATCAGAGCCACGAG TTTCA-3';下游引物5'-TCAGGGCCCAAAACACTA TC-3';OCN引物序列:上游引物5'-TGCCTTCTGTCT GGGTGTCC-3';下游引物5'-GCTGTGCCGTCCATACT TTCG-3';Runx2引物序列:上游引物5'-CAACATCTCC ACATCATTAG-3';下游引物5'-TTATTACCCTCTCA AACACTG-3';β-Actin 引物序列:上游引物5'-TGG AATCCTG TGGCATCCATGAAACTA-3';下游引物5'-TAAAACGCAGCTCAGTAACAGTCCG-3'。在進行7、14 天培養后,收集細胞,使用Trizol 一步法,對細胞內總RNA 進行提取。每組設3 個復孔,采取Q-PCR 反復檢測。取3 只大鼠骨髓,反復3 次。
1.4 觀察指標①分析堿性磷酸酶活性檢測值,堿性磷酸酶活性(金氏單位/100ml)=測定空OD 值/標準空OD 值×標準孔含酚量×2000 堿性磷酸酶的金氏單位;②熒光顯微鏡下觀察細胞形態學特征;③分析培養細胞后細胞增殖、mRNA 表達。
1.5 統計學方法運用SPSS 20.0 統計學軟件處理數據。計量資料以±s表示,采用t檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 形態學特征在熒光顯微鏡下觀察,大鼠BMSCs接種后,24h 即會貼壁,48h 后見細胞貼壁,外觀呈纖維細胞樣,接種3~7 天后,細胞對數生長,增殖顯著,為單層生長。B 組大鼠在培養5~7 天后,細胞為橢圓形或多角形,為無規則堆積;細胞在融合生長期時,直徑變短,形態呈扁平狀,細胞核及細胞核仁清晰,見圖1。
2.2 兩組細胞增殖比較在培養細胞第1、3 天,A組、B 組BMSCs 細胞增殖程度比較差異無統計學意義(P>0.05),培養第5、7 天后,B 組BMSCs 細胞增殖程度明顯高于A 組,差異有統計學意義(P<0.05),見表1。
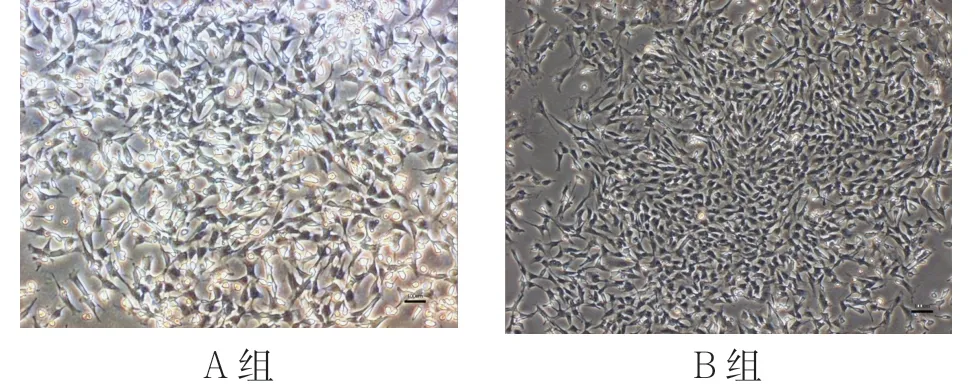
圖1 原代培養5~7 天
2.3 兩組mRNA 表達比較誘導第7、14 天,B 組OPN、OCN、Runx2 的mRNA 表達均高于A 組,差異有統計學意義(P<0.05),見表2。
2.4 兩組堿性磷酸酶活性比較誘導第14 天,B 組堿性磷酸酶活性值為(1.32±0.10)U/L,高于A 組的(1.15±0.11)U/L,差異有統計學意義(t=3.431,P=0.002)。
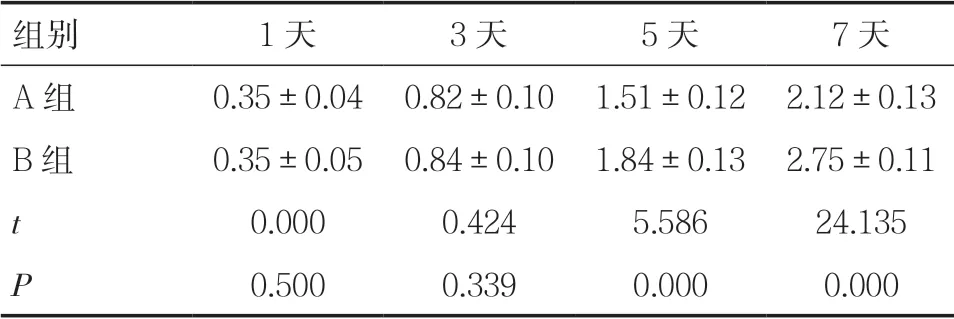
表1 兩組細胞增殖測定OD 值比較
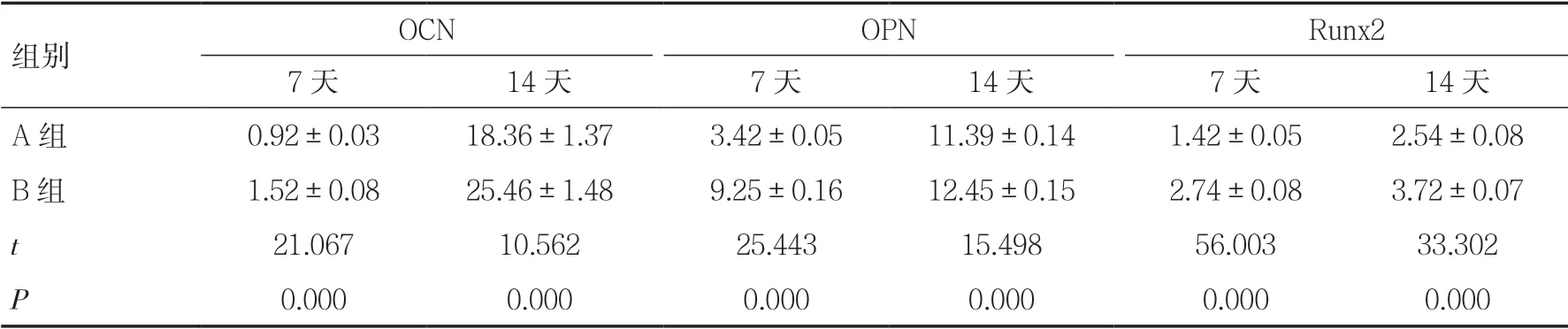
表2 OPN、OCN、Runx2 的mRNA 表達
3 討論
骨髓間充質干細胞生物特性較多,如可促進血管生成,抑制細胞凋亡及免疫特性,并有抗纖維化、抗炎作用;同時骨髓間充質干細胞存在多向分化能力,比如轉化為心肌細胞、內皮細胞、成骨細胞、脂肪細胞等多種細胞類型;另外骨髓間充質干細胞具有高增殖活性作用,成為理想的骨組織種子細胞[3]。
BMP2 是骨形態發生蛋白之一,屬于TGF-β超家族中的一員,與其他骨形態發生蛋白相比,對成骨誘導活性的強度最高,可高度促進骨形成及表達,并能促使特異性骨細胞產物的分泌、生 成[4]。BMP2 信號傳導途徑是利用Smads 或MAPK兩條途徑,促進轉錄因子Runx2 及Osx,進而促進成骨細胞特異性的基因表達。在成骨過程中,通過BMP2 刺激,使BMSCs 出現趨向、聚集、分化作用,以此形成軟骨及成骨。純天然BMP2 組成有114個氨基酸,但只有20 多個氨基酸真正發揮出骨誘導作用,組成核心結構。尤其是在實際臨床操作中,難以獲得純天然BMP2,操作復雜,獲取困難,因此臨床加大了對基因重組BMP2 的研究。P17-BMP2 是由17 個氨基酸組成的寡肽BMP2,活性特點明顯,合成簡單,通過細胞通訊及信息傳遞,可調控細胞成骨定向分化,具有骨誘導性;同時P17-BMP2 可使用多肽合成儀,在短期內大量制備小分子多肽,可減輕基因工程技術操作復雜程度,價格成本低;另外小分子多肽結構簡單,可充分暴露活性位點,并輕易結合細胞受體,形成不同劑型的多肽,具有較高的生物活性與穩定性。因此P17-BMP2 操作簡單,活性明顯,具有較高的臨床使用價值。
OPN、OCN 等是促進骨形成的特異性骨細胞產物,BMP-2 信號可激活轉錄因子Runx2 及Osx,以此激活成骨細胞特異性基因表達。堿性磷酸酶廣泛存在于人體的肝臟、骨骼、腸等組織,屬一組同工酶,主要用于骨骼、肝膽系統疾病的診斷和鑒別診斷。本組實驗發現,培養第5、7 天后,B 組BMSCs細胞增殖程度明顯高于A 組,誘導第7、14 天,B 組OPN、OCN、Runx2 的mRNA 表達均高于A 組,誘導第14 天,B 組堿性磷酸酶活性均高于A 組,差異有統計學意義(P<0.05)。研究提示,P17-BMP2 聯合成骨誘導有著促使骨生成,誘導成骨轉為軟骨的作用,誘發骨誘導活性。
為了實現體外組織工程骨體內植入實驗的要求,需密切監測組織相容性,骨體植入的功能狀態、愈合能力、再塑能力,觀察移植物的生物學功能、血管化程度等。為了確保異體植入物的準確結果,需先排除正位植入物因受體骨、骨膜成骨導致的假陽性。P17-BMP2 與成骨誘導能夠促使骨髓間充質干細胞向成骨方向分化,且P17-BMP2 與BMP2 相比,半衰期長,生物相容性高,適度降解性高,不影響BMP2 活性作用。
綜上所述,P17-BMP2 聯合成骨誘導能夠促進骨髓間充質干細胞增殖以及成骨分化,P17-BMP2和成骨誘導劑聯合作用在各個時間點均能促進大鼠骨髓間充質干細胞增殖,對骨髓間充質干細胞的促分化作用明顯,具有較高的可研究性。

